Stephanie Seneff, Anthony M Kyriakopoulos, Greg Nigh, e Peter A McCullough
Abstrato
A proteína príon humana e o dobramento incorreto da proteína semelhante ao príon são amplamente reconhecidos como tendo um papel causal em muitas doenças neurodegenerativas. Com base em evidências experimentais in vitro e in vivo relacionadas ao príon e à doença semelhante ao príon, extrapolamos a partir da evidência convincente de que a glicoproteína spike do SARS-CoV-2 contém sequências de aminoácidos estendidas características de uma proteína semelhante ao príon para inferir seu potencial de causar doenças neurodegenerativas. Propomos que a síntese da proteína spike induzida pela vacina pode facilitar o acúmulo de fibrilas tóxicas semelhantes ao príon nos neurônios. Descrevemos várias vias pelas quais essas proteínas podem ser distribuídas por todo o corpo. Revisamos tanto as patologias celulares quanto a expressão da doença que pode se tornar mais frequente naqueles que foram submetidos à vacinação de mRNA. Especificamente, descrevemos as contribuições da proteína spike, por meio de suas propriedades semelhantes ao príon, para a neuroinflamação e doenças neurodegenerativas; para distúrbios de coagulação na vasculatura; para maior risco de doença devido à regulação suprimida da proteína príon no contexto de resistência à insulina amplamente prevalente; e para outras complicações de saúde. Explicamos por que essas características semelhantes a príons são mais relevantes para proteínas spike induzidas por mRNA relacionadas à vacina do que para a infecção natural com SARS-CoV-2. Notamos com otimismo uma perda aparente de propriedades semelhantes a príons entre as variantes atuais do Ômicron. Reconhecemos que a cadeia de eventos patológicos descrita ao longo deste artigo é apenas hipotética e ainda não verificada. Também reconhecemos que as evidências que apresentamos, embora baseadas na literatura de pesquisa, são atualmente amplamente circunstanciais, não diretas. Por fim, descrevemos as implicações de nossas descobertas para o público em geral e discutimos brevemente as recomendações de saúde pública que consideramos que precisam de consideração urgente.
Uma versão anterior deste artigo foi publicada no servidor de pré-impressão da Authorea em 16 de agosto de 2022.
Palavras-chave: neurodegeneração, amiloidose, g quadruplexes, diabetes, monócitos cd16+, exossomos, vacinas de mRNA, doença de príons, proteína spike, sars-cov-2
Introdução e Contextualização
Doenças priônicas, também conhecidas como encefalopatias espongiformes transmissíveis (EETs), são um grupo de doenças cerebrais raras e consistentemente fatais que afetam animais e humanos. Elas são causadas por “partículas infecciosas proteináceas”, que podem facilitar a disseminação da doença na ausência de uma infecção clássica por um organismo vivo. Elas incluem a conhecida doença da vaca louca (encefalopatia espongiforme bovina), scrapie em ovelhas e doença de emagrecimento crônico (CWD) em veados. A principal doença priônica humana é conhecida como doença de Creutzfeldt-Jakob (CJD), e é sempre fatal. A insônia familiar fatal (FFI) é uma doença genética rara e fatal causada por certas mutações na proteína priônica. Na nomenclatura comum, a forma naturalmente dobrada da proteína priônica é referida como PrP C , enquanto a forma mal dobrada é chamada de PrP SC (para “scrapie”). A propagação da doença ocorre por meio de um processo autocatalítico pelo qual proteínas príons externas mal dobradas (PrP SC ) atuam como um agente infeccioso para facilitar o mal dobramento da mesma proteína expressa em neurônios. Agora é geralmente reconhecido que uma forma oligomérica solúvel intermediária da proteína é o agente tóxico. Em contraste, a placa insolúvel pode até ser protetora, pois resulta na limpeza dos oligômeros solúveis. Está se tornando cada vez mais aparente que há uma generalização de doenças príons que podem abranger doenças neurodegenerativas, como Alzheimer, doença de Parkinson e esclerose lateral amiotrófica (ELA), que também estão associadas a proteínas mal dobradas que se acumulam em placas e corpos de Lewy. Essas proteínas, que são denominadas amiloidogênicas, também foram rotuladas como “semelhantes a príons” e sua disseminação também pode ter propriedades que se sobrepõem à definição clássica mais rigorosa da proteína príon (PrP). Tanto a Tau quanto a α-sinucleína foram caracterizadas como amiloidogênicas. Além disso, os pesquisadores estão descobrindo que a proteína de ligação TAR-DNA de 43 kDa (TDP-43), uma proteína que se dobra incorretamente em associação com a ELA, forma agregados que se propagam entre as células de maneira semelhante ao príon. Os agregados de proteínas podem ser transmitidos de uma célula para outra por meio de pelo menos três mecanismos distintos: nanotubos de tunelamento, secreção como agregados nus ou empacotamento em vesículas extracelulares, como exossomos.
Um estudo notável envolveu uma variante mutada de uma proteína iniciadora de plasmídeo bacteriano, RepA, que constrói oligômeros amiloides intracelulares desencadeando uma cascata letal em bactérias, semelhante ao comprometimento mitocondrial de células humanas na neurodegeneração. Neste estudo, os autores trabalharam com uma linhagem de células de neuroblastoma humano projetada para expressar RepA de tipo selvagem. Uma variante de RepA com uma mutação A31V mostrou-se propensa a formar fibrilas amiloides. As células de neuroblastoma humano geneticamente modificadas foram cocultivadas com células murinas liberando agregados RepA mutados. As fibrilas amiloides liberadas das células murinas mostraram-se presentes no citosol de células receptoras humanas e eram citotóxicas. Assim, a amiloidose foi propagada das células murinas para as células humanas. Com base em seus resultados, esses autores declararam um “princípio central da biologia subjacente do príon”. “Não importa a origem biológica de uma dada proteína semelhante a príon, ela pode ser transmitida a uma célula receptora filogeneticamente não relacionada, desde que esta expresse uma proteína solúvel na qual a proteína recebida possa facilmente modelar sua conformação amiloide”. Eles declararam que a troca intercelular de agregados de proteínas semelhantes a príons pode ser um fenômeno comum. O artigo acima prepara o cenário para a narrativa que propomos aqui, a saber, que a proteína spike produzida em excesso por células humanas transfetadas com as vacinas de mRNA, análoga à proteína bacteriana semelhante a príon mutada, pode ser liberada como fibrilas amiloides e absorvida por neurônios que expressam várias proteínas amiloidogênicas, mais notavelmente a proteína príon, agindo como uma semente. Isso pode resultar em citotoxicidade e neurodegeneração, explicando muitos dos sintomas neurológicos observados como reações adversas às vacinas de mRNA. No restante deste artigo, desenvolvemos ainda mais essa hipótese com base em evidências extensas da literatura de pesquisa. A ideia de que a proteína spike pode ser neurotóxica por meio de capacidades semelhantes a príons não é nova. Em 2020, Tavassoly O et al. propuseram que peptídeos derivados da proteína spike poderiam cruzar sementes com proteínas humanas amiloidogênicas existentes para acelerar a formação de fibrilas e causar neurodegeneração. Fortes evidências para o potencial semelhante ao príon da proteína spike vêm de um artigo publicado em 2021 que demonstrou por meio de modelagem computacional que o domínio de ligação ao receptor (RBD) do segmento S1 da proteína spike se liga à heparina e a várias proteínas de ligação à heparina amiloidogênicas diferentes, incluindo β amiloide, α-sinucleína, Tau, a proteína príon e a proteína de ligação ao DNA TAR 43 (TDP-43). Eles propuseram que esse poderia ser o mecanismo pelo qual a proteína spike poderia causar estresse oxidativo mitocondrial, apoptose e neurodegeneração. A ligação à heparina acelera a agregação de proteínas amiloides no cérebro. Foi feito um caso para amplificar o dano do sistema nervoso central na doença de Alzheimer devido à endocitose da proteína spike por células endoteliais no cérebro em associação com a infecção por COVID-19. Consistente com outros estudos, esses autores propuseram que a endotelite induzida por spike perturba a barreira hematoencefálica e exacerba a doença de Alzheimer por meio da interação da proteína spike com β amiloide ou tau hiperfosforilada.
Análise
A proteína spike possui domínios semelhantes a príons
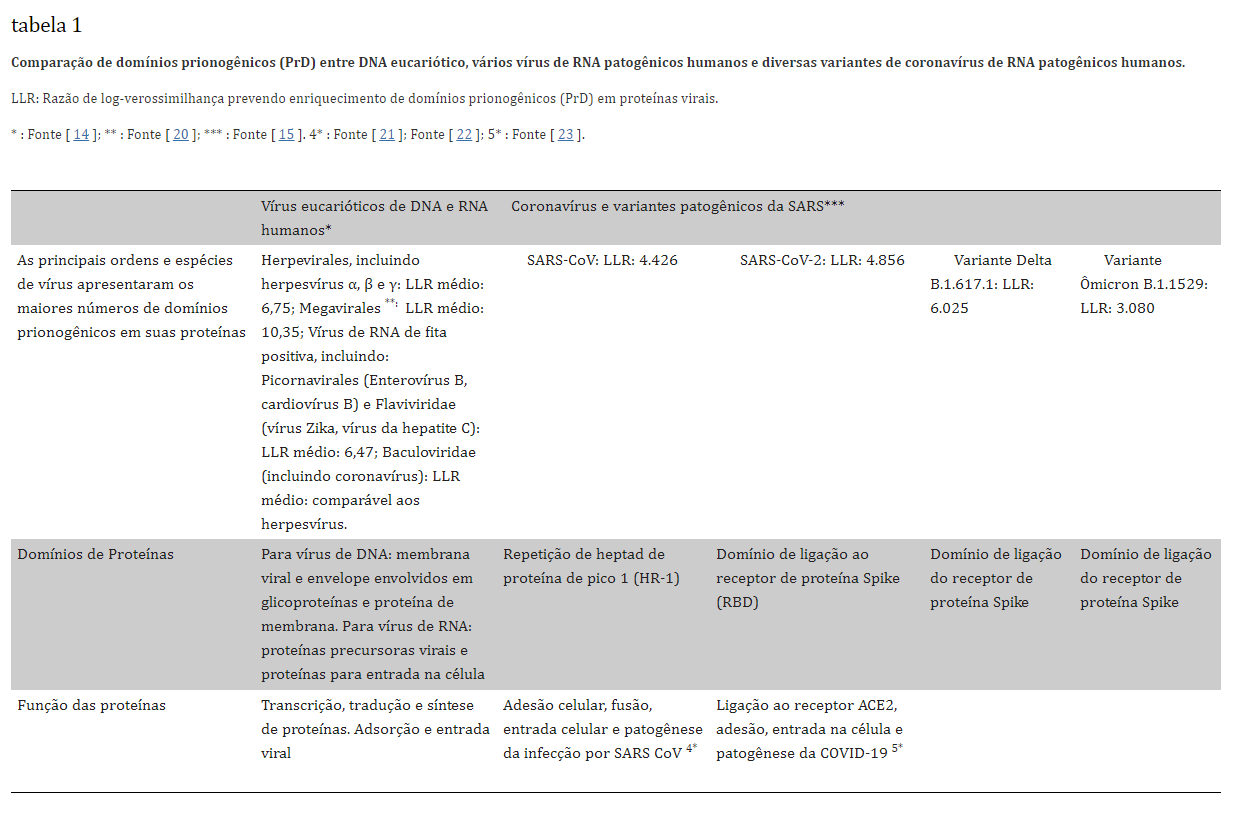
As vacinas de mRNA da COVID-19 são baseadas em nanopartículas lipídicas contendo mRNA que codifica a glicoproteína spike do SARS-CoV-2. A vacina foi projetada de várias maneiras para proteger o conteúdo de mRNA da degradação e para garantir que as células transfetadas com ela produzam grandes quantidades de proteína spike em uma alta taxa de produção por um longo período de tempo. Um estudo abrangente usando bioinformática identificou um grande número de proteínas virais de diversas espécies que têm assinaturas semelhantes a príons em sua sequência genética. Em particular, eles identificaram domínios semelhantes a príons em proteínas de superfície viral envolvidas na ligação do receptor e fusão com a célula hospedeira. Esses mesmos autores publicaram posteriormente um artigo analisando o potencial semelhante a príons da proteína spike. Eles encontraram um domínio semelhante a príons no RBD da proteína spike do SARS-COV-2, que estava ausente do vírus SARS-CoV original. As regiões ricas em asparagina (N) e glutamina (Q) são características de muitas proteínas príons. Cinco substituições de aminoácidos na variante SARS-CoV-2 em comparação com o SARS-CoV formaram uma região rica em Q/N hidrofóbica permitindo a prionogênese. Eles também analisaram algumas das variantes do SARS-CoV-2, determinando que a variante Delta teve uma pontuação mais alta para prionogênese do que a cepa original de Wuhan, enquanto a Ômicron teve uma pontuação substancialmente menor. Regiões ricas em glutamina-asparagina (QNRs) foram encontradas frequentemente em moléculas reguladoras e proteínas de ligação ao RNA. Elas estão associadas a proteínas ligadas a doenças neurodegenerativas, incluindo Alzheimer, Huntington e ELA. A Modelagem Oculta de Markov (HMM) é uma ferramenta estatística usada para calcular a probabilidade de uma sequência de observação específica, dado um conjunto de dados de treinamento que representam a classe sob investigação. Uma de suas muitas aplicações é avaliar similaridades composicionais entre proteínas e sequências de príons. Uma aplicação online, análise de composição de aminoácidos semelhantes a príons (PLAAC) (http://plaac.wi.mit.edu/) emprega tecnologia HMM para identificar domínios prionogênicos candidatos em proteínas de vírus, procariotos e eucariotos. A razão de log-verossimilhança (LLR) resultante obtida usando PLAAC é uma estimativa da probabilidade de uma proteína investigada ser prionogênica. O algoritmo PLAAC analisa os domínios prionogênicos (PrDs) de uma determinada proteína que corresponde composicionalmente a pelo menos um domínio dos príons de levedura já investigados.Tabela 1 inclui as principais ordens e espécies de vírus patogênicos eucarióticos (humanos) que contêm a maioria dos domínios PrD estimados pelo PLAAC e espelhados por suas pontuações LLR médias. Além disso, o principal coronavírus SARS e suas pontuações LLR variantes também estão incluídos na Tabela 1.
Um estudo que avaliou o potencial amiloidogênico da proteína spike usou métodos teóricos e experimentais para verificar se a proteína spike do SARS-CoV-2 pode causar o aparecimento de fibrilas semelhantes a amiloides após a proteína ter sido submetida à proteólise. Previsões teóricas identificaram sete sequências potencialmente amiloidogênicas dentro da proteína spike. Em experimentos de laboratório onde a proteína foi incubada com a protease elastase de neutrófilos, fibrilas semelhantes a amiloides apareceram durante 24 horas de coincubação. Um segmento específico, spike 194-213 (FKNIDGYFKI), foi altamente abundante após seis horas e se sobrepôs quase completamente com a sequência mais amiloidogênica identificada teoricamente. Os neutrófilos que respondem à ativação imunológica liberam elastase de neutrófilos no meio, onde teriam acesso à proteína spike e seriam capazes de quebrá-la nos segmentos amiloidogênicos. A proteína spike do SARS-CoV-2 tem uma inserção polibásica única de quatro aminoácidos, RRAR, na junção dos segmentos S1 e S2, que não está presente no SARS-CoV. Esta sequência tem vários locais de clivagem suscetíveis a proteases, como a elastase neutrofílica. As elastases neutrofílicas secretadas por neutrófilos atraídos para os locais de inflamação causados pela proteína spike do SARS-CoV-2 podem presumivelmente clivar a proteína spike encontrada e liberar o segmento S1 na circulação, potencializando uma resposta amilogênica. A amiloidose derivada da elastase neutrofílica tem sido implicada há muito tempo na amiloidogênese. As fibrilas amiloides desencadeiam a liberação de armadilhas extracelulares de neutrófilos (NETs) contendo elastase de neutrófilos, o que pode induzir a fragmentação amiloide em oligômeros tóxicos. A α-sinucleína é um fator causal bem estabelecido na doença de Parkinson (DP). A demência por corpos de Lewy (LBD) é uma doença relativamente comum associada a depósitos de α-snucleína no cérebro, mostrando em muitos casos semelhanças com a DP. Relações experimentais emergentes de estudos de bioinformática mostram que a proteína spike do SARS-CoV-2 interage com proteínas amiloidogênicas, particularmente α-sinucleína, e induz patologia semelhante à do corpo de Lewy em uma linhagem celular. Também induziu a regulação positiva da expressão de α-sinucleína. Os autores sugeriram que essas propriedades da proteína spike poderiam ser o mecanismo subjacente responsável pela ligação entre COVID-19 e DP, que foi encontrada em outros estudos. A superexpressão de α-sinucleína aumenta seu risco de dobramento incorreto em fibrilas amiloides tóxicas. Um estudo de caso de um homem em sua sexta década de vida documentou o início dos sintomas de DCJ coincidindo com a infecção por SARS-CoV-2. A rápida progressão dos sintomas neurológicos levou à sua morte dois meses depois. Os autores levantaram a hipótese de que uma resposta inflamatória grave ao SARS-CoV-2 precipita ou agrava a doença neurodegenerativa. Um artigo de revisão documentou este caso e vários outros casos da literatura de pesquisa publicada sobre doenças ou síndromes neurológicas associadas à COVID-19. Sua Tabela 1 lista 25 casos de doença de Alzheimer, epilepsia, esclerose múltipla, doença de príons e distúrbios visuais associados à COVID longa.
O Prof. Luc Montagnier é um ganhador do prêmio Nobel recentemente falecido por seu trabalho sobre HIV. Um artigo publicado recentemente, coautorado por Montagnier, descreve 26 casos em que o paciente ficou gravemente doente com sintomas espontâneos de DCJ logo após uma vacina contra a COVID-19. Vinte e três dos 26 casos desenvolveram sintomas dentro de 15 dias após a segunda injeção de uma vacina de mRNA. Os outros três casos foram associados à vacina de vetor de DNA da AstraZeneca, e os sintomas apareceram no primeiro mês. Dos 26, 20 morreram no momento em que o artigo foi escrito, e os seis restantes estavam em estado crítico. O tempo médio até a morte foi inferior a cinco meses após a injeção. A DCJ é uma doença extremamente rara, geralmente afetando apenas uma em um milhão de pessoas durante a vida. Também geralmente leva vários anos desde o início dos primeiros sintomas até a morte. Portanto, este é claramente um tipo extraordinariamente incomum de DCJ que deve levantar uma preocupação sobre a segurança dessas vacinas. Embora ainda seja uma hipótese que precisa ser provada por estudos clínicos em humanos, é possível que essa forma de CJD de rápida progressão seja devida ao mimetismo molecular entre a proteína spike e a proteína príon. Proteínas contendo domínios semelhantes a príons estão sendo extensivamente investigadas recentemente por análises computacionais por seu papel causal não apenas para o desenvolvimento de doenças semelhantes a príons, mas também para câncer e infecções virais. Há uma sequência de cinco resíduos na proteína spike, YQAGS, que difere por apenas um resíduo de uma sequência no domínio C-terminal da proteína príon (YQRGS). A sequência na proteína spike está no final de um epítopo de célula B dentro do RBD. Anticorpos para essa sequência podem se ligar ao C-terminal da proteína príon devido ao mimetismo molecular. Estudos mostraram que autoanticorpos no domínio C-terminal globular podem causar uma forma agressiva de CJD ao interferir no transporte da proteína príon para o retículo endoplasmático.
Biodistribuição de vacinas de mRNA
Já em 1979, foi reconhecido que a exposição de camundongos à proteína priônica do scrapie, independentemente de ser por via intraperitoneal, intravenosa ou múltiplas vias subcutâneas, sempre mostrou o mesmo padrão de disseminação da infectividade. A propagação no baço apareceu consistentemente bem antes de uma disseminação perceptível para a medula espinhal, com a infectividade no cérebro exigindo o período de incubação mais longo. Uma conclusão foi que as células imunes carregam as proteínas infecciosas para o baço, e a disseminação posterior da infectividade ocorre principalmente ao longo dos nervos, em vez de pela vasculatura ou pelo sistema linfático.
Ao contrário da PrP, que é altamente expressa no sistema nervoso, mas expressa em níveis muito mais baixos em uma infinidade de outros tecidos, a proteína precursora amilóide (APP) é altamente expressa em muitos tecidos além do sistema nervoso, incluindo músculos, fígado, sistema imunológico (timo e baço) e muitos outros órgãos.
Apenas alguns estudos foram conduzidos para examinar a biodistribuição de mRNA de vacinas subsequentes à injeção. Um estudo publicado em 2017 rastreou a distribuição de mRNA que codifica proteínas de hemaglutinina da gripe após injeção no músculo do camundongo. Eles quantificaram o nível máximo de mRNA encontrado em vários órgãos e usaram esses dados para inferir a via de migração do mRNA. Como esperado, de longe, a maior concentração permaneceu no músculo (5.680 ng/mL). No entanto, uma quantidade substancial foi encontrada nos linfonodos proximais (2.120 ng/mL), com quantidades significativamente menores nos linfonodos distais (177,0 ng/mL). Entre os órgãos, o baço e o fígado tiveram de longe as maiores concentrações (86,9 ng/mL no baço e 47,2 ng/mL no fígado). Quantidades menores foram encontradas no plasma (5,47 ng/mL), medula óssea (3,35 ng/mL), íleo (3,54 ng/mL) e testículos 2,37 ng/mL, com vestígios em muitos outros órgãos, incluindo o cérebro (0,429 ng/mL).
Outro estudo rastreou a via de biodistribuição de uma vacina de mRNA contra a raiva administrada intramuscularmente em ratos. Eles descobriram que o mRNA apareceu nos gânglios linfáticos drenantes em um dia e também foi encontrado no sangue, pulmões, baço e fígado. Os desenvolvedores da tecnologia estão satisfeitos em ver que o mRNA aparece no sistema linfático e no baço porque a ativação das células T e a produção de anticorpos pelas células B ocorrem principalmente nos centros germinativos nos gânglios linfáticos e no baço.
Reconhecemos e admitimos que esses são estudos de biodistribuição baseados em animais. Como tal, sua relevância para os humanos é especulativa. Esses estudos são conduzidos, no entanto, na expectativa de que tenham alguma relevância para a biodistribuição humana. Na ausência de estudos humanos que esclareçam esse tópico, incluímos os estudos in vivo como a melhor evidência disponível que é potencialmente análoga à biodistribuição humana.
Exossomos e microRNAs
Exossomos são nanovesículas secretadas membranosas de 30-150 nm de tamanho, geradas e liberadas por todas as células, frequentemente sob condições de estresse. Essas vesículas extracelulares são produzidas em endossomos tardios pela brotação interna da membrana endosomal. Sua carga é diversa e pode incluir ácidos nucleicos, proteínas, lipídios e metabólitos. Eles mediam a comunicação intercelular de curta e longa distância por meio de conteúdos que incluem moléculas de sinalização, nutrientes e toxinas. Em particular, sua membrana lipídica pode proteger moléculas de RNA internalizadas da degradação por ribonucleases extracelulares. Um artigo publicado por Wei H et al. em 2021 fornece uma excelente revisão dos mecanismos complexos que controlam a classificação de proteínas, RNAs e outras moléculas em exossomos para exportação e entrega a outras células. Foi demonstrado experimentalmente que as células que absorvem o mRNA das nanopartículas nas vacinas de mRNA empacotam alguns dos mRNAs, juntamente com os lipídios catiônicos ionizáveis, em pequenas partículas lipídicas que são então liberadas no meio externo como exossomos. Na verdade, esses autores encontraram uma proporção de 1:1 de moléculas lipídicas catiônicas para nucleotídeos nos exossomos liberados. Eles também demonstraram que as células que absorvem os exossomos podem sintetizar proteínas a partir do mRNA contido nos exossomos. Este experimento envolveu mRNA que codifica a eritropoietina humana, mas um resultado semelhante pode ser esperado para o mRNA codificador de spike das vacinas COVID-19. Em teoria, isso significa que uma célula imune no baço pode enviar mRNA intacto codificando a proteína spike até o cérebro ao longo do nervo vago, e um neurônio ou célula microglial no cérebro pode absorver o mRNA e começar a sintetizar a proteína spike. Além disso, foi demonstrado dramaticamente em um estudo com camundongos publicado em 2019 que a α-sinucleína mal dobrada no intestino pode ser entregue ao cérebro através do nervo vago para causar DP. Uma vagotomia protegeu completamente os camundongos da transmissão do intestino para o cérebro. O Sistema de Notificação de Adversos de Vacinas dos Estados Unidos (VAERS) é um programa nacional de vigilância de segurança de vacinas mantido pelo governo dos EUA, onde médicos e pacientes podem enviar casos de reações adversas que acreditam estar relacionadas a qualquer vacina que receberam. Uma análise de dados do VAERS envolveu a tabulação das contagens no ano de 2021 de vários eventos adversos que listaram sintomas que poderiam estar associados à inflamação no nervo vago e/ou nos principais nervos da cabeça aos quais ele se conecta. Esses sintomas incluíam anosmia (perda do olfato), zumbido, surdez, paralisia facial, vertigem, enxaqueca, disfonia, disfagia, náusea, vômito, dispneia, síncope e bradicardia. Houve mais de 200.000 casos com esses sintomas relacionados às vacinas contra a COVID-19 em 2021, representando 97,2% de todos os casos de qualquer vacina relacionada a esses sintomas naquele ano. Embora as evidências do VAERS não sejam prova de que haja inflamação no nervo vago associada a esses sintomas, essa inflamação é uma explicação plausível convincente para os sintomas observados. Também há evidências de que os exossomos desempenham um papel importante na propagação de proteínas amiloidogênicas no cérebro. A proteína priônica humana, PrP, é encontrada em associação com exossomos tanto em sua forma normal (PrP C ) quanto em sua forma mal dobrada (PrP SC). Além disso, exossomos contendo PrP SC são infecciosos. Exossomos podem transportar tanto β amiloide quanto Tau fosforilada, duas proteínas que estão ligadas à doença de Alzheimer.
As placas Aβ associadas à doença de Alzheimer são enriquecidas em proteínas exossômicas, sugerindo uma fonte original de exossomos. Em um modelo murino de tauopatia, técnicas que inibem a síntese de exossomos foram encontradas para interromper a propagação de tau. A proteína Tau coagrega-se com Aβ mal dobrada em placas nos cérebros de pacientes com DA, e isso sugere que pode haver um princípio geral de toxicidade induzida por endocitose de exossomos. Finalmente, exossomos especificamente derivados de células que passam por agregação de Tau podem semear e corromper Tau solúvel em células receptoras. Um dos tipos de moléculas frequentemente presentes em exossomos são os microRNAs (miRNAs). Os miRNAs são pequenas moléculas de RNA não codificantes de fita simples contendo cerca de 22 nucleotídeos que são encontrados em vários filos, incluindo animais, plantas e vírus. Eles desempenham um papel regulador essencial por meio de sua capacidade de silenciar a expressão de genes para proteínas específicas, geralmente ligando-se às regiões não traduzidas 3′ e 5′ (perto da capa 5′) (UTRs 3′, 5′) da molécula de mRNA que codifica a proteína. Tanto as células dendríticas apresentadoras de antígenos (DCs) quanto as células T podem secretar e absorver miRNAs exossômicos. Portanto, é apropriado ver os exossomos como um mecanismo de comunicação célula-célula para transferir esses RNAs reguladores essenciais entre diferentes tipos de células em associação com outras cargas. Dois miRNAs que são importantes para nossa discussão aqui são miR-155 e miR-146a. Ambos foram encontrados presentes em exossomos liberados por células imunes após exposição a endotoxinas. Ambos também foram destacados na curta lista de miRNAs cujos níveis de expressão são alterados em associação com COVID-19.
Foi demonstrado experimentalmente que os exossomos desempenham um papel essencial na comunicação célula-célula entre células T e células B durante o processo de produção de anticorpos após a apresentação de antígenos em centros germinativos. Três miRNAs específicos, um dos quais era o miR-155, foram identificados como presentes nesses exossomos e foram essenciais para provocar a resposta apropriada das células B. Os miRNAs promoveram a sobrevivência, a proliferação e a troca de classe de anticorpos nas células B, todos essenciais para o processo de produção de anticorpos. Mostramos anteriormente como o miR-155, em particular, provavelmente desempenha um papel na miocardite associada às vacinas de mRNA. Aqui, argumentaremos a favor de um papel para o miR-146a na indução de doenças neurodegenerativas. Nossa hipótese é que os exossomos liberados de células imunes no baço viajam pelo nervo vago para atingir os núcleos do tronco cerebral. Eles entregam sua carga tóxica, que pode incluir não apenas a proteína spike, mas também moléculas de mRNA intactas que codificam a proteína, para células receptoras no cérebro. A microglia no cérebro, por sua vez, poderia absorver a proteína spike e/ou o mRNA, potencialmente levando a uma maior regulação positiva desses microRNAs. O miR-146a é um miRNA comumente expresso que está envolvido em muitos estados de doença. Em particular, está altamente associado tanto à infecção viral quanto às doenças de príons no cérebro. Foi demonstrado que o miR-146a suprime a proteína quinase 1 associada a rho, contendo espiral enrolada (ROCK1), o que resulta na hiperfosforilação de Tau em associação com a doença de Alzheimer . O miR-146a suprime a tradução do mRNA ROCK1 em proteína ao se ligar à sua UTR 3′. Pode ser confuso que a supressão de uma quinase leve ao aumento da fosforilação de Tau, mas o ROCK1 não atua diretamente no Tau. A fosforilação do ROCK1 da proteína fosfatase e homólogo da tensina (PTEN) ativa o PTEN para promover a desfosforilação do tau. Portanto, a supressão do ROCK1 pelo miR-146a resulta na inativação do PTEN, o que leva ao acúmulo de fosfatos ligados ao Tau. Outra função do ROCK1 é reprimir o recrutamento excessivo de macrófagos e neutrófilos durante a inflamação aguda, portanto sua supressão pelo miR-146a resulta em infiltração excessiva de macrófagos e neutrófilos no tecido, aumentando assim a inflamação.
Um artigo de revisão de Pogue AI e Lukiw WJ mostrou que os miRNAs são abundantes no cérebro e participam da progressão de muitos distúrbios neurológicos relacionados à idade. O miR-146a foi destacado como um fator contribuinte pró-inflamatório em várias doenças neurodegenerativas, incluindo doença de Alzheimer, esclerose lateral amiotrófica (ELA), degeneração macular, esclerose múltipla, epilepsia do lobo temporal e DCJ. Como foi mencionado acima, o miR-146a é regulado positivamente em resposta a endotoxinas. A proteína spike contém uma sequência logo acima de seu local de clivagem da furina que é um motivo semelhante a um superantígeno sequencialmente e estruturalmente semelhante a um segmento de enterotoxina B (SEB) produzido por Staphylococcus aureus.Além disso, como veremos na próxima seção, há uma via de sinalização direta através da qual se pode esperar que a proteína spike regulasse positivamente o miR-146a na microglia que recebe os exossomos.
Em uma publicação de revisão anterior, propusemos que um efeito importante das vacinas de mRNA era inibir a sinalização do interferon tipo I (IFN), levando ao aumento das suscetibilidades à ativação de vírus latentes e câncer. Esta hipótese é apoiada por análises clínicas in vitro que mostram que a proteína spike interage com o Fator Regulador do Interferon 3 (IRF3) e resulta no término da ativação do IFN-I. Outras investigações in vitro em células pulmonares de macacos obtidas por lavagem broncoalveolar reforçam a validade da hipótese de que a spike prejudica a expressão do interferon tipo I. Com base nesta evidência in vitro, sugerimos que a superexpressão do miR-146a pode ser um fator contribuinte significativo nesta regulação negativa. Foi demonstrado que o miR-146a suprime a sinalização do IFN tipo I por meio da supressão da síntese de várias proteínas de sinalização, incluindo IRF5, Transdutor de Sinal e Ativador da Transcrição 1 (STAT1), Quinase Associada ao Receptor da Interleucina-1 (IRAK-1) e fator de necrose tumoral (TNF) associado ao fator 6 (TRAF6), todos mediadores essenciais da sinalização do IFN.
Monócitos CD16+ e receptor toll-like 4
Cerca de 30% dos pacientes infectados com SARS-CoV-2 continuam a apresentar sintomas debilitantes muito depois que o vírus foi eliminado. Essa condição, conhecida coloquialmente como “COVID longa”, também foi formalmente denominada “sequelas pós-agudas da COVID” (PASC). Os sintomas comuns incluem falta de ar, fadiga, confusão mental, inflamação e coagulopatias. Um estudo baseado em 46 indivíduos que sofrem de PASC descobriu que dois tipos específicos de monócitos não clássicos, (CD14Lo, CD16+) e (CD14+, CD16+) estavam significativamente elevados nos pacientes com PASC até 15 meses após a infecção aguda. Um número estatisticamente significativo desses monócitos não clássicos ainda continha a proteína S1 do SARS-CoV-2 até 15 meses após a infecção.
Um estudo humano de pré-impressão subsequente envolveu indivíduos que apresentaram sintomas semelhantes aos do PASC após a vacinação para COVID-19. Monócitos CD16+ foram isolados de seis desses pacientes, e foi confirmado que eles também continham sequências S1 e S2, bem como vários peptídeos S1 mutantes. Foi proposto que a liberação contínua de fragmentos de proteína spike desses monócitos poderia sustentar os sintomas do PASC. É concebível que esses monócitos tenham transcrito reversamente o mRNA em DNA, provavelmente armazenado em plasmídeos. Foi demonstrado experimentalmente que células humanas que expressam o retrotransposon long interspersed nuclear element-1 (LINE-1) são capazes de transcrever reversamente o mRNA da proteína spike em DNA dentro de seis horas de exposição por meio de transfecção.
A poliproteína Gag, presente em todos os retrovírus, é uma proteína essencial de ligação ao ácido nucleico que coordena muitos aspectos da montagem do vírion como um passo importante em direção à transcrição reversa e integração no DNA do hospedeiro. Um artigo publicado em 2020 com o título provocativo: “Prion protein PrP nucleic acid binding and mobilization implica retroelements as the replicative component of transmissible spongiform encephalopathy”, propôs que PrP é uma proteína antimicrobiana de ligação ao ácido nucleico que, como as proteínas Gag retrovirais, pode desencadear a transcrição reversa ao se ligar ao RNA derivado do retroelemento LINE-1. Além disso, eles alegaram que a citotoxicidade do PrP SC depende de sua capacidade de facilitar a atividade de retrotransposição LINE-1. Isso leva a quebras de fita dupla de DNA e danos celulares, mas, também, pode-se inferir que PrP SC, e, por analogia, a própria proteína spike, que também é uma proteína de ligação a RNA, pode facilitar a retrotranscrição do mRNA da proteína spike em DNA, mediada por LINE-1. Enquanto LINE-1 é inativo na maioria das células, neurônios, como células cancerígenas e células imunes, expressam ativamente LINE-1, especialmente em associação com doenças neurodegenerativas. As implicações potenciais de tudo isso são preocupantes.
O fibrinogênio no sangue pode coagular em uma forma amiloide anômala de fibrina que, semelhante a outros amiloides e príons ricos em β, é relativamente resistente à proteólise (fibrinólise). Em um estudo humano onde amostras de sangue e plasma pobre em plaquetas (PPP) foram coletadas de voluntários saudáveis e pacientes com COVID-19, concluiu-se que a proteína spike do SARS-CoV-2 produz hipercoagulação sanguínea e alterações no fibrinogênio de forma direta, mesmo quando não é absorvida pelas células. Um artigo de Kell DB et al. forneceu evidências de que a proteína spike do SARS-CoV-2 pode interagir com a fibrina para formar microcoágulos de fibrina amiloide aberrantes, denominados fibrinoides. Esses microcoágulos podem inibir o transporte de eritrócitos para os capilares, interrompendo o fornecimento de oxigênio aos tecidos afetados. Eles argumentaram que essa característica da proteína spike poderia ser a etiologia subjacente primária do PASC. De fato, as plaquetas são o maior reservatório de proteína príon no sangue. Foi demonstrado que a ativação plaquetária induz as plaquetas a liberar a proteína príon e exibi-la na superfície dos exossomos. Essa patologia lembra muito a capacidade de proteínas semelhantes a príons de causar o dobramento incorreto de proteínas no cérebro, levando a doenças neurodegenerativas, e os aspectos biofísicos subjacentes podem ser análogos. O suporte para essa ideia vem de observações das propriedades do β amiloide. As tromboses associadas ao β amiloide têm uma estrutura anormal e são resistentes à degradação por meio da proteólise. O β amiloide interage com o fibrinogênio, e sua ligação ao fibrinogênio facilita a oligomerização.Os autores deste artigo argumentaram que essas propriedades do β amiloide podem torná-lo um importante contribuinte para as anormalidades vasculares associadas à doença de Alzheimer.
Os monócitos sanguíneos reconhecem endotoxinas produzidas por bactérias Gram-negativas por meio de uma via do receptor Toll-like 4 (TLR4). A via TLR4 induz uma resposta inflamatória ao aumentar os níveis de mRNA e proteína para TNF-α e interleucina-1β (Il-1β), mediados pelo fator de diferenciação mieloide 88 (MyD88). O superantígeno estafilocócico, enterotoxina B (SEB), é um indutor potente de TNF-α e estimulou a grande expansão de monócitos (CD14Lo, CD16+). A adição de TNF-α recombinante à cultura de sangue total resultou na expansão da população de monócitos (CD14Lo, CD16+) para 35% do pool total de monócitos. Notavelmente, a proteína spike do SARS-CoV-2 tem uma sequência logo acima do local de clivagem da furina que se assemelha muito ao SEB. Esta sequência não está presente no SARS-CoV original.
Um experimento cuidadosamente conduzido demonstrou de forma convincente que a proteína spike do SARS-CoV-2 se liga ao TLR4 e o ativa. O trímero spike se liga diretamente ao receptor TLR4 com uma afinidade de ∼300nM, comparável à força de ligação de muitas interações vírus-receptor. Além disso, a proteína spike induz robustamente o agente inflamatório Il-1β, e essa indução é perdida quando inibidores de TLR4 são adicionados. É concebível que o segmento que se assemelha ao SEB seja responsável pela ativação do TLR4.
Um artigo de pesquisa de uma equipe em Boulder, CO, focou na subunidade S1 da proteína spike e demonstrou que a injeção do segmento S1 na cisterna magna de ratos Sprague-Dawley machos adultos resultou em déficits comportamentais, ativação microglial e resposta neuroinflamatória. Eles determinaram que os sinais S1 por meio de um padrão molecular associado a patógenos (PAMP). Experimentos in vitro em células transgênicas TLR4 de rim embrionário humano (HEK)-293 mostraram que S1 se liga aos receptores TLR4 para induzir a regulação positiva de TNF-α e outras citocinas pró-inflamatórias.
Há um crescente corpo de evidências que apoiam o papel do TLR4 na DP. A expressão do TLR4 é alta na substância negra em associação com a DP, juntamente com a regulação positiva da citocina inflamatória IL-1β. Os pacientes de Parkinson também apresentam expressão aumentada do TLR4 em monócitos circulantes e células B.
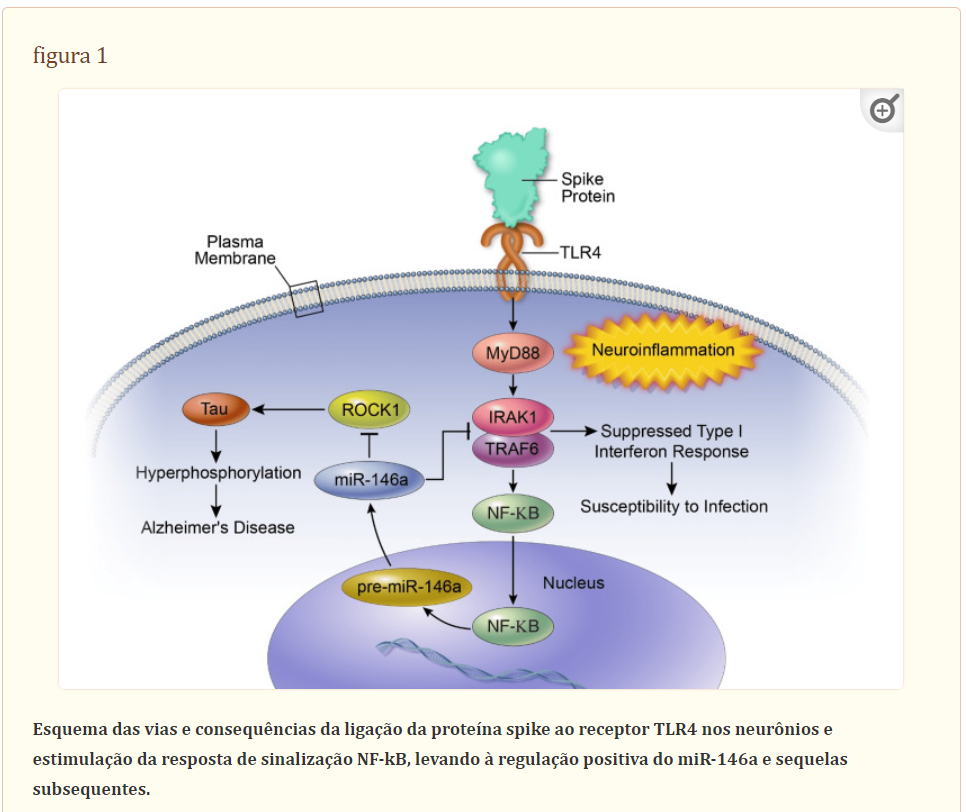
Figura 1 esquematiza as vias propostas envolvidas na ativação da proteína spike da resposta de sinalização TLR4 e na regulação positiva do miR-146a em neurônios.
Os sintomas graves da COVID compartilham muitas características com a sepse. O subconjunto de monócitos CD16+ é expandido em pacientes com sepse, e uma resposta inflamatória desregulada em monócitos CD16+ está associada à sepse. Pacientes com sepse apresentam níveis elevados de monócitos CD16+ no sangue, o que está associado a elevações na quimiocina inflamatória Il-6.
Os monócitos (CD14+, CD16+) foram reconhecidos como exibindo maior expressão de citocinas pró-inflamatórias e maior potência na apresentação de antígenos do que outros monócitos. Como tal, eles desempenham um papel crucial na infecção e inflamação. Em um estudo sobre pacientes que sofrem de demência por AIDS, foi descoberto que as células (CD14+, CD16+) representavam uma porcentagem extremamente alta (37% em média) dos monócitos em seu sangue, em comparação com apenas 6,5% em controles HIV-negativos. Esses autores indicaram que essas células “podem entrar no cérebro e expor as células neurais a fatores tóxicos”. Um estudo de pesquisa relevante de Prabhu VM et al., 2019, forneceu resultados solidamente convincentes indicando que os níveis de subtipo de monócitos (ou seja, desregulação de monócitos) correspondem ao que é observado na ativação do HIV não progressor (LTNP) de longo prazo. Embora as contagens de CD4 nesses pacientes estejam dentro da faixa normal, eles são propensos a uma inflamação sistêmica prolongada e a um alto risco de viremia não correlacionada com células T. Mais precisamente, a expansão não clássica de CD14+, CD16+ de monócitos neste estudo foi fortemente correlacionada com o que é observado em pacientes HIV-positivos LTNP. Nesses pacientes, a expressão muito alta do receptor de manose CD206, característico de um fenótipo M2 em monócitos, juntamente com o aumento da ativação de células T, correspondeu a um aumento na carga viral. Assim, o subtipo de monócitos não clássico em pacientes HIV LTNP é caracterizado por uma resposta inflamatória crônica de células T.
Além disso, níveis anormalmente altos de monócitos (CD14+, CD16+) também estão associados à sarcoidose e à síndrome da dor regional complexa, uma condição associada à inflamação neurogênica. A sarcoidose é uma doença de inflamação crônica caracterizada pela formação de granuloma. Na sarcoidose, os monócitos e células de origem monócita são aumentados em número em comparação com controles saudáveis. Além disso, o aumento da expressão de TNF em pacientes com sarcoidose é devido aos monócitos presentes, pois são encontrados em grande número em inúmeras amostras de lavagem bronquioalveolar (LBA) de vários pacientes. Portanto, a gravidade clínica dos pacientes com sarcoidose está intimamente ligada ao número de monócitos presentes. No entanto, outro estudo de pesquisa de Fraser SD et al., 2020, conclui que o tipo de monócito não clássico na sarcoidose é expandido e que eles são caracterizados por uma expressão muito baixa de receptores reguladores.
Reconhecemos que as conexões que estamos propondo entre esses eventos celulares e a manifestação clínica de inflamação e patologias específicas dependem de uma cadeia inferencial que liga dados in vitro e in vivo a achados histológicos em sujeitos humanos. No entanto, acreditamos que é importante considerar essas conexões potenciais para que possam ser investigadas de forma mais rigorosa.
Interações potenciais entre a proteína spike e PrP
O vírus da AIDS, HIV, invade o sistema nervoso central, onde causa neuroinflamação, levando a deficiências cognitivas. Um estudo publicado em 2017 demonstrou que a expressão de TNF-α, induzida pelo HIV, levou à eliminação de PrP de astrócitos no cérebro. Os níveis de PrP no fluido cerebrospinal de pacientes com AIDS que sofrem de problemas cognitivos foram elevados em comparação com aqueles de pacientes com AIDS sem problemas cognitivos.
O segmento S2 da proteína spike é responsável pela fusão de membranas virais e celulares. Um estudo dos aspectos estruturais 3D de S2 e da proteína gp41 do HIV-1 revelou que essas duas proteínas compartilham as mesmas duas hélices α e podem seguir um mecanismo de fusão de membrana análogo.
O fato de que a proteína spike induz uma regulação positiva acentuada de TNF-α e causa problemas cognitivos implica que ela também pode, como o HIV, regular positivamente a expressão de PrP no cérebro. Recentemente, nossa equipe mostrou que a expressão de PrP C é induzida devido às interações da proteína spike na microglia murina e em monócitos e macrófagos humanos. Neste estudo, prevê-se que, de acordo com a ativação do receptor toll-like pela proteína spike, tanto a isoforma normal da proteína príon quanto a expressão de β amiloide são reguladas positivamente por meio da promoção da expressão de p53 por meio do metabolismo de β amiloide. Um aumento nos números de PrP C pode levar ao dobramento incorreto da conformação do príon e gerar doenças relacionadas ao príon e ao príon.
Embora não esteja claro qual é a função primária da proteína príon, foi demonstrado que ela é protetora sob condições de estresse neuronal. A expressão de PrP é aumentada no plasma de pacientes com AVC e protege os neurônios da apoptose. Além disso, há evidências de que PrP protege as células sob condições de estresse oxidativo da senescência. A indução da senescência em fibroblastos cultivados em cultura por meio da incubação com sulfato de cobre resultou em um aumento nos níveis de mRNA de PrP, um aumento na abundância de proteína PrP e uma localização nuclear de PrP. A redução da expressão de PrP por meio de pequeno RNA interferente resultou em um aumento nos marcadores de senescência. A conclusão dessas descobertas é que PrP é regulado positivamente sob condições de estresse oxidativo e ajuda como um antioxidante a retardar a transformação da senescência.
Foi demonstrado experimentalmente que a proteína spike induz a senescência em células transfectadas. Além disso, foi proposto que as vacinas de mRNA podem induzir a senescência prematura por meio da formação de sincícios em células imunes expostas, devido principalmente ao seu conteúdo lipídico. As vacinas contêm lipídios ionizáveis, colesterol e o fosfolipídio 1,2-distearoil-sn-glicero-3-fosfocolina (DSPC), todos os quais podem contribuir para a formação de sincícios. O DSPC é um mimético da fosfatidil serina (PS), e está bem estabelecido que o PS externalizado promove a formação de sincícios. Um modelo de camundongo demonstrou que as células imunes senescentes promovem o envelhecimento sistêmico em camundongos e provavelmente também em humanos.
Estudo molecular in vitro mostra que a aglomeração macromolecular pode facilitar a conversão de PrP nativa na configuração de oligômero β solúvel neurotóxico. É concebível que a rápida produção de proteína spike a partir do mRNA em células imunes transfectadas induziria um ambiente lotado, ao mesmo tempo em que aumentaria a síntese de PrP devido à condição estressante. Este poderia ser um ambiente ideal para a formação de moléculas PrP SC , que seriam liberadas dentro de exossomos de células imunes transfectadas no baço e em outros lugares. A transformação de PrP C na molécula PrP SC infecciosa é um processo extremamente lento na ausência de PrP SC . No entanto, sob a influência de PrPs intermediários, PrP SC pode induzir gênese amiloide sólida e irreversível por meio do modelo de assistência de molde. Em outro modelo, onde PrP SC está presente e interage com PrP C , a progressão para a gênese amiloide é rápida e reversível (modelo de polimerização nuclear), para estabelecer neurotoxicidade.
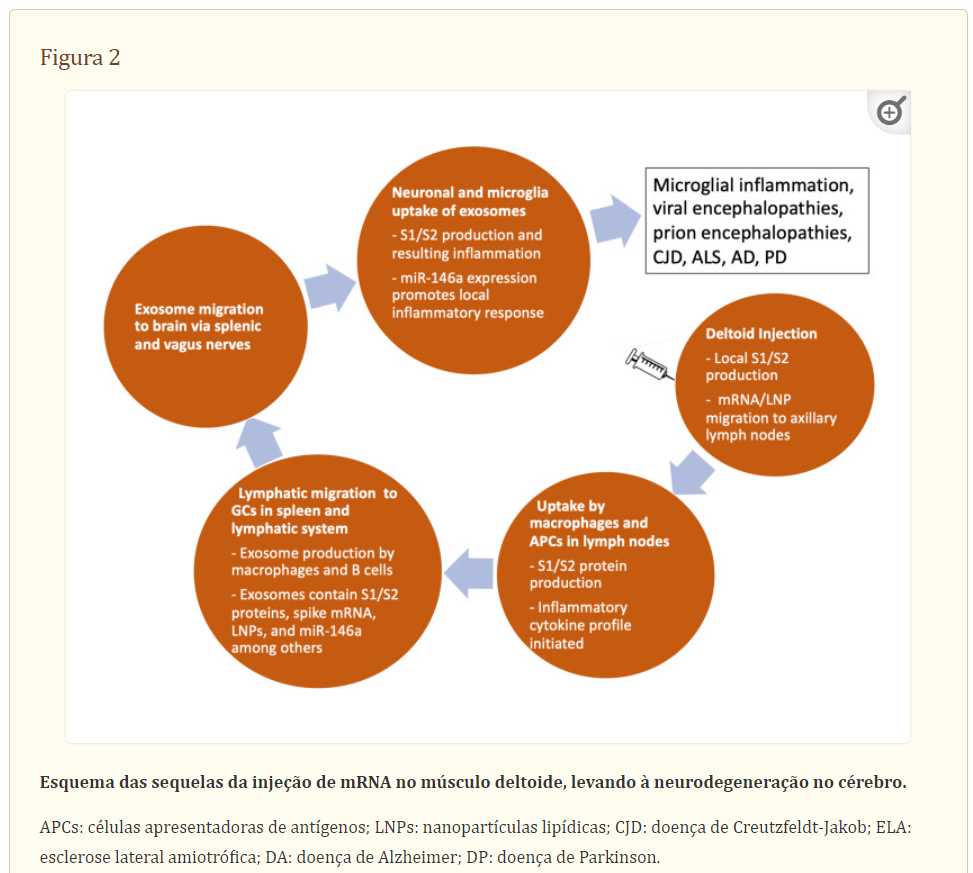
Figura 2 mostra um esquema da provável sequência de eventos que levam à neurodegeneração, começando com a injeção no músculo deltoide.
Um papel da Hsp70 e diabetes
Vários estudos em humanos mostraram que pessoas que sofrem de diabetes e/ou obesidade têm um risco aumentado de resultados graves da COVID-19. Uma possível explicação para esta observação é que estas condições interrompem a resposta ao choque térmico (HSR), uma resposta natural à febre que normalmente leva à resolução da resposta inflamatória. De fato, pacientes de COVID-19 de alto risco têm uma HSR anti-inflamatória suprimida. O fator de transferência de choque térmico 1 (HSF1) é o principal fator de transcrição que regula a expressão de proteínas de choque térmico. Ele suprime a atividade de Il-6 e Il-1β, controlando assim a resposta inflamatória. Muitas vezes, é a produção excessiva de citocinas por um sistema imunológico hiperativo que leva a danos nos tecidos e falência múltipla de órgãos com risco de vida.
Normalmente, HSR induz a expressão da proteína de choque térmico induzível 70 (Hsp70), também conhecida como Hsp72 e Hspa1a, uma chaperona molecular com muitas funções complexas no metabolismo e processos regulatórios. As proteínas de choque térmico podem ser responsáveis por até 2% da massa total de proteínas em uma célula após a ativação por HSR. Hsp70/72 interage com muitas outras proteínas durante o processo de dobramento de proteínas para facilitar o dobramento, ajudando a proteger da formação de agregados de proteínas e facilitando a degradação de proteínas danificadas.
Estímulos estressantes podem induzir a liberação de proteínas de choque térmico intracelular no meio extracelular e na circulação. A Hsp70/72 extracelular desempenha um papel facilitador na resposta imune adaptativa aos antígenos. Além disso, a Hsp70/72 extracelular pode ligar antígenos, e o complexo é então reconhecido pelas células apresentadoras de antígenos (APCs) por meio de receptores scavenger. A APC absorve o complexo, e a Hsp70/72 ligada sequestra o antígeno até que ele alcance o proteassoma. Após o processamento, o antígeno é transportado para moléculas de MHC classe I, desencadeando a ativação de células T CD8+ citotóxicas. O complexo Hsp70/72-antígeno também pode ser processado no lisossomo, levando à apresentação de peptídeos derivados de antígeno em moléculas de MHC classe II, ativando assim as células T CD4+.
A sinalização prejudicada da insulina leva a uma capacidade deficiente de induzir HSR e a subsequente resolução da inflamação. A glicogênio sintase quinase-3 (GSK-3) é uma serina/treonina quinase que desempenha um papel essencial na fisiopatologia molecular de muitas doenças. Sua superexpressão está ligada à resistência à insulina. A GSK-3 regula negativamente as atividades de ligação ao DNA e transcricionais da HSF1. A região promotora do gene TNF-α contém um sítio de ligação para HSF1 que reprime a transcrição do TNF-α. Portanto, aqueles com resistência à insulina enfrentam uma maior suscetibilidade à exposição à endotoxina devido à sua capacidade prejudicada de induzir a expressão de HSF1.
Uma das funções mais importantes da Hsp70 é proteger contra doenças neurodegenerativas. Muitos artigos na literatura de pesquisa vinculam a Hsp70 à proteção contra várias doenças neurológicas de dobramento incorreto de proteínas por meio de sua capacidade de facilitar o dobramento adequado e retardar a formação de fibrilas. As evidências de estudos in vitro também são muito claras. A indução farmacológica da Hsp70 em células cronicamente infectadas com príons diminuiu significativamente o acúmulo de SC PrP . Além disso, camundongos sem o gene para Hsp70 experimentaram progressão acelerada da doença priônica em comparação com camundongos selvagens.
Estudos post-mortem em humanos de pacientes que morreram de COVID-19 mostraram que um alvo primário da proteína spike do SARS-CoV-2 são as células imunes, particularmente os macrófagos, no baço e que muitas células infectadas cometeram apoptose. As células apoptóticas liberam um número maior de exossomos do que as células saudáveis. Embora uma investigação completa in vitro e in vivo seja necessária para confirmar isso, podemos prever que as células imunes nos centros germinativos no baço sintetizando constantemente a proteína spike sob a instrução do mRNA na vacina de mRNA estariam sob estresse considerável devido ao excesso de carga de proteína e ao potencial de fragmentos de proteína spike se dobrarem incorretamente em uma forma amiloidogênica. A pirexia (febre) é uma reação adversa muito comum à vacina, indicando ativação do HSR. Espera-se que as células imunes no baço regulem positivamente o Hsp70 sob a influência do HSF1. Eles provavelmente o liberariam em exossomos, junto com as proteínas spike e os miRNAs, como miR-155 e miR-146a, necessários para desencadear uma resposta de anticorpos apropriada à spike.
Os exossomos representam um método novo e eficiente para a transmissão de príons. A estimulação da liberação de exossomos aumenta a transferência intercelular de proteínas de príons e, inversamente, a inibição farmacológica da liberação de exossomos diminui a eficiência da transferência de príons. Pessoas obesas ou diabéticas vacinadas sofreriam de uma capacidade prejudicada de instanciar o HSR, deixando as células que absorvem exossomos contendo a proteína spike menos protegidas do dobramento incorreto da proteína spike e, portanto, mais vulneráveis à apoptose, criando um ciclo vicioso.
Um papel potencial dos quadruplexes G
Uma consideração na comparação da proteína spike da vacina com a proteína sintetizada pelo vírus está relacionada à etapa de “otimização de códons” na especificação do mRNA para as vacinas. Essa prática aproveita os códigos de nucleotídeos redundantes para a maioria dos aminoácidos e envolve a substituição dos códons usados pelo vírus por outros mais eficientes na montagem de proteínas. Acontece que os códons mais eficientes, em média, contêm mais guaninas do que outros códons. Os nucleotídeos de guanina, quando são enriquecidos na sequência de nucleotídeos, às vezes são capazes de se configurar em uma estrutura especial chamada “G quadruplex” (G4). Os G4s se tornaram um tópico quente recentemente devido à sua capacidade potencial de regular a tradução de maneiras mal compreendidas. Além disso, tornou-se aparente que o mRNA da proteína príon humana contém múltiplos motivos formadores de G4. Foi levantada a hipótese de que os G4s podem desempenhar um papel crítico em fazer com que a proteína príon assuma seu estado mal dobrado. A sequência de nucleotídeos original na versão do vírus do mRNA da proteína spike tem o potencial de formar apenas quatro motivos G4. Em contraste, a versão Pfizer tem o potencial de produzir nove, e a versão Moderna pode formar 19. O autor de um artigo publicado em 2014, apropriadamente intitulado “G-quadruplexes within prion mRNA: the missing link in prion disease?” escreveu o seguinte na conclusão: “A presença de motivos formadores de G4 no mRNA PrP pode fornecer o elo perdido na conversão inicial de PrP C para PrP SC . Entender como as estruturas de mRNA estão envolvidas no (mal)dobramento de PrP C e possivelmente muitas outras proteínas de ligação a RNA com propriedades semelhantes a príons é de suma importância para o desenvolvimento de melhores tratamentos para CJD e doenças relacionadas”.
Reavaliação da relação risco/benefício da vacinação contra a COVID-19
Um estudo publicado na Lancet monitorou a eficácia das vacinas contra a COVID-19 ao longo do tempo. Ele mostrou que, uma vez decorridos oito meses desde a segunda injeção da série de duas injeções, a função imunológica era menor do que entre os indivíduos não vacinados. Embora os reforços possam restaurar temporariamente níveis mais altos de anticorpos, os reforços frequentes podem corroer ainda mais a função imunológica inata por um período indefinido, levando a um risco aumentado de várias infecções e câncer. Além disso, a rápida evolução do vírus está resultando em uma ligação cada vez mais fraca de anticorpos à proteína spike da cepa agora dominante. Felizmente, a atual cepa Ômicron do vírus parece ser menos virulenta do que a original. Isso pode ser uma consequência do potencial reduzido de dobramento incorreto semelhante ao príon.
Reconhecemos que confiamos muito em estudos in vitro e in vivo. No entanto, vinculamos estes o mais próximo possível com os correlatos histológicos e patológicos humanos documentados com vias e eventos celulares. À luz destas considerações, a relação risco/benefício para as vacinas de mRNA precisa ser reavaliada. Com cada vacina vem uma enxurrada de proteína spike liberada na circulação, avançando ainda mais o potencial para efeitos amiloidogênicos e aumentando o risco de futuras doenças neurodegenerativas. Um comentário de Kenji Yamamoto publicado no BMC está pedindo à comunidade médica para manter o controle da data da vacinação mais recente de pacientes hospitalares para poder avaliar melhor qual papel a vacina pode ter desempenhado em qualquer doença ou condição manifesta. Ele também desencoraja fortemente a política que promove o reforço contínuo de qualquer pessoa que não seja os pacientes de maior risco de morte por COVID-19. Há uma necessidade urgente de os governos reconsiderarem uma política cega que assume que reforços repetidos da vacina são uma abordagem válida para lidar com a COVID-19.
Conclusões
Examinamos a extensa literatura sobre as propriedades semelhantes a príons da glicoproteína spike do SARS-CoV-2. Além disso, identificamos vias pelas quais as vacinas de mRNA podem ser capazes de entregar a proteína spike ao cérebro, o que sugerimos que acontece por meio de exossomos liberados de centros germinativos no baço que viajam pelo nervo vago, aumentando o risco de doença neurodegenerativa. Se isso acontecer, seria esperado que as vacinas contra a COVID-19 encurtassem o período de tempo antes que a doença neurodegenerativa se manifestasse em indivíduos suscetíveis. Especulamos que a idade de início da doença neurodegenerativa no nível populacional diminuirá no futuro em países onde a aceitação da vacina foi alta.
Particularmente preocupante é a evidência de que os monócitos CD16+ podem produzir continuamente a proteína spike por meses após a vacinação, possivelmente por meio da presença citosólica prolongada de mRNA ou transcrição reversa do mRNA em DNA. Ficou claro que os anticorpos induzidos pela vacinação diminuem com o tempo, necessitando de reforços frequentes para aumentar os níveis de anticorpos para proteção suficiente contra a COVID-19. Com cada reforço vem um risco composto de doença neurodegenerativa futura. Felizmente, a infecção pela variante Ômicron tem uma capacidade semelhante a príon bastante reduzida e, portanto, com a cessação da vacinação em massa, o aumento esperado de doenças semelhantes a príons pode se estabilizar nos próximos anos.
UM PAPEL POTENCIAL DA PROTEÍNA SPIKE EM DOENÇAS NEURODEGENERATIVAS UMA REVISÃO NARRATIVAFonte: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9922164/