O poder dos antioxidantes e o que eles realmente fazem no contexto do COVID-19.
Por Jessica Rose
Prólogo
Demorei muito para escrever este artigo porque eu precisava aprender, e reaprender, muita química. Eu sou uma bióloga, não um químico “profissional” (eu me senti um pouco fora do meu “elemento” aqui), mas quando se trata de sistemas vivos, muitos de nossos campos e assuntos são partes integrantes de cada um. Também levei um tempo extra porque minha intenção original – simplesmente revisar um artigo de jornal específico – foi um tanto prejudicada, principalmente porque não acho que o artigo seja prontamente “consumível” pelo leitor comum, mesmo que esse leitor tenha formação científica. Percebi ao longo do caminho que não seria tão fácil quanto resumir os pontos levantados pelos autores e que eu teria que me aprofundar bastante nos fundamentos da química para ter alguma chance de transmitir uma mensagem biológica significativa.
Para mim, não basta apenas dizer “tomar antioxidantes”. Quero que meus leitores entendam por que devem tomar antioxidantes, se isso for sugerido. Quero que meus leitores entendam o que um antioxidante realmente é e faz. Eu quero entender o que um antioxidante realmente é e faz!
Minha esperança para este artigo é selecionar (e separar) os pontos mais importantes feitos neste e em outros artigos relacionados e definir com muita clareza por que certas pessoas são melhores do que outras em relação à gravidade da patologia COVID-19 (e praticamente todas “doenças” e distúrbios, incluindo câncer) no contexto de reações redox e do ambiente que pré-determina coisas como eventos de ligação, em primeiro lugar. Eu também decidi torná-lo uma série de várias partes. A quantidade de informações importantes a serem transmitidas é muito grande e muito importante para um único artigo.
Também gostaria de reiterar a importância do que Bret Weinstein e Heather Heying estão transmitindo sobre o perigo implícito de introduzir qualquer proteína estranha através da plataforma LNP/mRNA devido a reações imunes persistentes e muitas vezes graves. No entanto, para os propósitos deste artigo, o foco é a proteína spike e sua capacidade de se ligar ao receptor ACE-2 em humanos. Para todos os efeitos, a proteína spike foi absolutamente a pior proteína que poderia ter sido selecionada para uso nas vacinas de COVID-19 por causa do que ela liga. E sim, “eles” estavam bem cientes dessa capacidade de ligação e da onipresença da expressão de ACE-2 em uma ampla variedade de tipos de células e tecidos, incluindo os testículos, o coração e o tecido adiposo.
Esboço dos pontos principais da Parte I
- Antioxidantes, como a tiorredoxina, diminuem a gravidade do COVID-19 ao interferir na ligação do SARS-CoV-2:ACE-2 para prevenir a infecção das células;
- As proteínas SARS-CoV-2 RBD e ACE-2 têm dissulfetos redox ativos atuados por antioxidantes;
- O status redox (o equilíbrio de antioxidantes e espécies reativas) que regula o papel dos resíduos de cisteína do ambiente celular é vital e uma mudança no status redox pré-determina os estados de “doença”.
Antecedentes do artigo de jornal
Um artigo a ser impresso em breve em setembro de 2023 (assustador que possamos lê-lo agora) intitulado: A toxicidade da proteína spike do COVID-19 é um fenômeno de mudança redox: Uma nova abordagem terapêutica, foi publicado online na Free Radical Biology and Medicine. Os autores sugerem que a melhoria dos efeitos do COVID-19 pode ser alcançada usando substâncias específicas, como ácido alfa-lipóico, azul de metileno ou dióxido de cloro por seus efeitos restauradores no ciclo de Krebs, como antivirais e aliviando o efeito Warburg.
Ponto 1
- Antioxidantes, como a tiorredoxina, diminuem a gravidade do COVID-19 ao interferir na ligação do SARS-CoV-2:ACE-2 para prevenir a infecção das células
Antes de entender o poder por trás dessa frase, precisamos entender as palavras que a compõem. Agora eu provavelmente deveria começar com uma revisão da respiração celular, respiração aeróbica, ciclo de Krebs, cadeia de transporte de elétrons e produção de ATP, mas guardei esse detalhe para a Parte II. A Parte I será mais voltada para a compreensão do papel dos antioxidantes endógenos e exógenos na manutenção da homeostase redox para prevenir o estresse oxidativo – a nave-mãe da “doença” e potencialmente a razão da patologia grave relacionada à spike.
Oxidantes
Os oxidantes são aceptores de elétrons. O elemento químico oxigênio, peróxido de hidrogênio (H2O2) e halogênios são oxidantes bem estabelecidos. Espécies reativas de oxigênio (ROS) e espécies reativas de nitrogênio (RNS) são produtos químicos altamente reativos formados a partir do oxigênio diatômico (O2). ROS e RNS são subprodutos do metabolismo mitocondrial normal do oxigênio (como parte da produção de ATP → como parte da cadeia de transporte de elétrons → como parte do último componente da respiração aeróbica). Os radicais superóxidos (O2•-) podem se formar quando um elétron de run-off encontra um oxigênio sobressalente durante o processo de transporte de elétrons, e esses tipos de ROS são conversíveis em outras espécies reativas, uma vez exportadas da mitocôndria para danificar o DNA, lipídios e proteínas e para potencialmente alterar a função celular.
Tal como acontece com todas as coisas na natureza e, o equilíbrio é fundamental para a manutenção adequada de qualquer sistema, e os antioxidantes desempenham papéis importantes no contrapeso de ROS e RNS como parte do funcionamento normal dos sistemas.
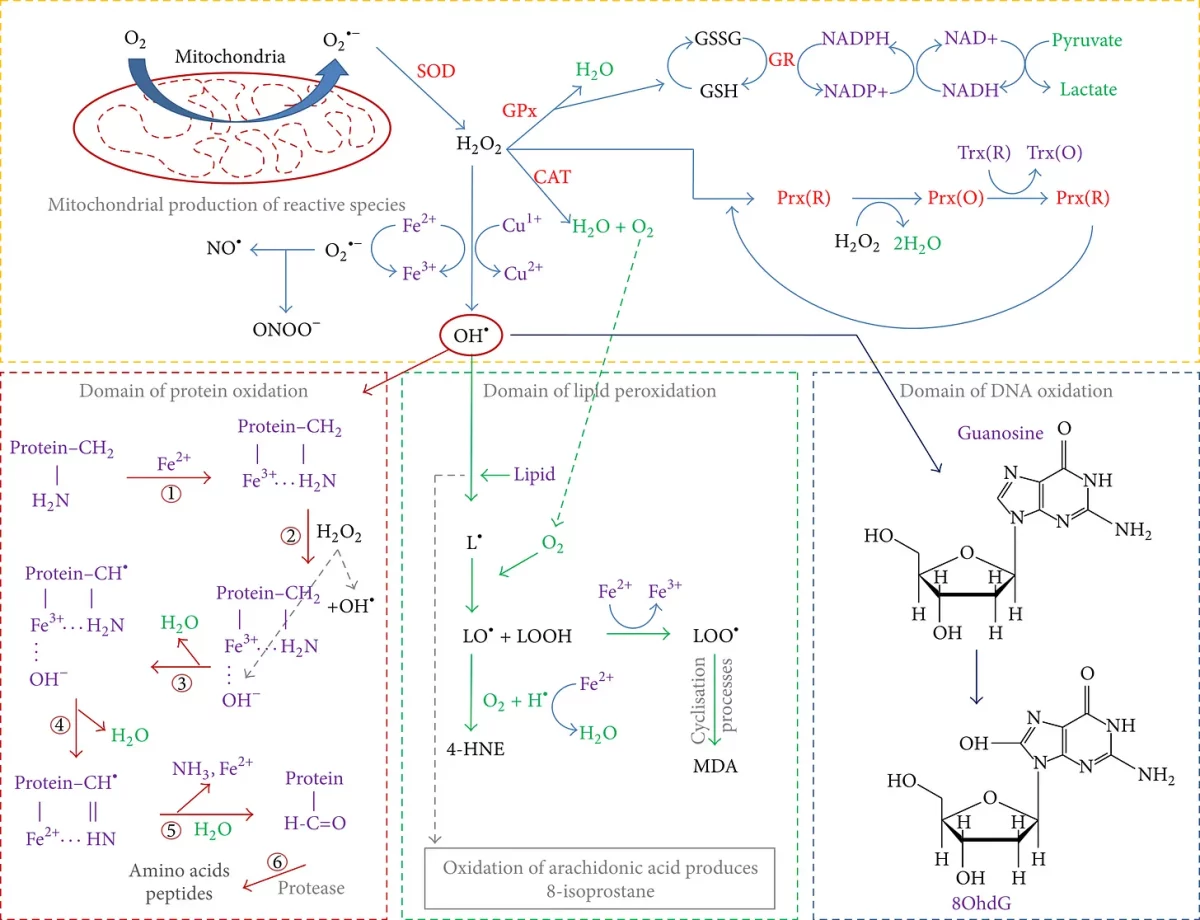
A figura 1 parece terrível, mas não é tão ruim e o ponto principal que quero transmitir ao apresentá-la é demonstrar o ato de equilíbrio sempre presente em nossas células com relação aos papéis de oxidantes e antioxidantes.
Antioxidante
Um antioxidante é um composto (algo formado por um monte de moléculas idênticas) que inibe a oxidação, ou seja: impede que outras coisas sejam oxidadas. Oxidação é uma palavra muito desagradável para mim. Sempre acho que deve ter algo a ver com o oxigênio – e tem – mas não de forma completa. Originalmente, a oxidação implicava uma reação com o oxigênio para formar um óxido. Mas isso é incompleto porque as reações de oxidação nem sempre envolvem oxigênio. Uma definição mais completa é a seguinte:
Todos os processos envolvendo a perda de elétrons → o aumento do estado de oxidação de uma espécie química.
Portanto, a oxidação é sobre a perda de elétrons. E assim, a antioxidação, trata-se de inibir a perda de elétrons. Os elétrons são partículas subatômicas com carga elétrica negativa 1. Sempre que ouvir falar em cobranças, pense no equilíbrio. Negativo e positivo. Dar e receber. É importante conceituar isso neste ponto por causa de algo chamado reação redox. Redox é uma palavra que é o composto (ou portmanteau – ooh la la) das palavras redução e oxidação. Você provavelmente pode imaginar que a redução pode ser o oposto da oxidação – e você estaria certo. Redução é ganhar elétrons.
Redox é uma dessas coisas incríveis encontradas no funcionamento inerente da biologia e da química que envolve conceitos como compartilhamento, ligação e emparelhamento. Viu? Não somos tão diferentes do velho Sr. redox. Ou devo dizer, Sr. e Sra. Redox.
Os antioxidantes são diferentes dos agentes redutores, pois os últimos reduzem outras substâncias, enquanto os primeiros impedem que outras substâncias sejam reduzidas.
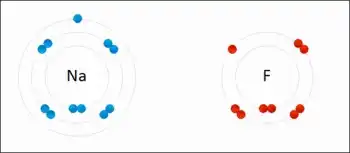
Redução e oxidação são processos inextricavelmente ligados que envolvem a doação de um elétron em sítios atômicos de uma molécula para outra. Diz-se que o doador de elétrons está oxidado e o receptor de elétrons está reduzido. A Figura 2 mostra a reação redox entre os átomos de Sódio (Na) e Flúor (F), em que o átomo de Na doa um elétron (foi oxidado) e o átomo de F aceita o elétron (foi reduzido).
As reações redox são onipresentes na natureza. Exemplos de reações redox são fotossíntese, fogo, baterias e síntese de energia: a produção de ATP via cadeia de transferência de elétrons em humanos, por exemplo. São processos constantes e dinâmicos essenciais à vida. Uma das reações redox mais importantes na biologia é a respiração celular, na qual a glicose (açúcar) é oxidada a CO2 e o oxigênio é reduzido a água. Caramba, é muito lindo, não é? Abordarei isso com mais detalhes na Parte II desta série.
Efetivamente, uma reação redox é a troca de elétrons para o “propósito” da troca de energia, pela qual os antioxidantes equilibram os subprodutos (como ROS) das reações redox dentro de uma célula.
Tioredoxina
Tioredoxina (Trx) é uma proteína antioxidante como parte de um sistema antioxidante central em células de mamíferos que envolve um sistema dissulfeto redutase que regula o equilíbrio ditiol/dissulfeto. Diga isso cinco vezes rápido. O sistema Trx é essencial para a manutenção de um ambiente reduzido dentro das células. As células têm muitos compartimentos subcelulares e dentro desses compartimentos subcelulares, como o retículo endoplasmático e o núcleo, por exemplo, existem diferentes distribuições de redutores e oxidantes. Isso é para manter os respectivos ambientes oxidantes e redutores necessários para as funções específicas de cada compartimento.
Então, como isso se relaciona com a prevenção da infecção de células por SARS-CoV-2? Bem, tem algo a ver com o fato de que a função primária de Trx é, de fato, a redução de resíduos de cisteína oxidada e a clivagem de pontes dissulfeto. Para entender o que isso significa, vamos passar para ligações dissulfeto, tióis e o papel vital do aminoácido cisteína.
Tióis e ligações/pontes dissulfeto
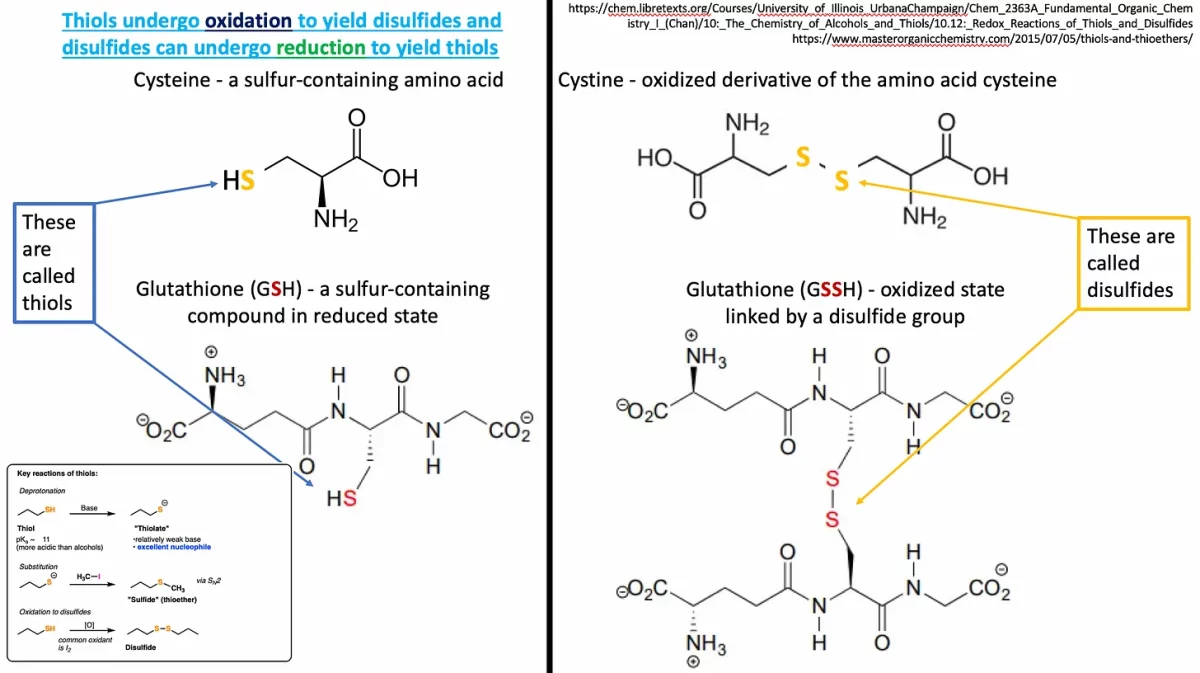
Um tiol é um composto organossulfurado da forma R-SH. Tem um grupo sulfidrila (o -SH) ligado a um grupo R. Um grupo R em química é uma abreviação de qualquer grupo no qual um átomo de carbono ou hidrogênio está ligado ao restante da molécula. Um exemplo de tiol é o aminoácido cisteína. Outro exemplo é o necessitador de vinificação e a glutationa antioxidante. Curiosamente, pode-se medir a quantidade de estresse oxidativo celular determinando a proporção de glutationa reduzida para oxidada dentro das células.
Uma ligação dissulfeto envolve dois enxofres ligados – geralmente chamados de ponte dissulfeto. Fiz um pequeno esquema (Figura 3) para demonstrar a relação entre tióis e dissulfetos. Há uma linha preta grossa entre esses dois estados (reduzido – esquerdo e oxidado – direito), mas não se engane, esses são estados reversíveis. Pontes dissulfeto são ligações covalentes (ou ligações cruzadas) entre 2 cisteínas. Tudo o que precisamos é de um aceptor de elétrons, como nosso amigo oxigênio, para que essa ponte seja construída.
Cisteína
O jogador crítico na história deste artigo e na própria vida é a cisteína. Ah, cisteína fedorenta. Sem você, a vida seria muito chata. De fato, sem cisteína, também não haveria história de SARS-CoV-2/COVID-19! A cisteína é um dos dois aminoácidos que contêm enxofre fedorento (o outro é a metionina), mas apenas a cisteína possui um grupo tiol ionizável. O enxofre torna a cisteína fedorenta e especial precisamente por causa de sua incrível capacidade de se ligar a si mesma para formar pontes de dissulfeto entre as cisteínas. Para aqueles que conhecem um pouco sobre proteínas, também se lembrarão da importância dessas pontes dissulfeto com relação ao dobramento, estrutura e estabilidade da proteína. Isso não pode ser enfatizado o suficiente.
As cisteínas são sensíveis ao redox devido às suas cadeias laterais de tiol redutoras. As cisteínas são mais altamente reativas quando sua cadeia lateral de tiol está na forma tiolato, ou seja, desprotonada em pH fisiológico (S-). Isso significa apenas que o hidrogênio foi retirado do grupo sulfidrila como parte de uma reação ácido-base. O grupo tiolato é subsequentemente oxidável por ROS e RNS, levando a modificações pós-traducionais. Basicamente, uma vez que os enxofres estão “livres”, eles podem se ligar a outros enxofres para formar a cistina: um dímero formado quando duas cisteínas são unidas por seus enxofres.
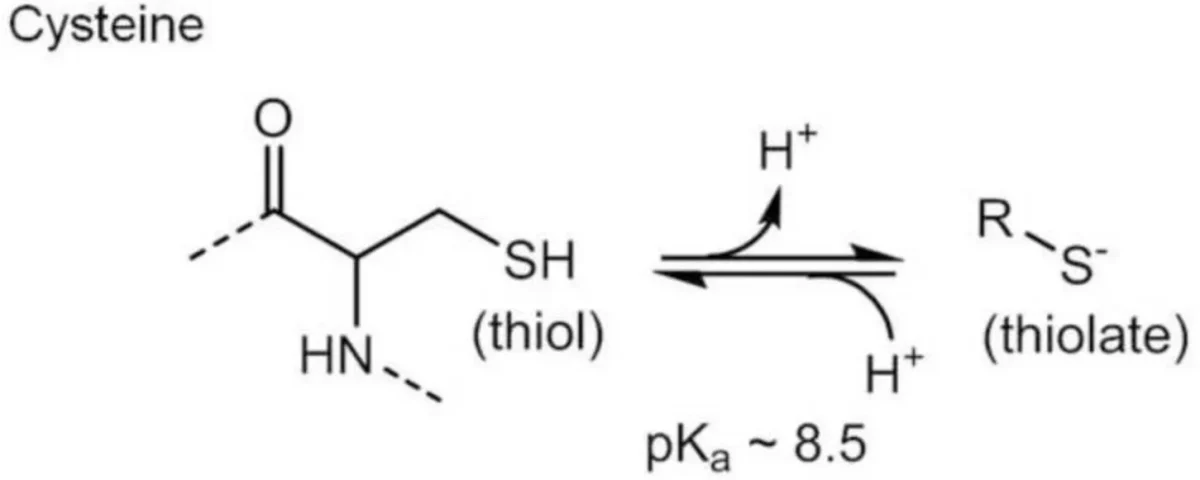
As cisteínas podem interagir com ROS para produzir não apenas pontes dissulfeto, mas ácidos sulfínicos, sulfênicos e sulfônicos e, naturalmente, isso pode perturbar a função da proteína. Mas, como todas as coisas na natureza, eles também têm funções. A capacidade da cisteína de adotar uma variedade de estados de oxidação a torna um regulador chave da homeostase e sinalização redox. Portanto, as pontes dissulfeto são o “ponto final” construtivo da oxidação da cisteína, por assim dizer, e contribuem para o funcionamento adequado da proteína. Os dissulfetos também são importantes porque desempenham funções no ciclo redox e na regulação de enzimas e fatores de transcrição envolvidos nos processos de sinalização celular.
Trx redutase e seu substrato Trx adoram cisteínas redutoras, então você pode imaginar que na presença delas, um ambiente redutor resultaria → ou seja: não há muitas pontes dissulfeto. Você consegue pensar em um compartimento subcelular que favoreceria a falta de pontes dissulfeto? Dica: Veja acima.
O papel dos antioxidantes na infecciosidade em relação à ligação SARS-CoV-2:ACE-2
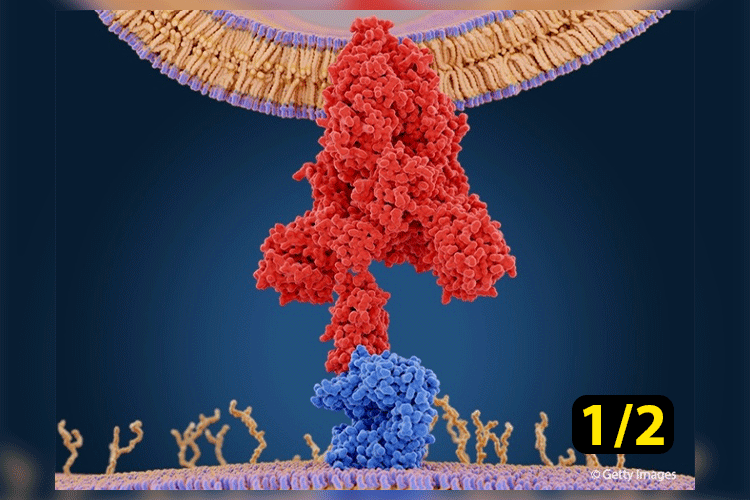
Tanto a ACE-2 quanto a proteína spike possuem muitas cisteínas. Na verdade, as cisteínas não são excessivamente abundantes como aminoácidos em mamíferos, mas altamente conservadas. Existem 9 cisteínas no RBD da proteína spike e 8 no ACE-2. Cada uma dessas proteínas tem vários conjuntos de ligações dissulfeto para garantir suas dobras seguras. O domínio de ligação ao receptor SARS-nCoV-2 (RBD) mostrado ligado à ACE-2 humana na Figura 5, possui 4 conjuntos de pontes dissulfeto: três (C336–C361, C379–C432 e C391–C525) que estabilizam a proteína e um (C480–C488) que conecta as alças na extremidade distal do motivo de ligação ao receptor (RBM). O RBM no SARS-CoV-2 RBD entra em contato com o lado inferior do ACE-2 humano. A ACE-2 humana contém uma ligação dissulfeto específica (C133-C141), na extremidade oposta do RBM, conforme mostrado na Figura 4 à direita em preto abaixo.
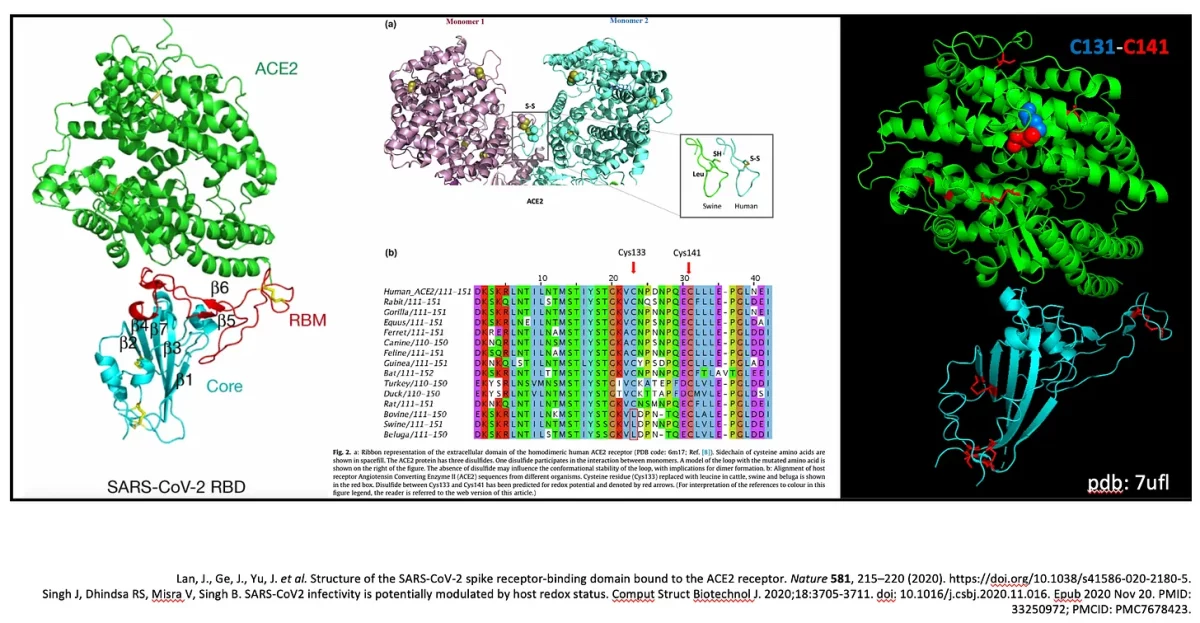
Aqui está uma reviravolta. Vacas e porcos têm uma Leucina na posição 133 em seus ACE-2s, então não há ligação dissulfeto no ACE-2 desses animais. Em vez disso, há uma leucina e um grupo tiol. Adivinha? Vacas e porcos são imunes ao SARS-CoV-2. Assim, a suscetibilidade ao SARS-CoV-2 está alinhada com esta ligação dissulfeto presente e intacta, como no ACE-2 humano.
Como ponto de interesse, os motivos C-X-X-C são domínios importantes de proteínas de ligação a metais e oxidorredutases. A ACE-2 também contém um domínio dobrado semelhante à ferredoxina (proteína ferro-enxofre) que medeia a transferência de elétrons para reações metabólicas. De fato, o local ativo em Trx contém um tiol em um motivo C-X-X-C e esta é a chave para a capacidade da tiorredoxina de reduzir outras proteínas. Mantenha isso em mente.
Lembra do que falamos sobre antioxidantes? Vamos nos fundir no ponto 2.
- As proteínas SARS-CoV-2 RBD e ACE-2 têm dissulfetos redox ativos atuados por antioxidantes
Os antioxidantes equilibram compostos oxidados e reduzidos dentro de uma célula. Os dissulfetos redox ativos sofrem ativamente reações redox para reduzir a tióis e podem voltar a dissulfetos novamente. É claro que isso é determinado pelos agentes redutores presentes e se o ambiente em geral é ou não redutor ou oxidante.
Imagine isso. O Trx pode reduzir as ligações dissulfeto de ACE-2 para produzir os grupos sulfidrila sobre os quais falamos. Isso torna a ACE-2 efetivamente inativa devido ao fato de que ela não pode se dobrar corretamente sem que suas pontes dissulfeto estejam intactas. Portanto, pela ação do sistema Trx, o SARS-CoV-2 pode ser impedido de se ligar e infectar as células. Isso é ilustrado na Figura 6 abaixo em um diagrama extraído da referência 20, em que os autores concluem que indivíduos mais velhos e/ou indivíduos com condições pré-existentes ou “estados de doença” têm maior vulnerabilidade ao SARS-CoV-2 devido ao aumento do estresse oxidativo.
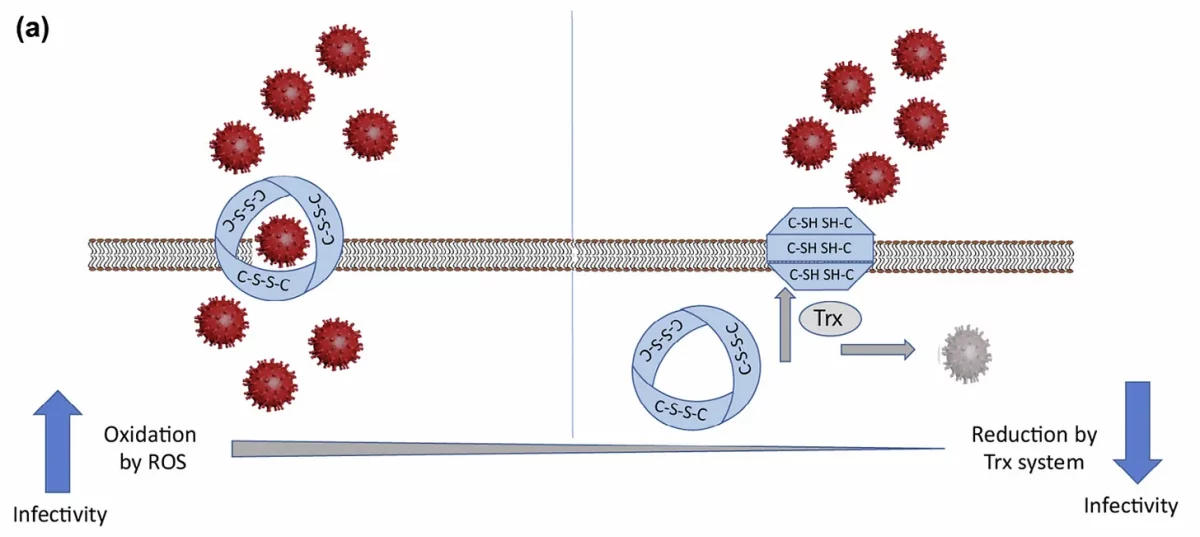
Foi demonstrado neste artigo específico (referência 20), e também é a essência do artigo original que pretendia revisar (referência 2), que a patogênese e a gravidade do COVID-19 dependem do redox, uma vez que as partes interativas do ACE-2 (o domínio de dobra semelhante à ferrodoxina) e a proteína spike, possuem dissulfetos redox-ativos, como mencionado. Curiosamente, sabe-se que a ferrodoxina passa elétrons para a tiorredoxina que, por sua vez, reduz as pontes dissulfeto.
Portanto, este é o ponto crucial da história. Uma vez que existe uma dependência de pontes dissulfureto intactas para ligação ACE-2:spike adequada, isto pode ser explorado, por assim dizer, para minimizar a ligação e subsequente infecção das células. Especificamente, o Trx e o sistema Trx podem atuar nas ligações dissulfeto da ACE-2 para anular a entrada do SARS-CoV-2. Ou seja, se as pontes dissulfeto reativas na ACE-2 forem reduzidas, a proteína não estará na conformação adequada para se ligar ao SARS-CoV-2. Portanto, a ligação não ocorre e a infecção não ocorre. A evidência que apoia isso reside no fato de que vacas e porcos são imunes ao SARS-CoV-2. Além disso, o sistema Trx também pode atuar diretamente no SARS-CoV-2 para dissolvê-lo efetivamente por meio do mesmo mecanismo: as ligações dissulfeto são reduzidas para que as proteínas spike não estejam na conformação adequada para ligar o ACE-2.
Aqui está o problema e por que algumas pessoas estão se saindo muito mal com o SARS-CoV-2 e, bem, muitas coisas: a maioria das pessoas é efetivamente deficiente em antioxidantes e tem excesso de ROS e RNS fazendo uma festa, festa, festa. Este é precisamente o estresse oxidativo e, como descreverei na Parte II, o estresse oxidativo está associado a uma infinidade de “doenças”. Novamente, quando o equilíbrio de antioxidantes e ROS ou RNS é interrompido, por excesso ou deficiência de qualquer um deles, o corpo humano experimenta uma forte mudança redox, comumente referida como nada menos que estresse oxidativo.
E agora podemos deslizar para o ponto 3.
- O status redox (o equilíbrio de antioxidantes e espécies reativas) que regula o papel dos resíduos de cisteína do ambiente celular é vital e uma mudança no status redox pré-determina os estados de “doença”
Deslocamento redox
Uma mudança redox é uma mudança no equilíbrio entre compostos oxidados e reduzidos dentro de uma célula (ver referência 3). Em condições “normais”, uma célula saudável mantém esse equilíbrio por meio de antioxidantes endógenos que neutralizam a produção contínua de ROS, que é um subproduto comum do metabolismo. Imagine que, se você tiver uma deficiência de antioxidantes, talvez não consiga remover ROS e RNS suficientes e, em seguida, Houston, começará a ter problemas. Que tipo de problemas? Bem, além do envelhecimento (bem, pelo menos algumas pessoas pensam no envelhecimento como um problema), estados de doença relacionados à inflamação e distúrbios metabólicos. Isso ocorre porque há um declínio no equilíbrio tiol/dissulfeto, sobre o qual estamos falando o tempo todo. O desequilíbrio redox pode ser medido por tióis de proteínas séricas e pode ser usado para prever doenças clínicas. Portanto, se você estiver interessado em saber se está com desequilíbrio redox, meça seus tióis de proteínas séricas.
Talvez a melhor maneira de demonstrar o estado redox contínuo e variável em relação ao envelhecimento e à doença, por exemplo, seja com uma imagem. No esquema abaixo na Figura 7, no canto superior esquerdo, você pode ver os estados oxidado e reduzido da glutationa (como um exemplo de par tiol/dissulfeto), em que o estado reduzido tem um tiol ligado e o estado oxidado envolve uma ponte dissulfeto.
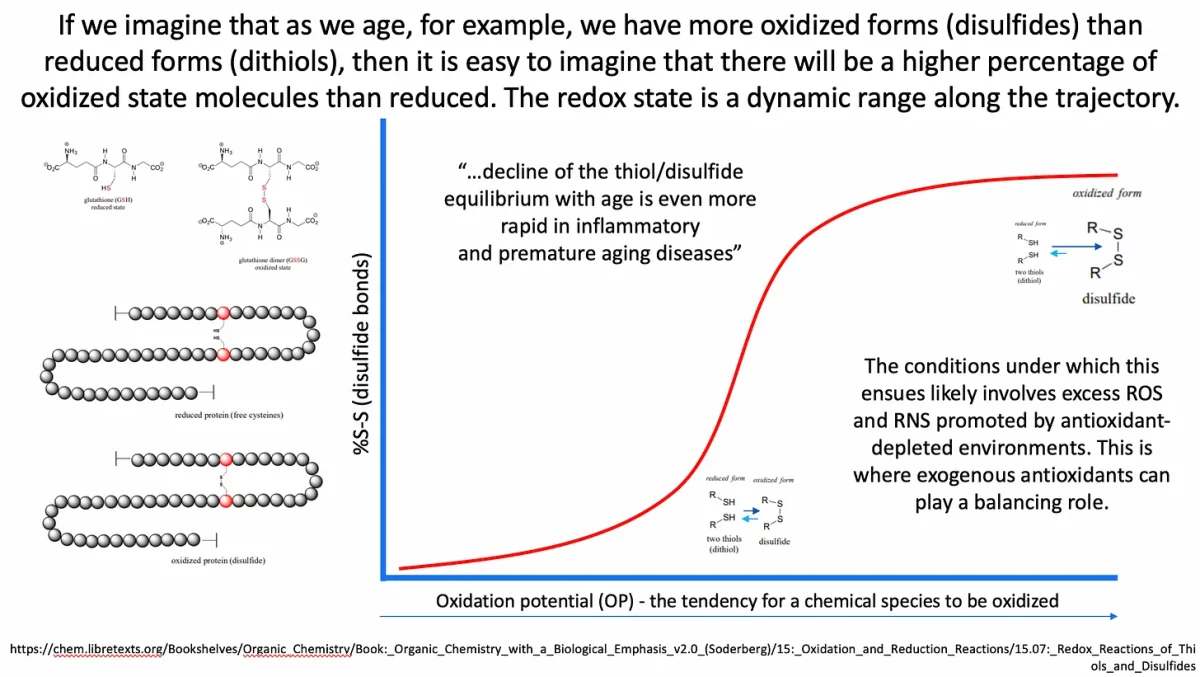
No contexto do artigo original, os autores descrevem um ambiente onde há um declínio no equilíbrio tiol/dissulfeto conforme o envelhecimento, e isso leva a um aumento da suscetibilidade ao COVID-19. No contexto do esquema acima, você pode imaginar que alguém com COVID-19 (ou câncer) pode ter um potencial de oxidação/redução (ORP) maior do que alguém sem essas condições. Portanto, se apontássemos para um ponto na trajetória vermelha onde alguém com COVID-19 grave estaria em termos de OP (Potencial de Oxidação), provavelmente seria no topo da trajetória. O que isso necessariamente significa é que essa pessoa provavelmente teria mais moléculas de enxofre no estado oxidado (ou seja: uma proporção mais alta de dissulfetos para ditióis (tióis de proteína sérica reduzidos)) indicando que os efeitos antioxidantes são abaixo do ideal.
É neste ponto que os deixo enquanto continuo trabalhando na Parte II. Por favor, se você é químico e vê que errei em algo, me avise nos comentários.
A mensagem mais importante que posso transmitir nesta Parte I é o valor dos antioxidantes – tanto como agentes endógenos quanto exógenos. Sempre iremos metabolizar oxigênio, e por isso sempre teremos radicais livres, ROS e RNS. E talvez à medida que envelhecemos, o equilíbrio dos antioxidantes endógenos resultará na modulação redox. Não há muito que possamos fazer sobre isso. Mas podemos nos ajudar a nos manter vitais e saudáveis (equilibrados) mantendo um suprimento de antioxidantes exógenos de fontes alimentares para contrabalançar os danos induzidos por esses subprodutos normais, embora prejudiciais. Felizmente, alguns dos alimentos mais saborosos, como mirtilos e chocolate, são incrivelmente ricos em antioxidantes.
- Li MY, Li L, Zhang Y, Wang XS. Expressão do gene ACE2 do receptor celular SARS-CoV-2 em uma ampla variedade de tecidos humanos. Infect Dis Poor. 28 de abril de 2020;9(1):45. doi: 10.1186/s40249-020-00662-x. PMID: 32345362; PMCID: PMC7186534.
- Schwartz L, Aparicio-Alonso M, Henry M, Radman M, Attal R, Bakkar A. A toxicidade da proteína spike do COVID-19 é um fenômeno de mudança redox: uma nova abordagem terapêutica. Free Radic Biol Med. 29 de junho de 2023;206:106-110. doi: 10.1016/j.freeradbiomed.2023.05.034. Epub antes da impressão. Errata em: Free Radic Biol Med. 2023, 27 de julho;207:226. PMID: 37392949.
- Fraunberger EA, Scola G, Laliberté VL, Duong A, Andreazza AC. Modulações redox, antioxidantes e distúrbios neuropsiquiátricos. Oxid Med Cell Longev. 2016;2016:4729192. doi: 10.1155/2016/4729192. Epub 2015 10 de novembro. PMID: 26640614; PMCID: PMC4657108.
- Matsuzaki S, Szweda PA, Szweda LI, Humphries KM. Produção regulada de radicais livres pela cadeia de transporte de elétrons mitocondrial: Pré-condicionamento isquêmico cardíaco. Adv Drug Deliv Rev. 2009 Nov 30;61(14):1324-31. doi: 10.1016/j.addr.2009.05.008. Epub 26 de agosto de 2009. PMID: 19716389; PMCID: PMC2789306.
- https://en.wikipedia.org/wiki/Redox
- Lu J, Holmgren A. O sistema antioxidante tioredoxina. Free Radic Biol Med. 2014 janeiro;66:75-87. doi: 10.1016/j.freeradbiomed.2013.07.036. Epub 2013, 27 de julho. PMID: 23899494.
- Smith KA, Waypa GB, Schumacker PT. Sinalização redox durante hipóxia em células de mamíferos. Redox Biol. 2017 Out; 13:228-234. doi: 10.1016/j.redox.2017.05.020. Epub 2017 31 de maio. PMID: 28595160; PMCID: PMC5460738.
- https://en.wikipedia.org/wiki/Thioredoxin
- https://www.chem.ucla.edu/~harding/IGOC/R/r_group.html
- Pastore A, Piemonte F, Locatelli M, Lo Russo A, Gaeta LM, Tozzi G, Federici G (agosto de 2001). “Determinação da glutationa total, reduzida e oxidada no sangue em pacientes pediátricos”. Química Clínica. 47 (8): 1467–1469. doi:10.1093/clinchem/47.8.1467.
- Lu SC (maio de 2013). “Síntese de glutationa”. Biochimica et Biophysica Acta (BBA) – Assuntos Gerais. 1830 (5): 3143–3153. doi:10.1016/j.bbagen.2012.09.008.
- William J. Wedemeyer, Ervin Welker, Mahesh Narayan, Harold A. Scheraga. Bioquímica 2000, 39, 15, 4207–4216. Data de publicação: 21 de março de 2000. https://doi.org/10.1021/bi992922o.
- Poole LB. Os fundamentos de tióis e cisteínas em biologia redox e química. Free Radic Biol Med. 2015 março;80:148-57. doi: 10.1016/j.freeradbiomed.2014.11.013. Epub 2014, 27 de novembro. PMID: 25433365; PMCID: PMC4355186.
- Fra A, Yoboue ED e Sitia R (2017) Cisteínas como interruptores moleculares redox e alvos de doenças. Frente. Mol. Neurosci. 10:167. doi: 10.3389/fnmol.2017.00167.
- Alcock LJ, Perkins MV, Chalker JM. Métodos químicos para mapear a oxidação da cisteína. Chem Soc Rev. 2018 Jan 2;47(1):231-268. doi: 10.1039/c7cs00607a. PMID: 29242887.
- Leonard SE, Carroll KS. Abordagens “ômicas” químicas para entender a oxidação da proteína cisteína em biologia. Curr Opin Chem Biol. 2011 fev;15(1):88-102. doi: 10.1016/j.cbpa.2010.11.012. Epub 2010 3 de dezembro. PMID: 21130680.
- Maryam Ghasemitarei, Angela Privat-Maldonado, Maksudbek Yusupov, Shadi Rahnama, Annemie Bogaerts, Mohammad Reza Ejtehadi. Efeito da oxidação de cisteína no domínio de ligação ao receptor SARS-CoV-2 em sua interação com dois receptores celulares: insights de simulações atomísticas. Journal of Chemical Information and Modeling 2022, 62 (1), 129-141.
- Sun MA, Zhang Q, Wang Y, Ge W, Guo D. Previsão de cisteínas sensíveis a redox usando distância sequencial e outros recursos baseados em sequência. BMC Bioinformática. 24 de agosto de 2016;17(1):316. doi: 10.1186/s12859-016-1185-4. PMID: 27553667; PMCID: PMC4995733.
- Attila Miseta, Peter Csutora, Relação entre a Ocorrência de Cisteína em Proteínas e a Complexidade dos Organismos, Biologia Molecular e Evolução, Volume 17, Issue 8, August 2000, Pages 1232–1239, https://doi.org/10.1093/oxfordjournals .molbev.a026406
- Singh J, Dhindsa RS, Misra V, Singh B. A infectividade do SARS-CoV2 é potencialmente modulada pelo status redox do hospedeiro. Comput Struct Biotechnol J. 2020;18:3705-3711. doi: 10.1016/j.csbj.2020.11.016. Epub 2020, 20 de novembro. PMID: 33250972; PMCID: PMC7678423.
- Lan, J., Ge, J., Yu, J. et al. Estrutura do domínio de ligação ao receptor SARS-CoV-2 spike ligado ao receptor ACE2. Natureza 581, 215–220 (2020). https://doi.org/10.1038/s41586-020-2180-5.
- Shuber, A.P., E.C. Orr, M.A. Recny, P.F. Schendel, H.D. May, N.L. Schauer e J.G. Ferry. 1986. Clonagem, expressão e seqüência de nucleotídeos dos genes da desidrogenase formato de metanobacterium formicicum. J. Biol. Chem.261:12942–12947.
- Ammendola, S., C. A. Raia, C. Caruso, L. Camardella, S. D’Auria, M. De Rosa, and M. Rossi. 1992. Álcool desidrogenase dependente de NAD(+) termoestável de Sulfolobus solfataricus: determinação da seqüência de genes e proteínas e relação com outras álcool desidrogenases. Bioquímica31:12514–12523.
- Hati S, Bhattacharyya S. Impacto do Equilíbrio Tiol-Dissulfeto na Ligação da Proteína Spike Covid-19 com Angiotensina Receptor da Enzima 2 em Conversão. ACS Ômega. 23 de junho de 2020;5(26):16292-16298. doi: 10.1021/acsomega.0c02125. PMID: 32656452; PMCID: PMC7346263.
- Sies, “Bioquímica do estresse oxidativo”, Angewandte Chemie International Edition em inglês, vol. 25, não. 12, pp. 1058–1071, 1986.
- Banne, A.F., Amiri, A., & Pero, R.W. (2003). Nível reduzido de tióis séricos em pacientes com diagnóstico de doença ativa. Journal of Anti-Aging Medicine, 6(4), 327–334. doi:10.1089/109454503323028920.