Abstrato
A infecção por coronavírus da síndrome respiratória aguda grave (SARS-CoV-2) é a causa de uma pandemia mundial, atualmente com opções terapêuticas limitadas. A glicoproteína spike e a proteína do envelope do SARS-CoV-2, contendo pontes dissulfeto para estabilização, representam um alvo atraente, pois são essenciais para a ligação ao receptor ACE2 nas células hospedeiras presentes na mucosa nasal. Bromelaína e Acetilcisteína (BromAc) tem ação sinérgica contra glicoproteínas por quebra de ligações glicosídicas e pontes dissulfeto. Procuramos determinar o efeito do BromAc nas proteínas spike e envelope e seu potencial para reduzir a infectividade nas células hospedeiras. As proteínas spike e envelope SARS-CoV-2 recombinantes foram interrompidas por BromAc. As pontes dissulfeto de proteína de envelope e spike foram reduzidas pela acetilcisteína. Na cultura de vírus inteiro in vitro de mutantes de tipo selvagem e spike, o SARS-CoV-2 demonstrou uma inativação dependente da concentração do tratamento com BromAc, mas não de agentes únicos. Testes clínicos por meio de administração nasal em pacientes com infecção precoce por SARS-CoV-2 são iminentes.
Palavras-chave: SARS-CoV-2, Bromelaína, Acetilcisteína, BromAc, reaproveitamento de medicamentos
1. Introdução
A recentemente emergente síndrome respiratória aguda grave coronavírus 2 (SARS-CoV-2) é o agente causador da doença de coronavírus 2019 (COVID-19), que pode variar de formas assintomáticas a formas graves e letais com uma síndrome de resposta inflamatória sistêmica. Em 21 de fevereiro de 2021, mais de 111 milhões de casos confirmados foram relatados, com uma mortalidade geral estimada de 2,2%. Atualmente, existem poucos agentes terapêuticos comprovadamente benéficos na redução da progressão da doença em estágio inicial e tardio. Embora existam, felizmente, muitos candidatos a vacina, sua ampla disponibilidade para vacinação pode não ser imediata, a duração da proteção imunológica pode ser limitada, e a eficácia das vacinas pode ser reduzida por novas variantes de SARS-CoV-2. A exploração contínua de tratamentos eficazes é, portanto, ainda necessária.
Estruturalmente, o SARS-CoV-2 contém proteínas spike de superfície, proteínas de membrana e proteínas de envelope, bem como nucleoproteínas internas que empacotam o RNA. A proteína spike é um complexo de glicoproteína homotrímero com diferentes funções realizadas por meio de modificações conformacionais dinâmicas, baseadas em parte em pontes dissulfeto. Ele permite a infecção de células-alvo pela ligação aos receptores da enzima conversora de angiotensina humana (ACE2), entre outros, que desencadeiam a proteólise pela protease transmembrana serina 2 (TMPRSS2), furina e talvez outras proteases, levando ao vírion e à fusão da membrana da célula hospedeira.
A entrada de vírus em células de mamíferos, ou “internalização do vírus”, é um mecanismo chave da infecção por vírus envelopados e é baseada em mudanças conformacionais dinâmicas de suas glicoproteínas de superfície, ou seja, mediadas pela redução da ligação dissulfeto e reguladas por oxidorredutases e proteases da superfície celular. Foi demonstrado que a entrada do SARS-CoV-2 nas células hospedeiras começa com a desestabilização da proteína spike por meio da transição mecânica alostérica, que induz uma mudança conformacional do estado fechado “para baixo” para abrir o estado “para cima” do domínio de ligação ao receptor (RBD) da proteína spike. As mudanças conformacionais de RBD e ligação do vírus são induzidas por TMPRSS2 ou Catepsina L, que desencadeiam a transição do estado de pré-fusão para pós-fusão. A energia liberada pela redução da ligação dissulfeto aumenta a flexibilidade da proteína, que é máxima quando o estado reduzido está completo, permitindo assim a fusão das membranas hospedeiro-vírus, que de outra forma seria impossível devido às forças repulsivas de hidratação presentes antes da redução.
A bromelaína é extraída principalmente do caule da planta do abacaxi (Ananas comosus) e contém uma série de enzimas que lhe conferem a capacidade de hidrolisar ligações glicosídicas em carboidratos complexos. Estudos anteriores indicaram que a bromelaína remove as proteínas spike e hemaglutinina do vírus Semliki Forest, vírus Sindbis, coronavírus gastrointestinal de camundongo, vírus da encefalomielite hemaglutinante e vírus influenza H1N1. Como molécula terapêutica, é utilizado para desbridamento de queimaduras. A acetilcisteína é um poderoso antioxidante que é comumente nebulizado nas vias aéreas para acúmulo de muco e também é usado como agente hepatoprotetor na overdose de paracetamol. Mais importante no presente contexto, a acetilcisteína reduz as pontes dissulfeto. Além disso, a associação das proteínas spike e envelope por seus respectivos motivos triplos de cisteína garante a hipótese de impactar a estabilidade do vírion após a ruptura da ponte dissulfeto pela ação da acetilcisteína. A combinação de bromelaína e acetilcisteína (BromAc) apresenta um efeito mucolítico sinérgico que é utilizado no tratamento de tumores mucinosos e como um quimiossensibilizador de várias drogas anticancerígenas. Essas diferentes ações se devem à capacidade do BromAc de desdobrar as estruturas moleculares de glicoproteínas complexas, permitindo assim que ocorra a ligação devido à alta afinidade entre RBD e ACE2.
Portanto, no presente estudo, decidimos determinar se o BromAc pode interromper a integridade das proteínas spike e envelope do SARS-CoV-2 e, subsequentemente, examinar seu potencial de inativação contra a replicação in vitro de duas cepas virais, incluindo uma com uma alteração mutante de spike do novo local de clivagem S1/S2.
2. Materiais e métodos
2.1. Materiais
O API de bromelaína foi fabricado por Mucpharm Pty Ltd (Kogarah, Austrália) como um pó estéril. A acetilcisteína foi adquirida da Link Pharma (Cat# AUST R 170803; Warriewood, Austrália). A proteína spike SARS-COV-2 recombinante foi obtida da SinoBiological (Cat# 40589-V08B1; Beijing, China). A proteína do envelope recombinante foi obtida de MyBioSource (Cat# MBS8309649; San Diego, CA, EUA). Todos os outros reagentes eram da Sigma Aldrich (St. Louis, MO, EUA).
2.2. Eletroforese de gel de envelope e spike recombinante
As proteínas spike ou envelope foram reconstituídas em água destilada estéril de acordo com as instruções do fabricante e as alíquotas foram congeladas a -20 °C. Dois microgramas e meio de spike ou proteína de envelope foram incubados com 50 ou 100 µg/mL de bromelaína, 20 mg/mL de acetilcisteína ou uma combinação de ambos em água Milli-Q. O controle não continha drogas. O volume total da reação foi de 15 µL cada. Após 30 min de incubação a 37 °C, 5 µL de tampão de amostra foram adicionados a cada reação. Um total de 20 µL de cada reação foi submetido a eletroforese em um SDS-PAGE (Cat# 456-1095; Bio-Rad Hercules, CA, EUA). Os géis foram corados com azul de Coomassie.
2.3. Detecção espectral de UV de pontes dissulfeto em proteínas spike e envelope
O método de Iyer e Klee para a medição da taxa de redução das pontes dissulfeto tem sido usado para detectar pontes dissulfeto em proteínas spike e envelope. A proteína spike SARS-CoV-2 recombinante a uma concentração de 3,0 µg/mL em solução salina tamponada com fosfato (PBS) (pH 7,0) contendo ácido etilenodiaminotetracético (EDTA) 1 mM foi incubada com 0, 10, 20, 40 e 50 µL de Acetilcisteína (0,5 M), agitado a 37 °C por 30 min, seguido pela adição equivalente de Ditiotreitol (DTT) (0,5 M) e agitado por mais 30 min a 37 °C. A proteína spike foi incubada em paralelo apenas com DTT (0,5 M) como antes sem qualquer acetilcisteína e agitada a 37°C por 30 min. A absorbância foi então lida a 310 nm. A detecção espectral de UV de pontes dissulfeto na proteína do envelope foi realizada de maneira semelhante.
2.4. Inativação do vírus inteiro SARS-CoV-2 com BromAc
Respeitando totalmente as orientações provisórias de biossegurança da Organização Mundial da Saúde (OMS) relacionadas à doença do coronavírus, os testes de inativação do vírus SARS-CoV-2 foram realizados com uma cepa do tipo selvagem (WT) representativa dos primeiros vírus europeus circulantes (número de acesso GISAID EPI_ISL_578176). Uma segunda cepa de SARS-CoV-2 (denotada como ∆S), relatada por meio de vigilância genômica de rotina na região de Auvergne-Rhône-Alpes, na França, foi adicionada aos testes de inativação devido a uma mutação rara no local de clivagem S1/S2 e sua disponibilidade de cultura no laboratório (número de acesso GISAID EPI_ISL_578177).
Esses testes foram conduzidos com concentrações incrementais de bromelaína sozinha (0, 25, 50, 100 e 250 µg/mL), acetilcisteína sozinha (20 mg/mL) e a reação cruzada das diferentes concentrações de bromelaína combinada com uma constante de 20 mg/mL de formulação de acetilcisteína, contra duas diluições de cultura de vírus a 105,5 e 104,5 TCID50/mL. Após 1 h de exposição à droga a 37 °C, todas as condições, incluindo o controle, foram diluídas 100 vezes para evitar citotoxicidade, inoculadas em quadruplicado em células Vero confluentes (CCL-81; ATCC ©, Manassas, VA, EUA) e incubado por 5 dias a 36 °C com 5% de CO2. As células foram mantidas em meio essencial mínimo de Eagle (EMEM) com 2% de penicilina-estreptomicina, 1% de L-glutamina e 2% de soro fetal bovino inativado. Os resultados foram obtidos por observações diárias de microscopia óptica, um ensaio de coloração de lise celular de ponto final e reação em cadeia da polimerase com transcriptase reversa (RT-PCR) de extratos de RNA sobrenadante. Resumidamente, o ensaio de coloração de lise celular de ponto final consistiu na adição de corante vermelho neutro (Merck KGaA, Darmstadt, Alemanha) a monocamadas celulares, incubação a 37 °C por 45 min, lavagem com PBS e adição de etanol citrato antes da densidade óptica (OD) foi medida a 540 nm (Labsystems Multiskan Ascent Reader, Thermo Fisher Scientific, Waltham, MA, EUA). OD foi diretamente proporcional às células viáveis, portanto, um baixo OD significaria importante lise celular devido à replicação do vírus. Além disso,® (bioMérieux, Lyon, FR) e SARS-CoV-2 RdRp IP2-targeted RdRp Institute Pasteur RT-PCR foi realizado em um sistema QuantStudio™ 5 (Applied Biosystems, Thermo Fisher Scientific, Foster City, CA, EUA). Os valores de redução de log10 (LRV) da replicação viral foram calculados pela diferença entre os poços de tratamento e controle por condição dividida por 3,3 (como 1 log10 ≈ 3,3 limiares do ciclo de PCR (Ct)).
2.5. Cinética de replicação por análise celular em tempo real
Para comparar a capacidade de replicação in vitro das cepas WT e ∆S SARS-CoV-2, a cinética de replicação foi determinada medindo a impedância do eletrodo de sensores de células microeletrônicas no xCELLigence Real-Time Cell Analyzer (RTCA) DP Instrument (ACEA Biosciences, Inc., San Diego, CA, EUA). Células Vero foram semeadas a 20.000 células por poço em um E-Plate 16 (ACEA Biosciences, Inc., San Diego, CA, EUA) e incubadas com as mesmas condições de meio descritas anteriormente a 36 °C com 5% de CO2. Após 24 h, os isolados da cultura SARS-CoV-2 foram inoculados em triplicado em uma multiplicidade de infecção de 10-2. Infecções simuladas foram realizadas em quadruplicata. Os dados de impedância eletrônica (índice celular) foram coletados continuamente em intervalos de 15 minutos por 6 dias. Área sob a análise da curva do índice celular normalizado, estabelecido no momento da inoculação, foi então calculado em intervalos de 12 horas. Em cada intervalo, a viabilidade celular foi determinada pela normalização contra o controle celular correspondente. Testes de comparação múltipla de Tukey foram usados para comparar cada condição no GraphPad Prism (software versão 9.0; San Diego, CA, EUA).
3. Resultados
3.1. Alteração das proteínas spike e envelope do SARS-CoV-2
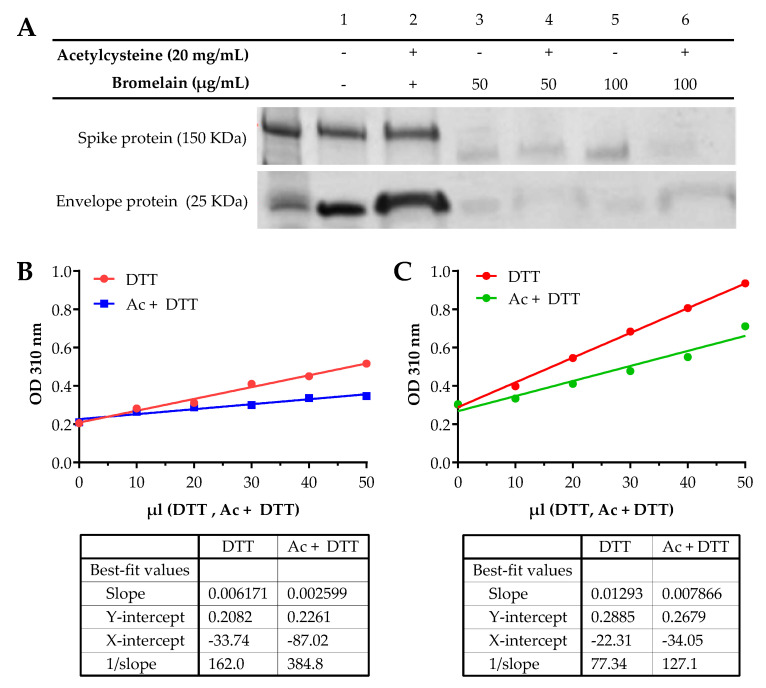
O tratamento da proteína spike apenas com acetilcisteína não mostrou nenhuma alteração da proteína, enquanto as concentrações de bromelaína em 50 e 100 µg/mL e BromAc em 50 e 100 µg/20 mg/mL resultaram em alteração da proteína (figura 1A). O tratamento com Acetilcisteína na proteína do envelope não alterou a proteína, enquanto o tratamento com Bromelina a 50 e 100 µg/mL e BromAc a 50 e 100 µg/20 mg/mL também resultou em fragmentação quase completa e completa, respectivamente (figura 1A).
Figura 1
(A) A bromelaína e a acetilcisteína apresentam um efeito sinérgico na spike de coronavírus da síndrome respiratória aguda grave (SARS-CoV-2) e na desestabilização da proteína do envelope. SDS-PAGE das subunidades S1 + S2 da proteína spike SARS-CoV-2 recombinante (150 kDa) e proteína do envelope (25 kDa). As proteínas foram tratadas com 20 mg/mL de Acetilcisteína sozinha, 100 e 50 µg/mL de Bromelina sozinha e uma combinação de 100 e 50 µg/20 mg/mL de BromAc. (B) Redução de dissulfeto da proteína spike SARS-CoV-2 recombinante por acetilcisteína. O ensaio diferencial entre Acetilcisteína (Ac) e Ditiotreitol (DTT) para a redução das pontes dissulfeto encontradas na proteína spike indica que a Acetilcisteína reduz 42% das pontes dissulfeto antes da adição de DTT. As ligações restantes são reduzidas por DTT para produzir o cromogênio detectado em 310 nm. (C) Redução de dissulfeto da proteína recombinante do envelope SARS-CoV-2 por acetilcisteína. O ensaio diferencial entre Acetilcisteína (Ac) e Ditiotreitol (DTT) para a redução das ligações dissulfeto encontradas na proteína do envelope indica que a Acetilcisteína reduz 40% das ligações antes da adição do DTT.
3.2. A detecção espectral de UV demonstra a alteração das pontes dissulfeto em proteínas spike e envelope
A redução comparativa de ligações dissulfeto na proteína spike entre DTT sozinho e DTT com acetilcisteína demonstrou uma diferença de 42% (figura 1B), com base na inclinação dos gráficos (0,002599/0,006171 (100) = 42%). A acetilcisteína foi assim capaz de reduzir 58% das ligações dissulfeto na amostra, após o que as pontes dissulfeto restantes foram reduzidas por DTT para produzir o cromogênio que foi monitorado nos espectros. Da mesma forma, o ensaio diferencial entre acetilcisteína e DTT para a redução das pontes dissulfeto encontradas na proteína do envelope (0,007866/0,01293 (100) = 60%) indica que a acetilcisteína reduz 40% das pontes dissulfeto antes da adição de DTT (figura 1C).
3.3. Potencial de inativação in vitro de SARS-CoV-2 de bromelaína, acetilcisteína e bromAc
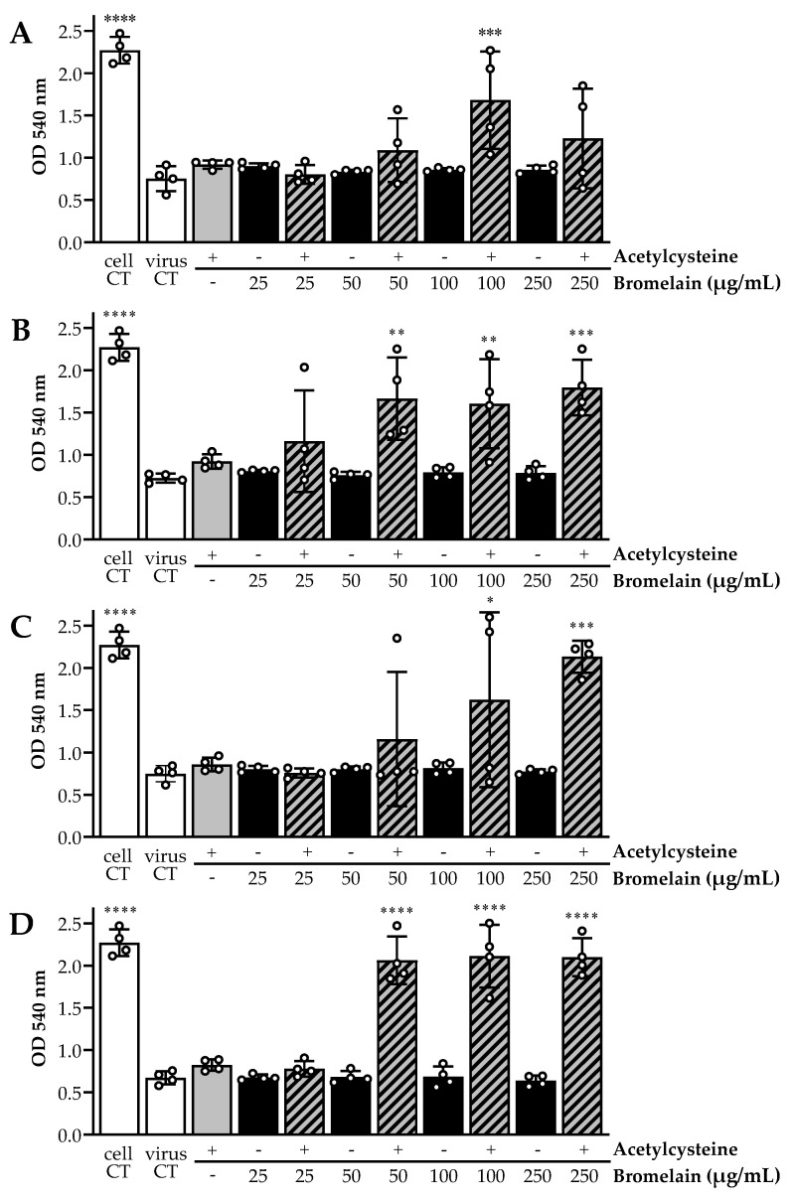
Para ambas as cepas de SARS-CoV-2 testadas, os controles de vírus não tratados em 105,5 e 104,5 TCID 50 /mL produziram efeitos citopáticos típicos (CPE) e nenhuma citotoxicidade foi observada para nenhuma das combinações de drogas nas células Vero. Os resultados do CPE óptico foram invariavelmente confirmados pela coloração de glóbulos vermelhos neutros de ponto final. No geral, o tratamento com bromelaína e acetilcisteína sozinho não mostrou inibição viral, todos com CPE comparável aos poços de controle do vírus, enquanto as combinações de BromAc exibiram inativação do vírus de maneira dependente da concentração (Figura 2). Tratamento em títulos de vírus de 104,5 TCID50/mL (Figura 2B,D) produziu inibição mais consistente de CPE para quadruplicados do que em títulos de vírus de 105,5 TCID50/mL (Figura 2A, C).
Figura 2
Ensaios de lise celular demonstraram potencial de inativação in vitro de Acetilcisteína e Bromelaína combinadas (BromAc) contra SARS-CoV-2. A viabilidade celular foi medida pela coloração celular com Vermelho Neutro, onde a densidade óptica (DO) é diretamente proporcional às células viáveis. OD baixo significaria lise celular importante devido à replicação do vírus. A cepa SARS-CoV-2 de tipo selvagem (WT) em títulos de 5,5 e 4,5 log10TCID50/mL (A e B, respectivamente) não mostraram inibição do efeito citopático (CPE) para o tratamento com agente único, em comparação com a condição de controle do vírus do tratamento simulado. As combinações de BromAc foram capazes de inibir o CPE, em comparação com os controles de célula de infecção simulada. O tratamento de uma variante da proteína spike SARS-CoV-2 (∆S) com uma mutação na junção S1/S2 em títulos de 5,5 e 4,5 log10TCID50/mL (C e D, respectivamente) mostrou resultados semelhantes. As barras representam a média de cada quadruplicado por condição, ilustradas por círculos brancos. ANOVA unidirecional comum foi realizada, usando o controle de vírus de tratamento simulado como condição de controle (**** p < 0,0001, *** p < 0,0005, ** p< 0,003, e * p < 0,05).
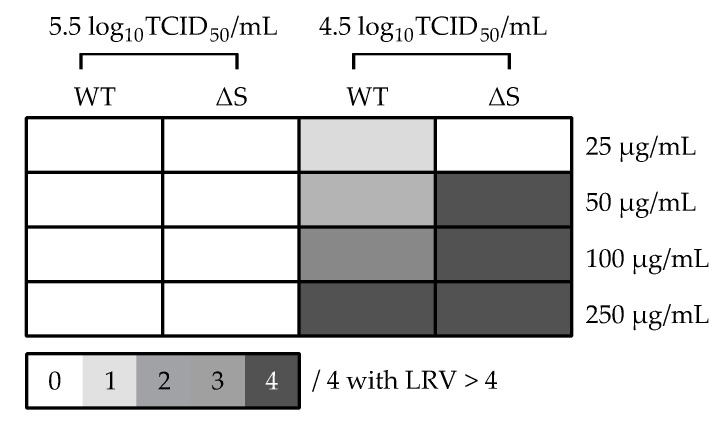
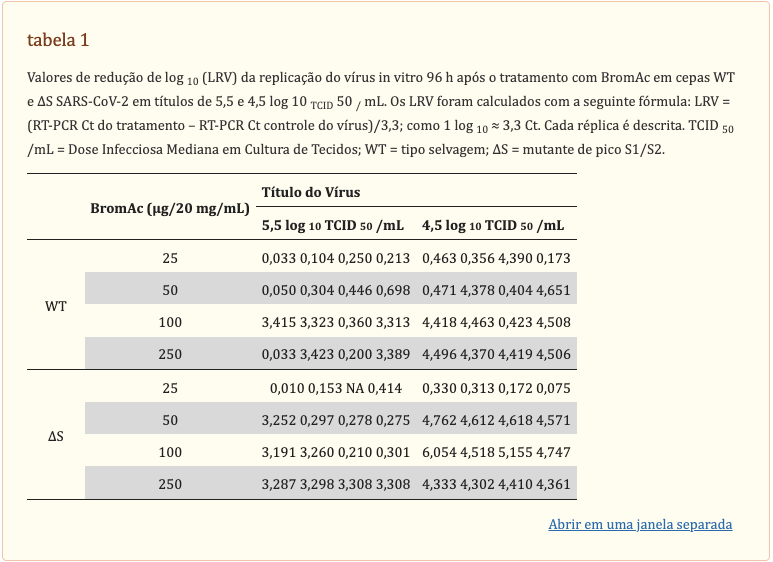
Com base nas diretrizes de inativação de vírus estabelecidas pela OMS, um processo robusto e confiável de inativação será capaz de reduzir a replicação em pelo menos 4 logs [Valor de redução Log10 (LRV) = (tratamento RT-PCR Ct – controle RT-PCR Ct)/3.3; como 1 log10 ≈ 3,3 Ct]. Como tal, RT-PCR foi realizado nos extratos de RNA para medir diretamente a replicação do vírus. Para a cepa de tipo selvagem (WT) a 104,5TCID50/mL, LRV bem sucedido > 4 foram observados com 1 de 4 poços, 2 de 4 poços, 3 de 4 poços e 4 de 4 poços para 25, 50, 100 e 250 µg/20 mg/mL BromAc, respectivamente (Figura 3). Vale a pena notar que em 105,5TCID50/mL, LRV estava ligeiramente abaixo do limite em, em média, 3,3, com 3 de 4 poços e 2 de 4 poços para 100 e 250 µg/20 mg/mL BromAc, respectivamente (tabela 1). Para o mutante de proteína spike (∆S) a 104,5TCID50/mL, nenhum LRV > 4 bem-sucedido foi observado para 25 µg/20 mg/mL de BromAc, mas foi observado em 4 de 4 poços para 50, 100 e 250 µg/20 mg/mL de BromAc (Figura 3). Digno de nota, em 105,5TCID50/mL, LRV estava ligeiramente abaixo do limite em, em média, 3,2, com 1 de 4 poços, 2 de 4 poços e 4 de 4 poços para 50, 100 e 250 µg/20 mg/mL BromAc, respectivamente (tabela 1). No geral, a inativação in vitro da capacidade de replicação de ambas as cepas de SARS-CoV-2 foi observada de maneira dose-dependente, mais fortemente demonstrada em 100 e 250 µg/20 mg/mL de BromAc contra 104,5TCID50/ mL de vírus.
Figura 3
Matriz limiar dos valores de redução de log10 (LRV) da replicação do vírus in vitro 96 h após o tratamento com BromAc em cepas WT e ∆S SARS-CoV-2 em títulos de 5,5 e 4,5 log10TCID50/mL. LRV foram calculados com a seguinte fórmula: LRV = (RT-PCR Ct de tratamento—RT-PCR Ct controle de vírus)/3,3; como 1 log10 ≈ 3,3 Ct. A matriz de gradiente de cores exibe o número de quadruplicados por condição produzindo um LRV > 4, correspondendo a uma inativação robusta de acordo com a OMS. WT = tipo selvagem; ∆S = mutante de spike S1/S2.
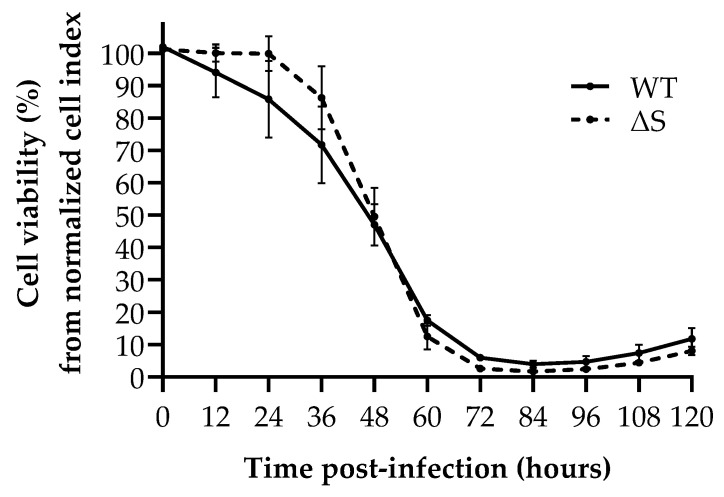
A análise celular em tempo real demonstrou uma cinética de replicação comparável para as cepas WT e ∆S SARS-CoV-2 (Figura 4). Nenhuma diferença significativa na viabilidade celular foi observada entre WT e ∆S em qualquer ponto de tempo. A partir de 48 h pós-infecção, a viabilidade das células WT e ∆S foram significativamente diferentes em comparação com a infecção simulada (p < 0,05).
Figura 4
Capacidade de replicação de SARS-CoV-2 de WT e ∆S SARS-CoV-2 medida por análise celular em tempo real. Os pontos de dados correspondem à área sob a análise da curva do índice celular normalizado (impedância eletrônica do RTCA estabelecida no momento da inoculação) em intervalos de 12 horas. A viabilidade celular foi então determinada por normalização contra o controle celular correspondente. WT = tipo selvagem; ∆S = mutante de spike S1/S2.
4. Discussão
A combinação de bromelaína e acetilcisteína, BromAc, inibiu sinergicamente a infectividade de duas cepas de SARS-CoV-2 cultivadas em células Vero. A confirmação da proteína e suas propriedades moleculares dependem de sua integridade estrutural e geométrica, que dependem tanto das ligações peptídicas quanto das pontes dissulfeto. A acetilcisteína, como um bom agente redutor, tende a reduzir as pontes dissulfeto e, portanto, alterar as propriedades moleculares da maioria das proteínas. Esta propriedade tem sido amplamente explorada no desenvolvimento de diversas terapias (doença pulmonar obstrutiva crônica, doenças alérgicas das vias aéreas, fibrose cística, pseudomixoma peritoneal, etc.). Mais recentemente, a acetilcisteína tem sido utilizada no desenvolvimento de terapias para infecções respiratórias como influenza e COVID-19, onde a integridade da proteína spike é vital para a infecção. Um mecanismo de ação hipotético poderia ser o desdobramento da glicoproteína spike e a redução de suas pontes dissulfeto.
A proteína spike SARS-CoV-2 é a pedra angular da ligação do vírion às células hospedeiras e, portanto, representa um alvo terapêutico ideal. Uma ação mecânica direta contra esta proteína spike é uma estratégia de tratamento diferente em comparação com a maioria das drogas antivirais existentes, que impede a entrada viral nas células hospedeiras, em vez de atingir a maquinaria de replicação. BromAc atua como um agente bioquímico para destruir glicoproteínas complexas. As competências enzimáticas multipotentes da bromelaína, dominadas pela capacidade de interromper as ligações glicosídicas, complementam de forma útil o forte poder da acetilcisteína de reduzir as pontes dissulfeto. A análise da sequência de aminoácidos da glicoproteína spike SARS-CoV-2 identificou vários locais predeterminados onde o BromAc poderia atuar preferencialmente, como o local S2′ rico em pontes dissulfeto, juntamente com outras três pontes dissulfeto em RBD. Paralelamente, o papel do escudo glicosídico em cobrir a spike, que é propenso a ser removido pelo BromAc, tem sido destacado como um elemento de estabilização das transições de conformação RBD, bem como um mecanismo de resistência à resposta imune específica.
Células de mamíferos exibem funções redutoras em sua superfície que são capazes de quebrar ligações dissulfeto, e a regulação desse equilíbrio tiol-dissulfeto provou afetar a internalização de diferentes tipos de vírus, incluindo SARS-CoV-2. As proteínas ACE2 e spike possuem pontes dissulfeto. Quando todas as pontes dissulfeto RBD da proteína spike foram reduzidas a tióis, a ligação do receptor ACE2 à proteína spike tornou-se menos favorável. Curiosamente, a redução das pontes dissulfeto ACE2 também induziu uma diminuição na ligação. Além disso, outros relatórios sugeriram que a bromelaína sozinha poderia inibir a infecção por SARS-CoV-2 em células VeroE6 por meio de uma ação nas ligações dissulfeto. Assim, a perda de infecciosidade do SARS-CoV-2 observada após o pré-tratamento com BromAc pode ser correlacionada ao desdobramento cumulativo das proteínas spike e envelope, com redução significativa de suas pontes dissulfeto pela acetilcisteína, demonstrado in vitro.
Curiosamente, um efeito semelhante do BromAc foi observado contra WT e ∆S SARS-CoV-2. A principal diferença nas sequências de aminoácidos entre o SARS-CoV-2 e o SARS-CoV anterior é a inclusão de um local de clivagem de furina entre os domínios S1 e S2. Este local distinto da proteína spike e seu papel no transbordamento do hospedeiro e na aptidão do vírus é um tópico de muito debate. Digno de nota, ∆S, que abriga uma mutação neste novo local de clivagem S1/S2 e altera o motivo de clivagem, não exibe nenhuma diferença aparente na capacidade de replicação em comparação com a cepa WT. A sensibilidade ligeiramente aumentada de ∆S ao tratamento com BromAc não se deve, portanto, a um viés de replicação basal, mas a mutação talvez possa estar envolvida no aumento do mecanismo de ação do BromAc. No entanto, esses resultados sugerem que, a partir de uma dose limite, o BromAc pode ser potencialmente eficaz em cepas mutantes de spike. Esta pode ser uma clara vantagem para BromAc sobre mecanismos imunológicos específicos de uma vacinação específica para spike.
Até o momento, diferentes estratégias de tratamento foram testadas, mas nenhuma molécula demonstrou um efeito antiviral claro. Além disso, dado o resultado heterogêneo da doença dos pacientes com COVID-19, a estratégia de tratamento deve combinar vários mecanismos de ação e ser adaptada ao estágio da doença. Assim, o reaproveitamento do tratamento continua sendo uma estratégia ideal contra o COVID-19, enquanto se espera uma cobertura vacinal suficiente em todo o mundo. Em particular, o desenvolvimento de tratamento precoce direcionado ao nariz, propenso a diminuir a infecciosidade de um paciente e prevenir a progressão para formas pulmonares graves, é apoiado por uma forte justificativa. Hou et al. demonstraram que o primeiro sítio de infecção é a mucosa nasofaríngea, com movimento secundário para os pulmões por aspiração. De fato, o padrão de infectividade das células do trato respiratório seguiu a expressão do receptor ACE2, diminuindo do trato respiratório superior para o tecido alveolar. A razão para ACE2 foi cinco vezes maior no nariz do que no trato respiratório distal. Outros tratamentos de reaproveitamento como anti-séptico nasal foram testados in vitro, como Povidone-Iodine, que demonstrou atividade contra SARS-CoV-2. No presente estudo, mostramos o potencial terapêutico in vitro de BromAc contra SARS-CoV-2 com uma dose eficiente limiar de 100 µg/20 mg/mL. Como os modelos animais de segurança das vias aéreas em duas espécies até o momento não exibiram toxicidade (dados não publicados), o objetivo é testar a administração nasal da droga em um ensaio clínico de fase I (ACTRN12620000788976). Esse tratamento pode ajudar a mitigar infecções leves e prevenir a infecção de pessoas em contato regular com o vírus, como profissionais de saúde.
Embora nossos resultados sejam encorajadores, há uma série de pontos a serem considerados em relação a essa demonstração. Ou seja, as condições in vitro são fixas e podem ser diferentes das in vivo. Qualquer reação enzimática é influenciada pelo pH do ambiente, ainda mais quando se trata de reações redox como a redução de pontes dissulfeto. O pH da mucosa nasal é, em termos fisiológicos, entre 5,5 e 6,5 e aumenta na rinite para 7,2-8,3. A idade avançada, frequentemente encontrada em infecções sintomáticas por SARS-CoV-2, também induz um aumento do pH da mucosa nasal. Tal intervalo de variação, dependendo das modificações tipicamente induzidas por uma infecção viral, pode desafiar a eficácia de nossa estratégia de tratamento. Outros experimentos in vitro para testar várias condições de pH estão em andamento, mas, em última análise, apenas estudos clínicos serão capazes de avaliar este ponto. Nossos experimentos foram conduzidos em uma linha celular de rim de macaco conhecida por ser altamente permissiva à infecciosidade do SARS-CoV-2. Com a hipótese acima de ruptura do equilíbrio tiol-dissulfeto de lise da proteína S, a eficácia do BromAc no SARS-CoV-2 não deve ser influenciada pelo padrão de protease de membrana. A reprodução deste protocolo experimental com a linha celular Calu-3 do epitélio pulmonar humano (ATCC ®HTB-55™) permitiria que esses pontos fossem abordados, pois a entrada do vírus é dependente de TMPRSS2 e independente do pH, como no epitélio das vias aéreas, enquanto a entrada do vírus nas células Vero é dependente da catepsina L e, portanto, dependente do pH.
No geral, os resultados obtidos no presente estudo em conjunto com estudos complementares sobre as propriedades do BromAc e a caracterização do SARS-CoV-2 revelam uma forte indicação de que o BromAc pode ser desenvolvido em um agente terapêutico eficaz contra o SARS-CoV-2.
5. Conclusões
Atualmente, não há tratamento terapêutico adequado para SARS-CoV-2 inicial com o objetivo de prevenir a progressão da doença. BromAc está em desenvolvimento clínico pelos autores para cânceres mucinosos devido à sua capacidade de alterar estruturas glicoproteicas complexas. O potencial de BromAc nas proteínas spike e envelope do SARS-CoV-2 estabilizadas por pontes dissulfeto foi examinado e descobriu-se que induz o desdobramento de proteínas recombinantes spike e envelope reduzindo as pontes estabilizadoras dissulfeto. O BromAc também mostrou um efeito inibitório no SARS-CoV-2 mutante de tipo selvagem e spike por inativação de sua capacidade de replicação in vitro. Portanto, BromAc pode ser um agente terapêutico eficaz para infecção precoce por SARS-CoV-2, apesar das mutações, e até mesmo ter potencial como profilático em pessoas com alto risco de infecção.
viruses-13-00425