Qi Qi , Qi Chen , Yumei Dong , Kun Wang , Jialu Wang , GuimingJin , Aiping Zheng ,RongZhang , Yongqiang Deng , Yuhuan Li , ChengfengQin e Xiaotao Duan
O novo coronavírus humano (HCoV) SARS-CoV-2 é o agente causador da atual pandemia COVID-19, representando uma enorme ameaça à saúde pública global. 1 Até agora, foram identificados sete HCoVs. Esses HCoVs (incluindo SARS-CoV, HCoV-229E, HCoV-NL63, HCoV-OC43, HCoV-HKU1, MERS-CoV e SARS-CoV-2) causam uma série de sintomas, desde um resfriado comum até patologias graves. 2 À medida que novos HCoV surgem continuamente na população humana, há uma necessidade urgente de desenvolver terapias antivirais de amplo espectro que possam ser eficazes contra os HCoV, incluindo o SARS-CoV-2 e as suas variantes emergentes.
O SARS-CoV-2 pertence a um vírus de RNA envelopado, de fita simples e de sentido positivo, e induz resposta de interferons (IFNs) nas células hospedeiras. 3 Esta resposta antiviral é mediada primariamente pelos receptores semelhantes ao gene I induzível pelo ácido retinóico (RIG-I) (RLRs) – sinalização da proteína sinalizadora antiviral mitocondrial (MAVS). Uma vez ativado, o MAVS agrega e recruta a quinase 1 de ligação ao TANK (TBK1), que fosforila o fator regulador do interferon 3 (IRF3). O IRF3 fosforilado transloca-se para o núcleo para ativar a expressão de IFN. 4 Os IFNs impulsionam a expressão de genes estimulados por IFN (ISGs) para controlar a infecção por SARS-CoV-2. Evidências clínicas sugerem que defeitos na resposta ao interferon tipo I (IFN-I) são de primordial importância na determinação da gravidade dos pacientes com SARS-CoV-2, 5sublinhando a importância da sinalização de IFN no controle da infecção por SARS-CoV-2.
Identificamos recentemente que a O -GlcNAcilação, uma modificação pós-tradução derivada da via biossintética da hexosamina (HBP), é essencial para a ativação do MAVS induzida por vírus e sinalização de IFN. Demonstramos que a D -glucosamina (GlcN), um suplemento dietético comumente usado, aumenta a MAVS O -GlcNAcilação e aumenta a sinalização de IFN mediada por MAVS e, portanto, exibe uma atividade antiviral de amplo espectro. 6Nesta comunicação, exploramos a potencial atividade antiviral de amplo espectro do GlcN contra HCoVs. Estabelecemos pela primeira vez o modelo de infecção por SARS-CoV-2 usando a linha celular epitelial do pulmão humano Calu-3 e a linha celular de câncer de fígado humano Huh7, respectivamente. Células Calu-3 ou Huh7 foram tratadas com GlcN (na concentração final de 20 mM) por 3 h, infectadas com SARS-CoV-2 em uma multiplicidade de infecção (MOI) de 1. Após infecção por 24 h, observamos que As células infectadas com SARS-CoV-2 mostraram uma intensidade significativamente aumentada de O -GlcNAcilação celular em comparação com o grupo não infectado (Fig. 1a , Figura 1 suplementar ), indicando que SARS-CoV-2 promove o metabolismo de HBP e proteína O-GlcNAcilação em células hospedeiras. Isto é semelhante à nossa observação anterior na infecção por vírus RNA, incluindo IAV e VSV. 6 Como esperado, descobrimos que a GlcN aumentou significativamente o nível celular de O -GlcNAcilação e suprimiu substancialmente a replicação do SARS-CoV-2 em células epiteliais pulmonares infectadas, conforme medido pela expressão da proteína spike do SARS-CoV-2 (Fig. 1a ). Os títulos de vírus no sobrenadante foram significativamente reduzidos (P <0,01) no grupo de tratamento com GlcN (Fig. 1b ). As medições do curso do tempo (6 a 24 horas após a infecção) confirmaram ainda mais a nossa observação, o tratamento com GlcN inibiu significativamente a replicação do SARS-CoV-2, consistente com a redução do título (Fig. 1c, d ).
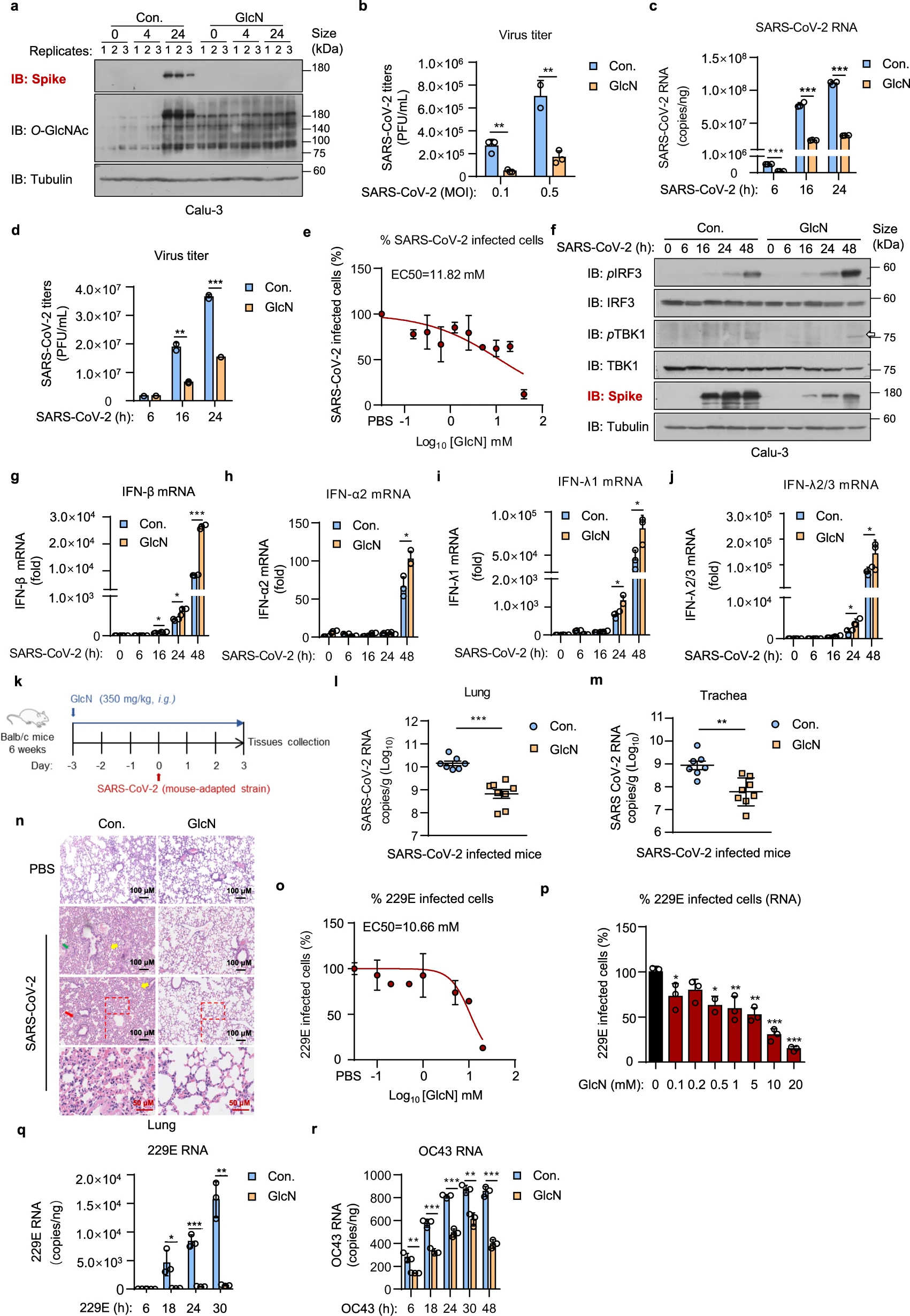
Em seguida, determinamos o valor mediano da concentração efetiva (EC50) de GlcN contra a infecção por SARS-CoV-2. Células Calu-3 foram tratadas com várias doses de GlcN variando de 0,1 a 40 mM por 3 h, infectadas com SARS-CoV-2 em um MOI de 1. Infecção por 24 h, as células foram fixadas, coradas para SARS-CoV- 2 proteínas do nucleocapsídeo (N). Após a coloração, as células foram visualizadas (Figura 1b Complementar ). A fração de células infectadas foi quantificada. GlcN inibiu a infecção por SARS-CoV-2 em células Calu-3 com um valor EC50 de 11,82 mM (Fig. 1e ). A citotoxicidade da GlcN foi examinada em paralelo com a atividade antiviral. Não observamos nenhuma citotoxicidade mensurável em todas as concentrações (Figura 1c Complementar). Estes resultados sugerem que a GlcN inibe eficazmente a replicação e infecção do SARS-CoV-2 in vitro.
Num esforço para compreender melhor o mecanismo antiviral da GlcN contra o SARS-CoV-2, examinamos a resposta do interferon induzida pelo SARS-CoV-2 na presença de GlcN. Observamos que o tratamento com GlcN resultou em um aumento considerável tanto do IRF3 fosforilado quanto do TBK1 fosforilado e, assim, promoveu a sinalização de IFN em resposta ao SARS-CoV-2. Isto, por sua vez, diminuiu a expressão da proteína spike SARS-CoV-2 no grupo de tratamento com GlcN (Fig. 1f ). Vale a pena notar que, além do IFN tipo I ( isto é , IFN-β, IFN-α2), também observamos uma elevação significativa do IFN tipo III (IFN-λ1, IFN-λ2/3) no grupo de tratamento com GlcN após Infecção por SARS-CoV-2 (Fig. 1g – j ). Isto está de acordo com a nossa descoberta anterior de que a GlcN promove a produção de IFN mediada por MAVS. 6Enquanto o MAVS mitocondrial medeia preferencialmente a expressão de IFNs do tipo I, o MAVS peroxissomal ativa seletivamente o IFN-λ. 7 Isto fornece uma justificativa melhor para o tratamento com GlcN, uma vez que o SARS-CoV-2 é sensível aos IFNs do tipo I e do tipo III. 8 Consequentemente, descobrimos que IFITM1, IFIT2/ISG54 e CXCL10 estavam significativamente elevados no grupo de tratamento com GlcN em comparação ao controle (Figura 2a-c suplementar ), confirmando ainda mais o mecanismo proposto. Estas descobertas juntas fornecem evidências suficientes de que a GlcN promove a via antiviral do IFN do hospedeiro contra o SARS-CoV-2.
Para avaliar o efeito antiviral da GlcN contra o SARS-CoV-2 in vivo, primeiro avaliamos a segurança da GlcN. Os ratos foram administrados intragástricamente com GlcN (350 mg/kg) durante 10 dias consecutivos. Os pesos corporais foram medidos diariamente e não detectamos qualquer perda de peso corporal de camundongos no grupo de tratamento com GlcN (Figura 3a Complementar ). Também coletamos os pulmões, baços e fígados de camundongos, e o GlcN administrado por via oral não induziu resposta sistêmica de IFN in vivo (Figura 3b-d suplementar ). A coloração H&E mostrou que a GlcN não causou quaisquer alterações patológicas no trato intestinal (Figura 3e suplementar ). Com base nesses dados de segurança, estabelecemos um modelo infectado por SARS-CoV-2 adaptado a camundongos. 9Camundongos BALB/c com 6 semanas de idade foram administrados intragástricamente com GlcN (350 mg/kg) por 3 dias consecutivos e foram então inoculados por via intranasal com cepa SARS-CoV-2 MASCp6. No dia 3 pós-infecção, os ratos foram sacrificados para avaliar as cargas virais e a inflamação na traqueia e no pulmão (Fig. 1k ). O tratamento com GlcN resultou em uma redução superior a 20 vezes no RNA do SARS-CoV-2 nos pulmões e em uma redução de 10 vezes nas traqueias (Fig. 1l, m). O exame histológico pulmonar por coloração H&E mostrou que camundongos infectados por SARS-CoV-2 desenvolveram pneumonia intersticial caracterizada por infiltração de células inflamatórias, espessamento do septo alveolar e inflamação peribronquiolar. Em comparação com o grupo controle, observamos que o tratamento com GlcN reduziu profundamente o infiltrado inflamatório e o dano epitelial causado pela infecção por SARS-CoV-2 (Fig. 1n ). Estes resultados mostraram que a GlcN administrada por via oral restringe a replicação do SARS-CoV-2 e alivia a lesão pulmonar induzida pelo vírus in vivo.
Para avaliar a atividade de amplo espectro da GlcN contra HCoVs, estabelecemos modelos de infecção celular usando HCoV-229E (229E) e HCoV-OC43 (OC43), respectivamente. Primeiro determinamos os valores de EC50 de GlcN contra a infecção por 229E. GlcN inibiu a infecção por 229E em células Calu-3 com um valor EC50 de 10,66 mM (Fig. 1o ). Também avaliamos a abundância de RNA viral intracelular via qRT-PCR. Uma redução do RNA 229E foi observada após tratamento com GlcN (Fig. 1p ). Em seguida, exploramos a atividade antiviral do GlcN contra HCoVs ao longo do tempo da infecção por 229E/OC43. Descobrimos que o tratamento com GlcN resultou em uma redução pronunciada (~ 95%) do nível de RNA 229E às 18, 24 e 30 horas após a infecção (Fig. 1q). Da mesma forma, o tratamento com GlcN inibiu grandemente a replicação do ARN OC43 em células Calu-3. (Fig. 1r , Fig. Complementar 4a ). A ribavirina foi utilizada como controle positivo em ambas as avaliações. GlcN mostrou eficácia comparável versus ribavirina em termos de replicação de HCoVs (Figura 4b, c suplementar ), sugerindo uma atividade antiviral de amplo espectro contra diversos HCoVs.
Tomados em conjunto, este estudo demonstrou que GlcN aumenta a sinalização de IFNs induzida por SARS-CoV-2 e restringe a replicação de SARS-CoV-2 em múltiplas linhas celulares humanas. No modelo de camundongo infectado por SARS-CoV-2, a administração profilática de GlcN em uma dose clinicamente relevante reduz significativamente a carga viral no pulmão e na traqueia e alivia consideravelmente a inflamação pulmonar. Um estudo clínico recente ( ClinicalTrials.gov : NCT04706416) relatou que N -acetil glucosamina (NAG) administrada por via oral, um metabólito a jusante de GlcN, diminui a taxa de mortalidade e melhora os resultados clínicos de pacientes infectados por SARS-CoV-2. 10Apesar de um ensaio multicêntrico em larga escala ainda estar em andamento, os dados piloto estão geralmente alinhados com nossos resultados experimentais. Também é importante notar que a GlcN exibiu atividade antiviral de amplo espectro contra HCoVs, incluindo 229E e OC43. O efeito antiviral do GlcN é mais forte contra a infecção por 229E do que o OC43. Aparentemente, 229E e OC43 induzem a resposta do interferon do hospedeiro em uma extensão diferente. A infecção por 229E induziu níveis significativamente mais elevados de IFNs tipo I e tipo III em comparação com OC43. 11 Portanto, raciocinamos que o efeito antiviral relativamente leve da GlcN contra o OC43 se deve à menor extensão da resposta imune inata mediada por interferon que o OC43 induziu nas células hospedeiras.
No geral, nosso trabalho demonstrou que GlcN mostra eficácia potencial contra múltiplos HCoVs, incluindo SARS-CoV-2, 229E e OC43 em modelos de infecção baseados em células e em camundongos. A GlcN tem sido aplicada clinicamente no tratamento da osteoartrite há mais de 50 anos. Como suplemento nutricional, a GlcN administrada por via oral em doses diárias variando de 750 a 3.500 mg é bem tolerada em seres humanos. Dado o perfil de segurança e a sua atividade anti-HCoV de amplo espectro, o GlcN pode servir como um medicamento promissor para prevenir a propagação do SARS-CoV-2 e das suas variantes emergentes em populações saudáveis.
Referências
- Zhang, YZ & Holmes, EC Uma perspectiva genômica sobre a origem e emergência do SARS-CoV-2. Célula 181 , 223–227 (2020).
Artigo CAS PubMed PubMed Central Google Scholar
- Chen, B. et al. Visão geral dos coronavírus humanos letais. Transdução de Sinal. Alvo lá. 5 , 1–16 (2020).
- Lei, X. et al. Ativação e evasão de respostas de interferon tipo I pelo SARS-CoV-2. Nat. Comum. 11 , 3810 (2020).
Artigo CAS PubMed PubMed Central Google Scholar
- Yin, X. et al. MDA5 governa a resposta imune inata ao SARS-CoV-2 nas células epiteliais pulmonares. Célula Rep. 34 , 108628 (2021).
Artigo CAS PubMed PubMed Central Google Scholar
- Hadjadj, J. et al. Atividade de interferon tipo I prejudicada e respostas inflamatórias em pacientes graves com COVID-19. Ciência 369 , 718–724 (2020).
Artigo CAS PubMed PubMed Central Google Scholar
- Canção, N. et al. A MAVS O -GlcNAcilação é essencial para a imunidade antiviral do hospedeiro contra vírus de RNA letais. Célula Rep. 28 , 2386–2396 (2019).
Artigo CAS PubMed Google Scholar
- Ding, S. & Robek, MD Peroxisomal MAVS ativa a produção de IFN-λ mediada por IRF1. Nat. Imunol. 15 , 700–701 (2014).
Artigo CAS PubMed Google Scholar
- Felgenhauer, U. et al. Inibição de SARS-CoV-2 por interferons tipo I e tipo III. J. Biol. Química. 295 , 13958 (2020).
Artigo CAS PubMed PubMed Central Google Scholar
- Gu, H. et al. Adaptação do SARS-CoV-2 em camundongos BALB/c para testar a eficácia da vacina. Ciência 369 , 1603–1607 (2020).
Artigo CAS PubMed PubMed Central Google Scholar
- Hassan, AE Um estudo de coorte observacional para avaliar N -acetilglucosamina para tratamento de COVID-19 em ambiente hospitalar. Ana. Med. Surg. 68 , 102574 (2021).
- Loo, S.-L. e outros. Os coronavírus humanos 229E e OC43 replicam e induzem respostas antivirais distintas em células epiteliais brônquicas humanas primárias diferenciadas. Sou. J. Fisiol. Mol de células pulmonares. Fisiol. 319 , L926–L931 (2020).
Artigo CAS PubMed PubMed Central Google Scholar