Nabin K. Shrestha , Patrick C. Burke , Amy S. Nowacki , James F. Simon , Amanda Hagen , Steven M. Gordon
ABSTRATO
Antecedentes O objetivo deste estudo foi avaliar se uma vacina bivalente contra COVID-19 protege contra COVID-19.
Métodos Foram incluídos funcionários da Cleveland Clinic empregados no dia em que a vacina bivalente contra a COVID-19 foi disponibilizada pela primeira vez aos funcionários. A incidência cumulativa de COVID-19 foi examinada nas semanas seguintes. A proteção proporcionada pela vacinação (analisada como uma covariável dependente do tempo) foi avaliada utilizando a regressão de riscos proporcionais de Cox. A análise foi ajustada para a fase pandêmica quando ocorreu o último episódio anterior de COVID-19 e o número de doses de vacina anteriores recebidas.
Resultados Entre 51.011 funcionários, 20.689 (41%) tiveram um episódio anterior documentado de COVID-19 e 42.064 (83%) receberam pelo menos duas doses de uma vacina contra COVID-19. COVID-19 ocorreu em 2.452 (5%) durante o estudo. O risco de COVID-19 aumentou com o tempo desde o episódio anterior mais recente de COVID-19 e com o número de doses de vacina recebidas anteriormente. Na análise multivariada, o estado de vacinação bivalente foi independentemente associado a um menor risco de COVID-19 (HR, 0,70; IC 95%, 0,61-0,80), levando a uma eficácia estimada da vacina (VE) de 30% (95% IC, 20-39%). Em comparação com a última exposição ao SARS-CoV-2 nos últimos 90 dias, a última exposição 6 a 9 meses antes foi associada ao dobro do risco de COVID-19, e a última exposição 9 a 12 meses antes a 3,5 vezes o risco.
Conclusões A vacina bivalente contra a COVID-19 administrada a adultos em idade ativa proporcionou uma proteção global modesta contra a COVID-19, enquanto as estirpes do vírus dominantes na comunidade foram as representadas na vacina.
Resumo Entre 51.011 funcionários da Cleveland Clinic em idade ativa, o reforço da vacina bivalente contra a COVID-19 foi 30% eficaz na prevenção da infecção, durante o período em que as cepas do vírus dominantes na comunidade estavam representadas na vacina.
INTRODUÇÃO
Quando as vacinas originais contra a doença do coronavírus 2019 (COVID-19) foram disponibilizadas pela primeira vez em 2020, havia ampla evidência de eficácia em ensaios clínicos randomizados [ 1 , 2 ]. A eficácia da vacina foi posteriormente confirmada por dados de eficácia clínica no mundo real, fora da clínica. ensaios [ 3 , 4 ], incluindo uma estimativa de eficácia de 97% entre funcionários de nosso próprio sistema de saúde [ 5 ]. Foi quando a população humana acabou de encontrar o novo vírus da Síndrome Respiratória Aguda Grave Coronavírus 2 (SARS-CoV-2), e o patógeno impôs uma elevada carga de morbidade e mortalidade em todo o mundo. As vacinas foram surpreendentemente eficazes na prevenção da COVID-19, salvaram um grande número de vidas e alteraram o impacto da pandemia.
Embora as vacinas tenham sido muito eficazes, a maioria da população dos países com poucos recursos não conseguiu ser vacinada a tempo e ocorreram ondas de infecção em todo o mundo. A aquisição contínua de mutações no vírus, desde a evolução natural em resposta à interação com a resposta imunitária entre a população humana, levou ao surgimento e propagação de variantes do SARS-CoV-2. Apesar disso, aqueles previamente infectados ou vacinados continuaram a ter proteção substancial contra reinfecção por imunidade virtual ou induzida por vacina [ 6 ]. A chegada da variante Omicron em dezembro de 2021 trouxe uma mudança significativa no cenário da proteção imunológica. Indivíduos previamente infectados ou vacinados não estavam mais protegidos do COVID-19 [ 6 ]. O reforço da vacina forneceu alguma proteção contra a variante Omicron [ 7 , 8 ], mas o grau de proteção não foi próximo ao da vacina original contra as variantes pré-Omicron do SARS-CoV-2 [ 8 ]. Após o surgimento da variante Omicron, a infecção anterior com uma linhagem anterior da variante Omicron protegeu contra a infecção subsequente com uma linhagem subsequente [ 9 ], mas essa proteção pareceu desaparecer dentro de alguns meses [ 10 ]. Durante a fase Omicron da pandemia, a proteção contra a imunidade induzida pela vacina diminuiu alguns meses após o reforço da vacina [ 8 ].
O reconhecimento de que as vacinas originais contra a COVID-19 proporcionavam muito menos proteção após o surgimento da variante Omicron estimulou esforços para produzir vacinas mais recentes e mais eficazes. Estes esforços culminaram na aprovação pela Food and Drug Administration dos EUA, em 31 de agosto de 2022, de vacinas bivalentes de mRNA contra a COVID-19, que continham antígenos representados na vacina original, bem como antígenos representando as linhagens BA.4/BA.5 de a variante Omicron. Dada a segurança demonstrada das vacinas de mRNA anteriores e a percepção urgente da necessidade de uma ferramenta preventiva mais eficaz, estas vacinas foram aprovadas sem demonstração de eficácia em estudos clínicos.
O objetivo deste estudo foi avaliar se a vacina bivalente contra COVID-19 protege contra COVID-19.
MÉTODOS
Design de estudo
Este foi um estudo de coorte retrospectivo realizado no Cleveland Clinic Health System (CCHS), nos Estados Unidos. O estudo foi aprovado pelo Conselho de Revisão Institucional da Clínica Cleveland como pesquisa isenta (IRB nº 22-917). Uma renúncia ao consentimento informado e à renúncia à autorização HIPAA foram aprovadas para permitir que a equipe de pesquisa tenha acesso aos dados necessários.
Contexto
Desde a chegada da pandemia de COVID-19 à Cleveland Clinic em março de 2020, o acesso dos funcionários aos testes tem sido uma prioridade. Os sistemas foram projetados para permitir que a Saúde Ocupacional entrevistasse e monitorasse remotamente os sintomas de todos os funcionários enquanto estes estavam isolados em casa. A vacinação voluntária para COVID-19 teve início em 16 de dezembro de 2020, e a vacina monovalente em forma de reforço passou a ser disponibilizada aos colaboradores em 5 de outubro de 2021. A vacina bivalente contra COVID-19 começou a ser oferecida aos colaboradores em 12 de setembro de 2022. Esta data foi considerada a data de início do estudo.
As variantes circulantes do SARS-CoV-2 variaram ao longo do estudo. A maioria das infecções em Ohio foi causada pelas linhagens BA.4 ou BA.5 da variante Omicron durante as primeiras 10 semanas do estudo, com base nos dados de monitoramento da variante SARS-CoV-2 disponíveis no Departamento de Saúde de Ohio. Em dezembro, as linhagens BQ.1, BQ.1.1 e BF.7 representavam uma proporção substancial das infecções.
Participantes
Os funcionários da CCHS empregados em qualquer local da Cleveland Clinic em Ohio em 12 de setembro de 2022, o dia em que a vacina bivalente foi disponibilizada pela primeira vez aos funcionários, foram incluídos no estudo. Foram excluídos aqueles para os quais idade e sexo não estavam disponíveis.
Variáveis
As covariáveis coletadas foram idade , sexo, local de trabalho e categorização do tipo de trabalho em clínico ou não clínico, conforme descrito em nossos estudos anteriores [ 5–7 ]. As regras institucionais de governança de dados relacionadas aos dados dos funcionários limitaram nossa capacidade de complementar nosso conjunto de dados com variáveis clínicas adicionais. Os sujeitos foram considerados contratações pré-pandemia se contratados antes de 16 de março de 2020, dia em que o teste COVID-19 foi disponibilizado em nossa instituição, e contratações pandêmicas se contratados a partir dessa data.
A COVID-19 anterior foi definida como um NAAT positivo para SARS-CoV-2 a qualquer momento antes da data de início do estudo. A data de infecção de um episódio anterior de COVID-19 foi a data do primeiro teste positivo para esse episódio de doença. Os testes positivos subsequentes dentro de 90 dias foram considerados parte do mesmo episódio de doença. Um teste positivo mais de 90 dias após a data de uma infecção anterior foi considerado um novo episódio de infecção. Como o sistema de saúde nunca exigiu a triagem sistemática de testes de funcionários assintomáticos, a maioria dos testes positivos durante o período do estudo teriam sido testes feitos para avaliar sintomas suspeitos. Alguns teriam sido para avaliar exposições conhecidas. Uma pequena proporção poderia ter sido testes realizados como parte da triagem pré-operatória ou pré-procedimento.
A fase pandêmica durante a qual um sujeito teve seu último episódio anterior de COVID-19 também foi coletada como variável. Para determinar isso, a pandemia foi dividida nas fases pré-Delta, Delta, Omicron BA.1/BA.2 e Omicron BA.4/BA.5, com base nas quais variantes/linhagens representaram mais de 50% das infecções em Ohio na época. Os dados para esta determinação foram obtidos a partir de dados de proporção de variantes fornecidos pelos Centros de Controle e Prevenção de Doenças (CDC) [ 11 ].
Resultado
O resultado do estudo foi o tempo para COVID-19, este último definido como um NAAT positivo para SARS-CoV-2 a qualquer momento após a data de início do estudo. Os resultados foram acompanhados até 12 de dezembro de 2022.
Análise estatística
Um gráfico de risco Simon-Makuch [ 12 ] foi criado para comparar a incidência cumulativa de COVID-19 nos estados vacinados e não vacinados bivalentes, tratando a vacinação bivalente como uma covariável dependente do tempo. Os indivíduos foram considerados vacinados bivalentes 7 dias após o recebimento de uma dose única da vacina bivalente contra COVID-19. Os indivíduos que não desenvolveram COVID-19 foram censurados no final do período de acompanhamento do estudo. Aqueles cujo emprego foi encerrado durante o período de estudo antes de terem COVID-19 foram censurados na data da rescisão do emprego. As curvas para o estado não vacinado basearam-se em dados, enquanto o estado de vacinação bivalente dos indivíduos permaneceu “não vacinado”. As curvas para o estado de vacinação bivalente foram baseadas em dados da data em que o estado de vacinação bivalente mudou para “vacinado”.
Modelos multivariados de regressão de riscos proporcionais de Cox foram ajustados para examinar a associação de várias variáveis com o tempo até a COVID-19. A vacinação bivalente foi incluída como uma covariável dependente do tempo [ 13 ]. O modelo primário incluiu todos os sujeitos do estudo. O modelo secundário incluiu apenas aqueles com exposição prévia ao SARS-CoV-2 por infecção ou vacinação. A eficácia da vacina foi calculada a partir das taxas de risco para vacinação bivalente nos modelos.
A análise foi realizada por NKS e ASN usando o pacote de sobrevivência e R versão 4.2.2 (R Foundation for Statistical Computing) [ 13–15 ].
RESULTADOS
Dos 51.977 indivíduos elegíveis, 966 (1,9%) foram excluídos por falta de idade ou sexo. Dos restantes 51.011 funcionários incluídos no estudo, 34.507 (68%) estavam empregados desde antes do início da pandemia de COVID-19 (contratações pré-pandemia). 1.794 sujeitos (3,5%) foram censurados durante o período do estudo devido à rescisão do emprego antes do final do estudo. Ao final do estudo, 10.804 (21%) receberam reforço da vacina bivalente. A vacina bivalente foi a vacina Pfizer em 9.595 (89%) e a vacina Moderna nos restantes 1.178. Ao todo, 2.452 funcionários (5%) adquiriram COVID-19 durante as 13 semanas do estudo.
Características base
A Tabela 1 mostra as características dos sujeitos incluídos no estudo. Notavelmente, esta era uma população relativamente jovem, com uma idade média de 42 anos. Entre estes, 20.689 (41%) já tinham tido um episódio documentado de COVID-19 e 12.029 (24%) já tinham tido uma infecção pela variante Omicron. 44.592 indivíduos (87%) já haviam recebido pelo menos uma dose de vacina, 42.064 (83%) receberam duas doses, 27.254 (53%) receberam pelo menos três doses e 3.858 (8%) receberam quatro ou mais doses . 46.340 (91%) tinham sido previamente expostos ao SARS-CoV-2 por infecção ou vacinação.
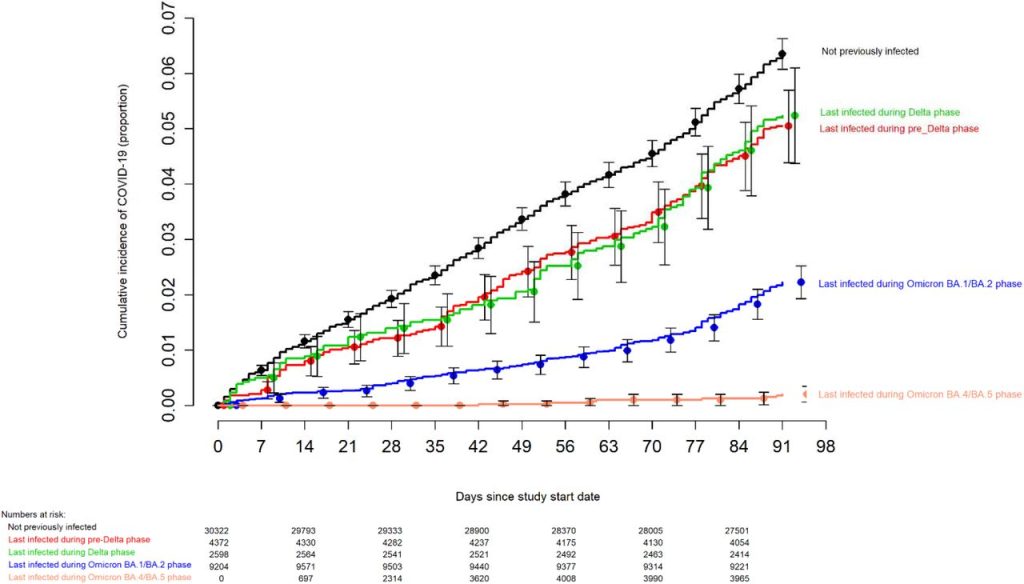
Risco de COVID-19 com base em infecção anterior e histórico de vacinação
O risco de COVID-19 variou de acordo com a fase da epidemia em que ocorreu o último episódio anterior de COVID-19 do sujeito. Em ordem decrescente de risco de COVID-19 estavam aqueles que nunca foram infectados anteriormente, os últimos infectados durante a fase pré-Delta ou Delta, os últimos infectados durante a fase Omicron BA.1/BA.2 e os últimos infectados durante a fase Omicron BA. Fase .4/BA.5 ( Figura 1 ).
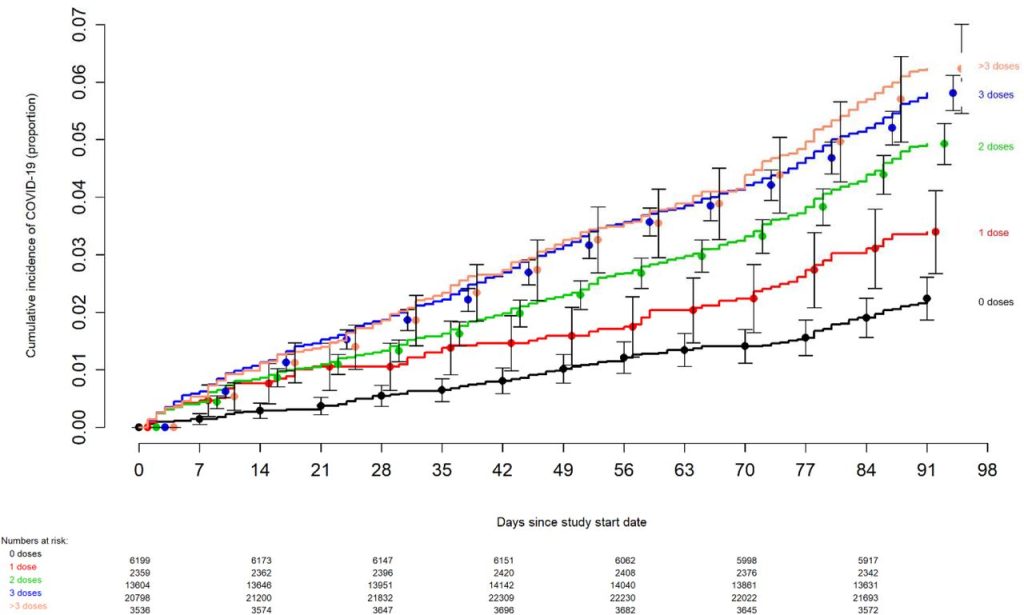
O risco de COVID-19 também variou de acordo com o número de doses de vacina contra COVID-19 recebidas anteriormente. Quanto maior o número de vacinas recebidas anteriormente, maior o risco de contrair COVID-19 ( Figura 2 ).
Eficácia da vacina bivalente
Num modelo multivariável de regressão de riscos proporcionais de Cox ajustado para idade, sexo, coorte de contratação, categoria profissional, número de doses da vacina contra a COVID-19 antes do início do estudo e fase epidémica quando ocorreu o último episódio anterior de COVID-19, uma vacina bivalente forneceu alguns proteção contra COVID-19 (HR, 0,70; IC 95%, 0,61-0,80; valor P, < 0,001). Estimativas pontuais e intervalos de confiança de 95% para taxas de risco para as variáveis incluídas nos modelos de regressão de riscos proporcionais de Cox não ajustados e ajustados são mostrados na Tabela 2 . A eficácia global da vacina calculada a partir do modelo foi de 30% (IC 95%, 20% – 39%).
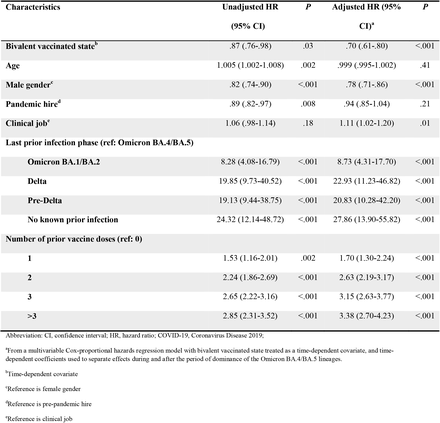
As análises multivariáveis também revelaram que, quanto mais recente for o último episódio anterior de COVID-19, menor será o risco de COVID-19 e que quanto maior for o número de doses de vacina recebidas anteriormente, maior será o risco de COVID-19.
Eficácia da vacina bivalente entre aqueles com infecção ou vacinação prévia por SARS-CoV-2
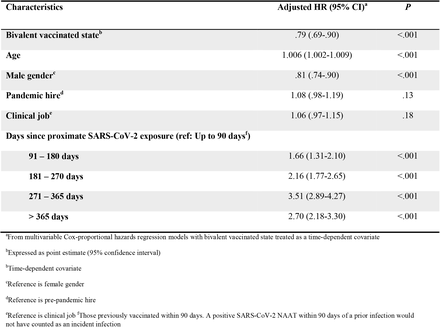
Dado que tanto a imunidade natural como a imunidade induzida pela vacina protegem contra a COVID-19, e ambas as formas de imunidade diminuem com o tempo, uma forma de avaliar a eficácia de uma vacina é ajustar o tempo desde a exposição próxima ao SARS-CoV-2 por infecção ou vacinação. Entre as pessoas com exposição prévia ao SARS-CoV-2 por infecção ou vacinação, as taxas de risco para vacinação bivalente para indivíduos, após ajuste para o tempo desde a exposição próxima ao SARS-CoV-2, são mostradas na tabela 3 . Esta análise mostra que, além de um efeito protetor de 21% da vacinação bivalente, aqueles com última exposição ao SARS-CoV-2 6-9 meses antes têm o dobro do risco, e aqueles expostos 9-12 meses antes têm 3,5 vezes o risco , de COVID-19, em comparação com aqueles com última exposição nos 90 dias anteriores.
DISCUSSÃO
Este estudo descobriu que as atuais vacinas bivalentes foram cerca de 30% eficazes no geral na proteção contra a infecção por SARS-CoV-2, quando as linhagens Omicron BA.4/BA.5 eram as cepas circulantes predominantes. A magnitude da proteção proporcionada pela vacinação bivalente foi semelhante à estimada em um estudo recente usando dados do programa nacional de testes SARS-CoV-2 de Aumento do Acesso Comunitário aos Testes (ICATT) [16 ] .
Os pontos fortes do nosso estudo incluem o grande tamanho da amostra e a sua conduta num sistema de saúde onde um reconhecimento muito precoce da importância crítica de manter uma força de trabalho eficaz durante a pandemia levou à dedicação de recursos para ter uma contabilização precisa de quem teve COVID- 19, quando a COVID-19 foi diagnosticada, quem recebeu a vacina contra a COVID-19 e quando. A metodologia do estudo, tratando a vacinação bivalente como uma covariável dependente do tempo, permitiu determinar a eficácia da vacina em tempo real.
O estudo tem várias limitações. Indivíduos com infecção anterior não reconhecida teriam sido classificados erroneamente como não infectados anteriormente. Dado que a infecção anterior protege contra infecções subsequentes, tal classificação errada teria resultado na subestimação do efeito protetor da vacina. No entanto, há poucos motivos para supor que teriam faltado infecções anteriores nos estados vacinados e não vacinados bivalentes, a taxas desproporcionais. Aqueles que optaram por receber a vacina bivalente poderiam ter ficado mais preocupados com a infecção e poderiam ter sido mais propensos a fazer o teste quando apresentavam sintomas, detectando assim desproporcionalmente mais infecções incidentes entre aqueles que receberam a vacina bivalente. Este risco é mitigado pelo tratamento dependente do tempo da vacinação bivalente, porque com esse tratamento, o risco de detecção desproporcional está, na verdade, na direção oposta. Se os indivíduos recebessem a vacina bivalente pensando que isso reduziria o risco de infecção, eles estariam menos inclinados a fazer o teste para os mesmos sintomas depois de receber a vacina (estado de vacinação bivalente) do que antes de receber a vacina (estado de vacinação não bivalente), proporcionando maior oportunidade de detectar infecção no estado não potenciado do que no potenciado, tendo assim o efeito de sobrestimar a eficácia da vacina. Aqueles que optaram por receber a vacina bivalente também tiveram maior probabilidade de ter um comportamento de menor risco em relação à COVID-19, tendo o efeito de um maior risco de COVID-19 no estado sem reforço (como aqueles que optaram por não tomar a vacina bivalente). receber a vacina bivalente, previsivelmente com comportamento de risco mais elevado, permaneceu no estado sem reforço durante todo o estudo), desta forma, novamente, potencialmente superestimando a eficácia da vacina. A ampla disponibilidade de kits de testes domésticos pode ter reduzido a detecção de infecções incidentes. Este efeito potencial deve ser um pouco mitigado na nossa coorte de cuidados de saúde porque é necessário um NAAT para obter folga remunerada, proporcionando um forte incentivo para obter um NAAT se o teste for positivo em casa. Mesmo que se presuma que alguns indivíduos optaram por não acompanhar um resultado positivo de um teste caseiro com um NAAT, é muito improvável que os indivíduos tivessem optado por prosseguir o NAAT depois de receberem a vacina bivalente, mais do que antes de receberem a vacina, a taxas desproporcionais. suficiente para afetar as descobertas do estudo. Não conseguimos distinguir entre infecções sintomáticas e assintomáticas e tivemos que limitar as nossas análises a todas as infecções detectadas. Variáveis não consideradas podem ter influenciado substancialmente os achados. Havia muito poucas doenças graves para que o estudo pudesse determinar se a vacina diminuiu a gravidade da doença. Nosso estudo com profissionais de saúde não incluiu crianças e poucos idosos, e a maioria não estaria imunocomprometida. Por último, durante a maior parte do estudo as variantes circulantes foram as representadas na vacina.
Uma possível explicação para uma eficácia da vacina mais fraca do que o esperado é que uma proporção substancial da população pode ter tido anteriormente uma infecção assintomática pela variante Omicron. Estima – se que cerca de um terço das infecções por SARS-CoV-2 sejam assintomáticas em estudos realizados em diferentes locais e momentos diferentes [ 17–19 ]. Se assim for, a proteção da vacina bivalente pode ter sido mascarada porque aqueles com infecção anterior pela variante Omicron podem já estar de alguma forma protegidos contra a COVID-19 em virtude da imunidade natural. Um estudo de soroprevalência conduzido pelo CDC descobriu que, em fevereiro de 2022, 64% da população da faixa etária de 18 a 64 anos e 75% das crianças e adolescentes tinham evidência sorológica de infecção prévia por SARS-CoV-2 [20], com quase metade dos a sorologia positiva atribuída a infecções ocorridas entre dezembro de 2021 e fevereiro de 2022, que teriam sido predominantemente infecções da linhagem Omicron BA.1/BA.2. Com uma proporção tão grande da população já tendo sido previamente exposta à variante Omicron do SARS-CoV-2, pode haver alguma preocupação de que uma proporção substancial de indivíduos possa provavelmente não obter benefícios substanciais de uma vacina bivalente.
A evolução do vírus SARS-CoV-2 necessita de uma abordagem mais matizada para avaliar o impacto potencial da vacinação do que quando as vacinas originais foram desenvolvidas. Fatores adicionais além da eficácia da vacina precisam ser considerados. A associação do risco aumentado de COVID-19 com números mais elevados de doses anteriores de vacina no nosso estudo foi inesperada. Uma explicação simplista poderia ser que aqueles que receberam mais doses tinham maior probabilidade de serem indivíduos com maior risco de COVID-19. Uma pequena proporção de indivíduos pode ter se enquadrado nesta descrição. No entanto, a maioria dos indivíduos neste estudo eram geralmente jovens e todos eram elegíveis para terem recebido pelo menos 3 doses da vacina até à data de início do estudo, o que tiveram todas as oportunidades de o fazer. Portanto, aqueles que receberam menos de 3 doses (>45% dos indivíduos no estudo) não eram aqueles inelegíveis para receber a vacina, mas aqueles que optaram por não seguir as recomendações do CDC sobre permanecerem atualizados com a vacinação contra a COVID-19, e pode-se esperar razoavelmente que esses indivíduos tivessem maior probabilidade de exibir um comportamento de maior risco. Apesar disso, o risco de adquirir COVID-19 foi menor do que aqueles que receberam um maior número de doses de vacina anteriores. Este não é o único estudo a encontrar uma possível associação com mais doses anteriores de vacina e maior risco de COVID-19. Um grande estudo descobriu que aqueles que tiveram uma infecção pela variante Omicron após receberem anteriormente três doses da vacina tiveram um risco maior de reinfecção do que aqueles que tiveram uma infecção pela variante Omicron após receberem anteriormente duas doses da vacina [21 ] . Outro estudo descobriu que o recebimento de duas ou três doses de uma vacina de mRNA após COVID-19 anterior estava associado a um risco maior de reinfecção do que o recebimento de uma dose única [7 ] . Ainda temos muito que aprender sobre a proteção da vacinação contra a COVID-19 e, além da eficácia de uma vacina, é importante examinar se múltiplas doses de vacina administradas ao longo do tempo podem não estar a ter o efeito benéfico geralmente assumido.
Em conclusão, este estudo encontrou um efeito protetor geral modesto do reforço da vacina bivalente contra a COVID-19, entre adultos em idade ativa. O efeito de múltiplas doses da vacina contra a COVID-19 no risco futuro de COVID-19 necessita de mais estudos.
Notas
Contribuições do autor
NKS: Conceitualização, metodologia, validação, investigação, curadoria de dados, software, análise formal, visualização, redação-preparação do rascunho original, redação-revisão e edição, supervisão, administração de projetos. PCB: Recursos, investigação, validação, redação-revisão e edição. ASN: Metodologia, análise formal, visualização, validação, redação-revisão e edição.
JFS: Recursos, redação, revisão e edição. AH: Recursos, redação, revisão e edição. SMG: Administração do projeto, recursos, redação, revisão e edição.
Potenciais conflitos de interesse
Os autores: Não há conflitos de interesse relatados. Todos os autores enviaram o Formulário do ICMJE para Divulgação de Potenciais Conflitos de Interesse. Foram divulgados conflitos que os editores consideram relevantes para o conteúdo do manuscrito.
Financiamento
Nenhum.
REFERÊNCIAS
- ↵Polack FP, Thomas SJ , Kitchin N , et al. Segurança e eficácia da vacina BNT162b2 mRNA Covid-19 . N Engl J Med 2020 ; 383 : 2603 – 2615 .
Referência CruzadaPubMedGoogle Scholar
- ↵ Baden LR, El Sahly HM , Essink B , et al. Eficácia e segurança da vacina mRNA-1273 SARS-CoV-2 . N Engl J Med 2021 ; 384 : 403-416 ._ _
Referência CruzadaPubMedGoogle Scholar
- ↵ Dagan N, Barda N , Kepten E , et al. Vacina BNT162b2 mRNA Covid-19 em um ambiente nacional de vacinação em massa . N Engl J Med 2021 ; 384 : 1412-1423 ._ _
Referência CruzadaPubMedGoogle Scholar
- ↵ Haas EJ, Angulo FJ , McLaughlin JM , et al. Impacto e eficácia da vacina mRNA BNT162b2 contra infecções por SARS-CoV-2 e casos, hospitalizações e mortes de COVID-19 após uma campanha nacional de vacinação em Israel: um estudo observacional utilizando dados de vigilância nacional . A Lanceta 2021 ; 397 : 1819-1829 ._ _
- ↵ Shrestha NK, Nowacki AS , Burke PC , Terpeluk P , Gordon SM . Eficácia das vacinas mRNA COVID-19 entre funcionários de um sistema de saúde americano . 2021 : 2021.06.02.21258231. Disponível em: https://www.medrxiv.org/content/10.1101/2021.06.02.21258231v1 . Acessado em 10 de agosto de 2021 .
- ↵ Shrestha NK, Burke PC , Nowacki AS , Terpeluk P , Gordon SM . Necessidade de vacinação contra COVID-19 em pessoas que já tiveram COVID-19 . Clin Infect Dis 2022 ; 75 : e662 – e671 .
- ↵ Shrestha NK, Shrestha P , Burke PC , Nowacki AS , Terpeluk P , Gordon SM . “Reforço da vacina contra a doença do coronavírus 2019 em indivíduos previamente infectados ou vacinados (COVID-19)” . Clin Infect Dis 2022 ; : ciac327 .
- ↵ Andeweg SP, de Gier B , Eggink D , et al. Proteção da vacinação contra COVID-19 e infecção anterior contra infecções por Omicron BA.1, BA.2 e Delta SARS-CoV-2 . Nat Comun 2022 ; 13 : 4738 .
Referência CruzadaPubMedGoogle Scholar
- ↵ Altarawneh HN, Chemaitelly H , Hasan MR , et al. Proteção contra a variante Omicron contra infecção anterior por SARS-CoV-2 . N Engl J Med 2022 ; 386 : 1288-1290 ._ _
- ↵ Malato J, Ribeiro RM , Fernandes E , et al. Diminuição rápida da proteção induzida por infecção anterior por BA.1/BA.2 contra infecção por BA.5 . 2022 :2022.08.16.22278820. Disponível em: https://www.medrxiv.org/content/10.1101/2022.08.16.22278820v1 . Acessado em 15 de novembro de 2022 .
- ↵ Lambrou AS. Vigilância genômica para variantes do SARS-CoV-2: Predominância das variantes Delta (B.1.617.2) e Omicron (B.1.1.529) — Estados Unidos, junho de 2021 a janeiro de 2022. MMWR Morb Mortal Wkly Rep 2022 ; 71 . Disponível em: https://www.cdc.gov/mmwr/volumes/71/wr/mm7106a4.htm . Acessado em 15 de dezembro de 2022 .
- ↵ Simon R, Makuch RW . Uma representação gráfica não paramétrica da relação entre a sobrevivência e a ocorrência de um evento: Aplicação ao viés de respondedor versus não respondedor . Stat Med 1984 ; 3 : 35-44 ._ _
Referência CruzadaPubMedWeb da CiênciaGoogle Scholar
- ↵ Therneau TM, Crowson C , Atkinson E. Usando covariáveis dependentes do tempo e coeficientes dependentes do tempo no modelo de Cox . 2021 . Disponível em: https://cran.r-project.org/web/packages/survival/vignettes/timedep.pdf . Acessado em 8 de maio de 2021 .
- Therneau TM,Grambsh , PM . Modelando Dados de Sobrevivência: Estendendo o Modelo Cox . Nova York, NY : Springer International Publishing , 2000 .
- ↵ Equipe principal R. R: Uma linguagem e ambiente para computação estatística . 2022.
- ↵ Link-Gelles R.Eficácia das vacinas bivalentes de mRNA na prevenção da infecção sintomática por SARS-CoV-2 — Aumento do acesso comunitário ao programa de testes, Estados Unidos, setembro-novembro de 2022 . MMWR Morb Mortal Wkly Rep 2022 ; 71 . Disponível em: https://www.cdc.gov/mmwr/volumes/71/wr/mm7148e1.htm . Acessado em 1 de dezembro de 2022 .
- ↵ Oran DP, Topol EJ . A proporção de infecções por SARS-CoV-2 que são assintomáticas□: uma revisão sistemática . Ann Intern Med 2021 ; 174 : 655-662 ._ _
- McDonald SA,Miura F , Vos ERA , et al. Estimando a proporção assintomática de infecção por SARS-CoV-2 na população em geral: Análise de dados de pesquisa sorológica nacional na Holanda . Eur J Epidemiol 2021 ; 36 : 735-739 ._ _
- ↵ Shang W, Kang L , Cao G , et al. Porcentagem de infecções assintomáticas entre indivíduos com variante positiva do SARS-CoV-2 Omicron: uma revisão sistemática e meta-análise . Vacinas 2022 ; 10 : 1049 .
- ↵ Clarke KEN. Soroprevalência de anticorpos SARS-CoV-2 induzidos por infecção — Estados Unidos, setembro de 2021 a fevereiro de 2022 . MMWR Morb Mortal Wkly Rep 2022 ; 71 . Disponível em: https://www.cdc.gov/mmwr/volumes/71/wr/mm7117e3.htm . Acessado em 15 de novembro de 2022 .
- ↵ Chemaitelly H, Ayoub HH , Tang P , et al. Série primária COVID-19 e vacinação de reforço e impressão imunológica . 2022 :2022.10.31.22281756. Disponível em: https://www.medrxiv.org/content/10.1101/2022.10.31.22281756v1 . Acessado em 13 de novembro de 2022 .
