Um estudo de coorte multinacional da Global Vaccine Data Network (GVDN) com 99 milhões de indivíduos vacinados.
Abstrato
Contexto
O Projeto Global de Segurança de Vacinas contra a COVID (GCoVS), estabelecido em 2021 no âmbito da multinacional Global Vaccine Data Network™ (GVDN®), facilita a avaliação abrangente da segurança das vacinas. Este estudo teve como objetivo avaliar o risco de eventos adversos de interesse especial (EAIE) após a vacinação contra a COVID-19 em 10 locais em oito países.
Métodos
Usando um protocolo comum, este estudo de coorte observacional comparou as taxas observadas com as esperadas de 13 EAIE selecionados em resultados neurológicos, hematológicos e cardíacos. As taxas esperadas foram obtidas pelos locais participantes usando dados de saúde pré-vacinação contra a COVID-19 estratificados por idade e sexo. As taxas observadas foram relatadas a partir dos mesmos conjuntos de dados de saúde desde o lançamento do programa de vacinação contra a COVID-19. Os EAIE ocorridos até 42 dias após a vacinação com vacinas de mRNA (BNT162b2 e mRNA-1273) e de vetor de adenovírus (ChAdOx1) foram incluídos na análise primária. Os riscos foram avaliados utilizando rácios observados versus esperados (OE) com intervalos de confiança de 95%. Os potenciais sinais de segurança priorizados foram aqueles com limite inferior do intervalo de confiança de 95% (LBCI) superior a 1,5.
Resultados
Os participantes incluíram 99.068.901 indivíduos vacinados. No total, 183.559.462 doses de BNT162b2, 36.178.442 doses de mRNA-1273 e 23.093.399 doses de ChAdOx1 foram administradas nos locais participantes no período do estudo. Os períodos de risco após esquemas de vacinação homólogos contribuíram com 23.168.335 pessoas-ano de acompanhamento. Razões de OE com LBCI > 1,5 foram observadas para síndrome de Guillain-Barré (2,49, IC 95%: 2,15, 2,87) e trombose do seio venoso cerebral (3,23, IC 95%: 2,51, 4,09) após a primeira dose da vacina ChAdOx1. A encefalomielite disseminada aguda mostrou uma proporção de OE de 3,78 (IC 95%: 1,52, 7,78) após a primeira dose da vacina mRNA-1273. As proporções de OE para miocardite e pericardite após BNT162b2, mRNA-1273 e ChAdOx1 aumentaram significativamente com LBCIs > 1,5.
Conclusão
Esta análise multinacional confirmou sinais de segurança pré-estabelecidos para miocardite, pericardite, síndrome de Guillain-Barré e trombose do seio venoso cerebral. Foram identificados outros potenciais sinais de segurança que requerem investigação mais aprofundada.
Palavras-chave
Vigilância de segurança de vacinas Farmacovigilância Eventos adversos após a imunização Eventos adversos de interesse especial COVID 19 Análise observada vs. Esperada
1. Introdução
Desde a declaração da pandemia de COVID-19 pela Organização Mundial da Saúde (OMS) em 11 de março de 2020, mais de 13,5 bilhões de doses de vacinas contra COVID-19 foram administradas em todo o mundo. Em novembro de 2023, pelo menos 70,5% da população mundial tinha recebido pelo menos uma dose da vacina COVID-19. Este cenário sem paralelo sublinha a necessidade premente de uma monitorização abrangente da segurança das vacinas, uma vez que eventos adversos muito raros associados às vacinas contra a COVID-19 só podem vir à luz após a administração a milhões de indivíduos.
Em antecipação a este lançamento global sem precedentes de vacinas contra a COVID-19, a iniciativa Safety Platform for Emergency vACcines (SPEAC) formulou uma lista de potenciais eventos adversos de interesse especial (EAIE) da vacina contra a COVID-19 em 2020. A seleção dos EAIE baseou-se nas suas associações pré-estabelecidas com a imunização, plataformas de vacinas específicas ou adjuvantes, ou replicação viral durante a doença do tipo selvagem; preocupações teóricas relacionadas à imunopatogênese; ou evidências de apoio de modelos animais usando plataformas de vacinas candidatas.
Uma abordagem flexível para avaliar os EAIE é a comparação das taxas de EAIE observadas após a introdução de um programa de vacinação com as taxas esperadas (ou de base) com base nos períodos históricos anteriores à implementação da vacina. Essas comparações podem ser executadas rapidamente e podem desempenhar um papel fundamental na detecção precoce de potenciais sinais de segurança de vacinas ou quando as agências reguladoras e de saúde pública precisam de uma avaliação rápida de um sinal de segurança emergente. A análise observada versus (vs.) esperada (OE) foi fundamental na identificação da síndrome de trombose com trombocitopenia (TTS) como um sinal de segurança, levando à suspensão do uso da ChAdOx1 (vacina AstraZeneca COVID-19) em 11 de março de 2021, na Dinamarca e Noruega.
Estas avaliações são valiosas não só numa fase inicial da distribuição de vacinas em grande escala, mas também à medida que o programa de vacinação amadurece, especialmente se puderem ser realizadas num contexto multinacional. Conduzimos um estudo de coorte global seguindo o protocolo de estudo de análises observadas vs. esperadas de eventos adversos de interesse especial da COVID-19 com dados de 10 locais em oito países participantes do projeto exclusivo Global COVID Vaccine Safety (GCoVS) da Global Vaccine Data Network™ (GVDN®). O Projeto GCoVS, iniciado em 2021, é uma colaboração global financiada pelos Centros de Controle e Prevenção de Doenças (CDC) de investigadores e fontes de dados de vários países para fins de monitoramento da segurança da vacina COVID-19.
2. Métodos
2.1. Design de estudo
Este estudo observacional retrospectivo foi concebido para estimar os rácios de EO de EAIE selecionados após a vacinação contra a COVID-19 numa coorte populacional de vários países.
2.2. Fonte de dados e população do estudo
O Projeto GCoVS compilou dados eletrônicos de saúde sobre EAIE relacionados às vacinas contra a COVID-19 de participantes de vários locais da rede GVDN, incluindo Argentina, Austrália – Nova Gales do Sul, Austrália – Victoria, Canadá – Colúmbia Britânica, Canadá – Ontário, Dinamarca, Finlândia, França, Nova Zelândia e Escócia. Os dados de saúde eram compostos por dados individuais ou populacionais, dependendo da disponibilidade nos locais de estudo (Tabela Suplementar 1).
Os registos de imunização contendo dados de vacinação a nível individual foram utilizados pela maioria dos locais de estudo. Estes registros abrangiam a mesma população e região geográfica que os conjuntos de dados utilizados para calcular as taxas de base. Também examinamos dados em nível populacional sobre a vacinação usando painéis atualizados regularmente nos locais de estudo. Se o número de indivíduos vacinados em grupos específicos de idade e sexo estivesse disponível, convertemos esses números em pessoas-ano com base no período de risco pós-vacinação. Ao contrário dos registros com dados a nível individual, os estratos de idade e sexo utilizados nesta abordagem podem não ter correspondido aos estratos utilizados nos cálculos das taxas de base.
Os participantes foram indivíduos vacinados com vacinas contra a COVID-19 nas populações representadas pelos locais. Na medida do possível, foram aplicados métodos padronizados em todos os locais. Os tipos de pacientes incluíram pacientes internados em hospitais (Austrália – Nova Gales do Sul, França, Nova Zelândia, Escócia) e combinações de pacientes internados e ambulatoriais no departamento de emergência (Argentina, Austrália – Victoria, Canadá, Dinamarca, Finlândia). Em países sem tipos de pacientes claramente definidos, a duração do contato hospitalar foi utilizada como substituto para os tipos de pacientes. Por exemplo, uma duração de contato de cinco horas ou mais foi utilizada como substituto para pacientes internados na Dinamarca. As características específicas do local das fontes de dados e dos dados são apresentadas na Tabela Suplementar 1.
2.3. Período de estudo e acompanhamento
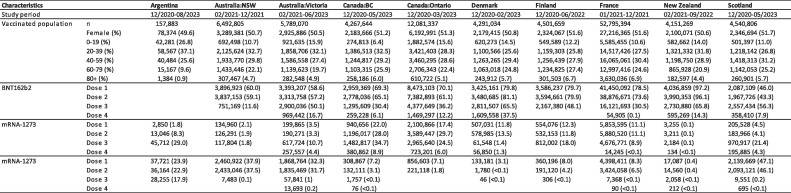
Os períodos de estudo variaram entre os países, começando na data do lançamento do programa de vacinação contra a COVID-19 específico do local e terminando no final da disponibilidade dos dados (Tabela 1). Em geral, os períodos de estudo abrangeram de dezembro de 2020 a agosto de 2023. O período de estudo mais curto observado ocorreu na Austrália – Nova Gales do Sul, incluindo 11 meses de fevereiro de 2021 a dezembro de 2021. A Argentina teve o período de estudo mais longo, de dezembro de 2020 a agosto de 2023, abrangendo um total de 32 meses.
Tabela 1. Resumo da população por site. (Apenas vacinas Pfizer/BioNTech BNT162b2, Moderna mRNA-1273 e Oxford/Astra Zeneca/Serum Institute of India ChAdOx1 e doses 1 a 4 incluídas).
Os intervalos de risco utilizados após cada dose foram 0–7 dias, 8–21 dias, 22–42 dias e 0–42 dias. Para cada dose de vacinação, o dia 0 foi indicado como o dia do recebimento da vacina. Para este manuscrito, apresentamos resultados apenas para o intervalo de risco de 0 a 42 dias. Mais dados são apresentados no painel GVDN com todas as atualizações mais recentes dos lugares participantes. Eventos de desfecho que ocorreram fora do período do estudo não foram incluídos. Um período de eliminação de 365 dias para eventos de resultado foi usado para definir os resultados do incidente. Os eventos de resultado foram considerados incidentes se não houvesse registro do mesmo evento de resultado durante o período de eliminação anterior de 365 dias. Um indivíduo pode ter contribuído com vários eventos de resultados, desde que estivessem separados no tempo por pelo menos um período de “limpeza” de 365 dias.
2.4. Variáveis e resultados do estudo
2.4.1. Eventos adversos de interesse especial (EAIE)
Treze condições que representam EAIE de relevância específica para o cenário atual da farmacovigilância de vacinas no mundo real foram selecionadas da lista compilada pelo Brighton Collaboration SPEAC Project e em resposta aos sinais de segurança da síndrome de trombose com trombocitopenia (Tabela Suplementar 2). As condições escolhidas corresponderam ao AESI para o qual as taxas de fundo foram geradas recentemente pelos sites GVDN. Os EAIE foram identificados utilizando códigos harmonizados da 10ª Revisão da Classificação Internacional de Doenças (CID-10). As condições neurológicas selecionadas incluíram síndrome de Guillain-Barré (GBS), mielite transversa (MT), paralisia facial (Bell), encefalomielite disseminada aguda (ADEM) e convulsões (convulsões generalizadas (GS) e convulsões febris (FS)) como potenciais sinais de segurança foram identificados para algumas dessas condições. As condições hematológicas incluíram trombose do seio venoso cerebral (TVC), trombose da veia esplâncnica (TVS) e embolia pulmonar (EP); as tromboses em locais incomuns (CVST e SVT) foram selecionadas como marcadores de potencial TTS que poderiam ser identificados com precisão usando códigos de diagnóstico. Trombocitopenia e trombocitopenia imune (PTI) também foram incluídas devido à sua associação com STT e relatos de PTI como um sinal de segurança independente. Miocardite e pericardite foram incluídas como condições cardiovasculares e as proporções de OE foram avaliadas separadamente para cada condição.
2.4.2. Vacinas para o covid-19
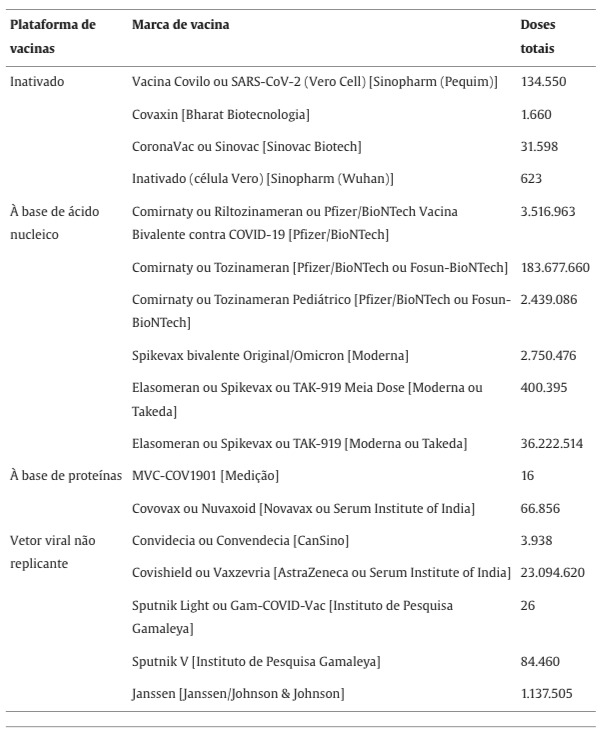
Em novembro de 2023, múltiplas vacinas contra a COVID-19 estavam em uso pelos locais do GCoVS representando múltiplos tipos de plataformas, como plataformas de vetores virais inativados, baseados em ácidos nucleicos (mRNA), baseados em proteínas e não replicantes (Tabela 2). Para este manuscrito, nos concentramos em três vacinas que registraram o maior número de doses administradas, as vacinas Pfizer/BioNTech BNT162b2, Moderna mRNA-1273 e Oxford/Astra Zeneca/Serum Institute of India ChAdOx1. O número cumulativo de doses de outras vacinas administradas (n) nos locais de estudo foi relativamente baixo, com exceções para as vacinas inativadas Sinopharm (n = 134.550) e Sinovac (n = 31.598), a vacina à base de proteína Novavax (n = 66.856) e as vacinas de vetor de adenovírus Janssen/Johnson & Johnson (n = 1.137.505) e Gamaleya Research Institute/Sputnik (n = 84.460). O número total de doses de cada marca de vacina administrada está descrito na Tabela 2. Os dados de exposição à vacina contra a COVID-19 por plataforma/tipo, marca e dose estavam disponíveis a nível individual para determinar o número de casos observados por tipo/marca de vacina e perfil de dose e dentro do intervalo de risco de 0 a 42 dias pós-vacinação.
Tabela 2. Número total de vacinações por marca.
2.5. Análise estatística
2.5.1. Cálculo das proporções observadas versus esperadas para cada local
Para cada local, calculamos o número observado de eventos para cada EAIE no intervalo de risco após a introdução da vacinação contra a COVID-19. Para calcular o número esperado de casos, utilizamos dados de taxas de fundo de vacinação pré-COVID-19 de 2015 a 2019 (2019-2020 para a Dinamarca) coletados nas taxas de fundo de AESI do GCoVS após o estudo de vacinação contra COVID-19. O período de acompanhamento observado em pessoas-ano para um determinado perfil vacinal e período pós-vacinal foi estratificado de acordo com faixa etária e sexo. Cada uma das pessoas-ano estratificadas por idade e sexo foi multiplicada pela taxa de antecedentes estratificada por idade e sexo correspondente. Isto resultou no número esperado de casos em cada estrato, que foi então somado para dar o número total de casos esperados durante o período de acompanhamento observado.
As proporções agregadas de OE por última dose foram calculadas dividindo o número observado de casos pelo número esperado de casos no período pós-vacinação, intervalos de confiança (IC) de 95% foram derivados usando a distribuição exata de Poisson. Também calculamos as proporções de OE para esquemas homólogos para as vacinas BNT162b2, mRNA-1273 e ChAdOx1 até quatro doses. São apresentados tanto os rácios de OE agregados como os específicos dos calendários homólogos.
Consideramos uma relação OE um potencial sinal de segurança preocupante quando o limite inferior do IC de 95% (LBCI) era maior que um e alcançava significância estatística. No entanto, priorizamos possíveis sinais de segurança preocupantes para avaliação adicional onde o LBCI fosse superior a 1,5, devido ao aumento da evidência estatística e à maior probabilidade de ser um sinal verdadeiro, com base na opinião de especialistas dos colaboradores do CDC e da GVDN.
2.5.2. Combinando resultados entre sites
Os resultados foram agregados entre locais, somando o número observado de eventos para cada EAIE e as pessoas-ano estratificadas por idade e sexo para um determinado perfil de vacinação e período pós-vacinação. Para cada EAIE, foram comunicados perfis de vacinas individuais se a quantidade cumulativa de acompanhamento (em pessoas-ano) no período de 0 a 42 dias pós-vacinação fosse de 10.000 ou superior. O número combinado de eventos e o rácio OE foram calculados com IC de 95% derivados utilizando a distribuição exata de Poisson. Nenhum evento (ou seja, zero) observado para uma marca de vacina e perfil de dose foi relatado separadamente sem IC.
2.5.3. Análise sensitiva
Em primeiro lugar, conduzimos análises de sensibilidade específicas do local para explorar ainda mais as associações potenciais dos sinais de segurança mais significativos identificados na análise principal. As taxas observadas informadas pelos sites foram consideradas na análise com base nas seguintes restrições. Para cada marca de vacina e perfil de dose, e combinação do período pós-vacinação, os rácios de OE e o IC de 95% foram suprimidos se fossem observados menos de cinco eventos. Em segundo lugar, conduzimos análises suplementares, incluindo outras vacinas e doses administradas nos locais. O limite de pessoa-ano para notificação foi reduzido de 10.000 para 1.000 pessoa-ano em comparação com a principal análise agregada dos rácios de OE, permitindo a análise de um âmbito mais amplo de vacinas.
2.6. Aprovação ética
A aprovação dos Comitês de Ética em Pesquisa com Seres Humanos relevantes foi adquirida ou uma isenção obtida para todos os locais participantes (Tabela Suplementar 3).
3. Resultados
A população total vacinada em todos os locais compreendeu 99.068.901 indivíduos. A maioria dos receptores da vacina estava nas faixas etárias de 20 a 39 e 40 a 59 anos (Tabela 1). No total, 183.559.462 doses de BNT162b2, 36.178.442 doses de mRNA-1273 e 23.093.399 doses de ChAdOx1 foram administradas em todos os locais nos períodos do estudo. O maior número de doses foi administrado na França (120.758.419), seguida por Canadá – Ontário (32.159.817) e Austrália – Victoria (15.617.627). No total, 23.168.335 pessoas-ano contribuíram para os rácios de OE do EAIE seguindo calendários homólogos. O resumo da população é apresentado na Tabela 1, e informações mais detalhadas sobre as demais vacinas administradas são apresentadas na Tabela Suplementar 4. Nas seções de resultados abaixo, fornecemos índices de OE agregados (Tabela 3, Tabela 4, Tabela 5) e índices de OE detalhados para cronogramas homólogos (Fig. 1, Fig. 2, Fig. 3), incluindo o número de eventos e pessoas-ano. No geral, 95,8% e 86,6% das vacinações foram incluídas na análise agregada e nos calendários homólogos, respectivamente (Tabela Suplementar 5). Os resultados primários de cada local, bem como períodos de risco adicionais e meta-análises para cada EAIE estão disponíveis no painel interativo GVDN Observado vs Esperado (OE).
Tabela 3. Razões de OE agregadas por última dose, condições neurológicas, período de 0 a 42 dias.

Vacinas: Pfizer/BioNTech (BNT162b2), Moderna (mRNA-1273) e Oxford/Astra Zeneca/Serum Institute of India (ChAdOx1).
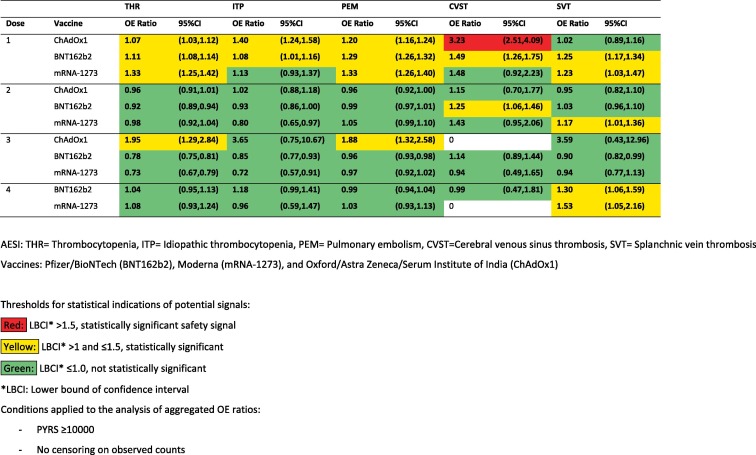
Tabela 4. Razões de OE agregadas por última dose, condições hematológicas, período de 0 a 42 dias.
Vacinas: Pfizer/BioNTech (BNT162b2), Moderna (mRNA-1273) e Oxford/Astra Zeneca/Serum Institute of India (ChAdOx1).
Tabela 5. Razões de OE agregadas por última dose, condições cardiovasculares, período de 0 a 42 dias.

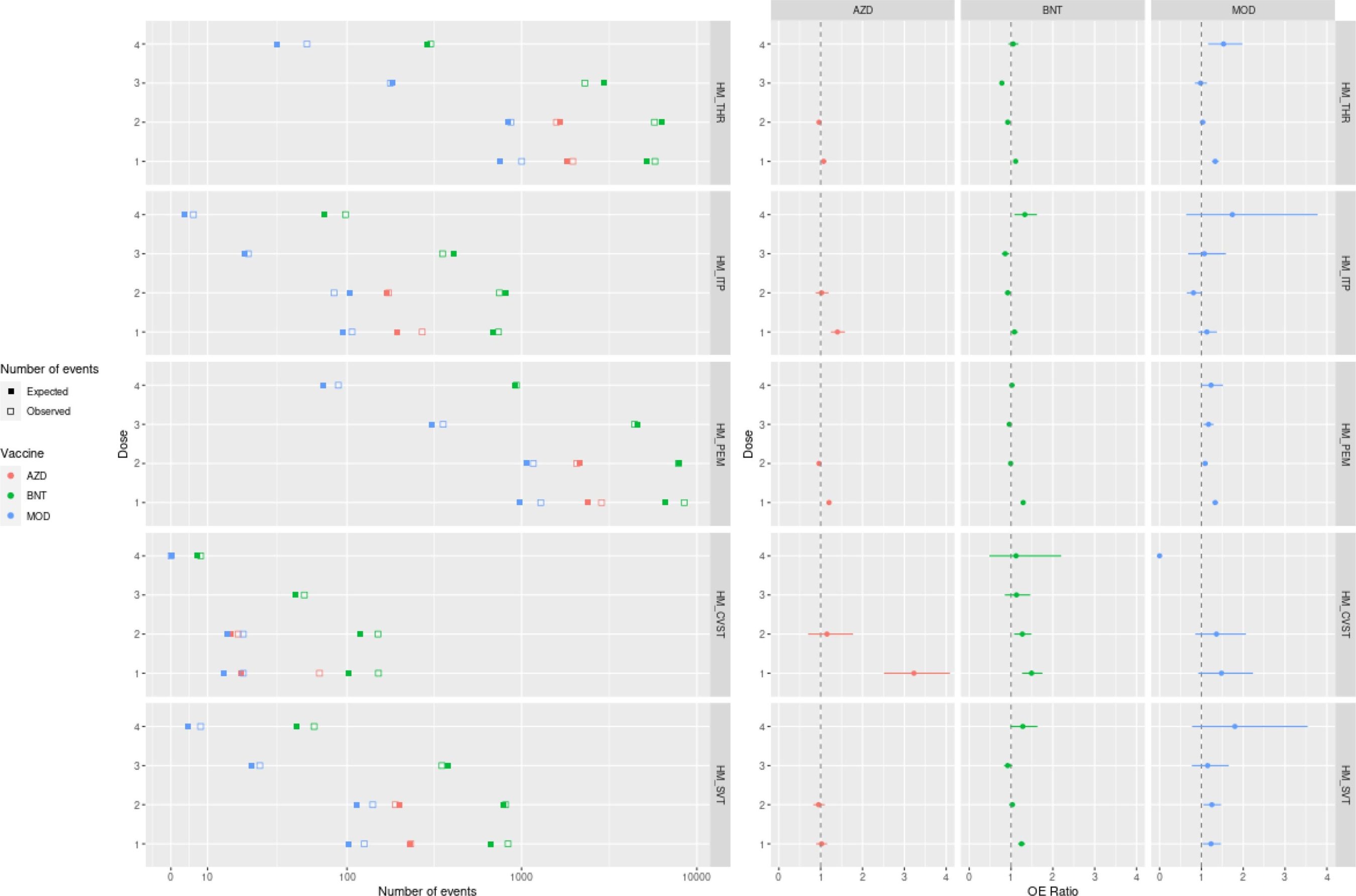
3.1. Condições neurológicas
Houve um aumento estatisticamente significativo nos casos de SGB dentro de 42 dias após a primeira dose de ChAdOx1 (razão OE = 2,49; IC 95%: 2,15, 2,87), indicando um sinal de segurança priorizado (Tabela 3). Foram esperados setenta e seis eventos de SGB e foram observados 190 eventos (Fig. 1). A proporção de OE para ADEM dentro de 42 dias após uma primeira dose de mRNA-1273 também cumpriu o limite de significância de um sinal de segurança priorizado (3,78; IC 95%: 1,52, 7,78), com dois eventos esperados em comparação com sete eventos observados (Fig. 1).
Também foram encontradas diferenças estatisticamente significativas para mielite transversa (razão OE = 1,91; IC 95%: 1,22, 2,84) e ADEM (razão OE = 2,23; IC 95%: 1,15, 3,90) após uma primeira dose de ChAdOx1. A paralisia de Bell teve uma proporção de OE aumentada após uma primeira dose de BNT162b2 (1,05; IC 95%: 1,00, 1,11) e mRNA-1273 (1,25; IC 95%: 1,11, 1,39). Houve também aumento das proporções de OE para convulsões febris após uma primeira e segunda dose de mRNA-1273 (1,36, IC 95%: 1,02, 1,77 e 1,44, IC 95%: 1,04, 1,95, respectivamente), e para convulsões generalizadas após uma primeira dose de mRNA-1273 (1,15, IC 95%: 1,10, 1,20) e uma quarta dose de BNT162b2 (1,09, IC 95%: 1,04, 1,14). Não foram identificados rácios aumentados de OE após uma terceira dose de qualquer vacina. Os resultados são concordantes com os rácios de OE dos esquemas homólogos; no entanto, foi identificada uma proporção aumentada de OE para convulsões generalizadas seguindo um esquema homólogo de quatro doses de mRNA-1273 (1,33; IC 95%: 1,07, 1,63) (Fig. 1). Estes resultados não atingiram o limiar para um sinal de segurança priorizado após a vacinação.
3.2. Condições hematológicas
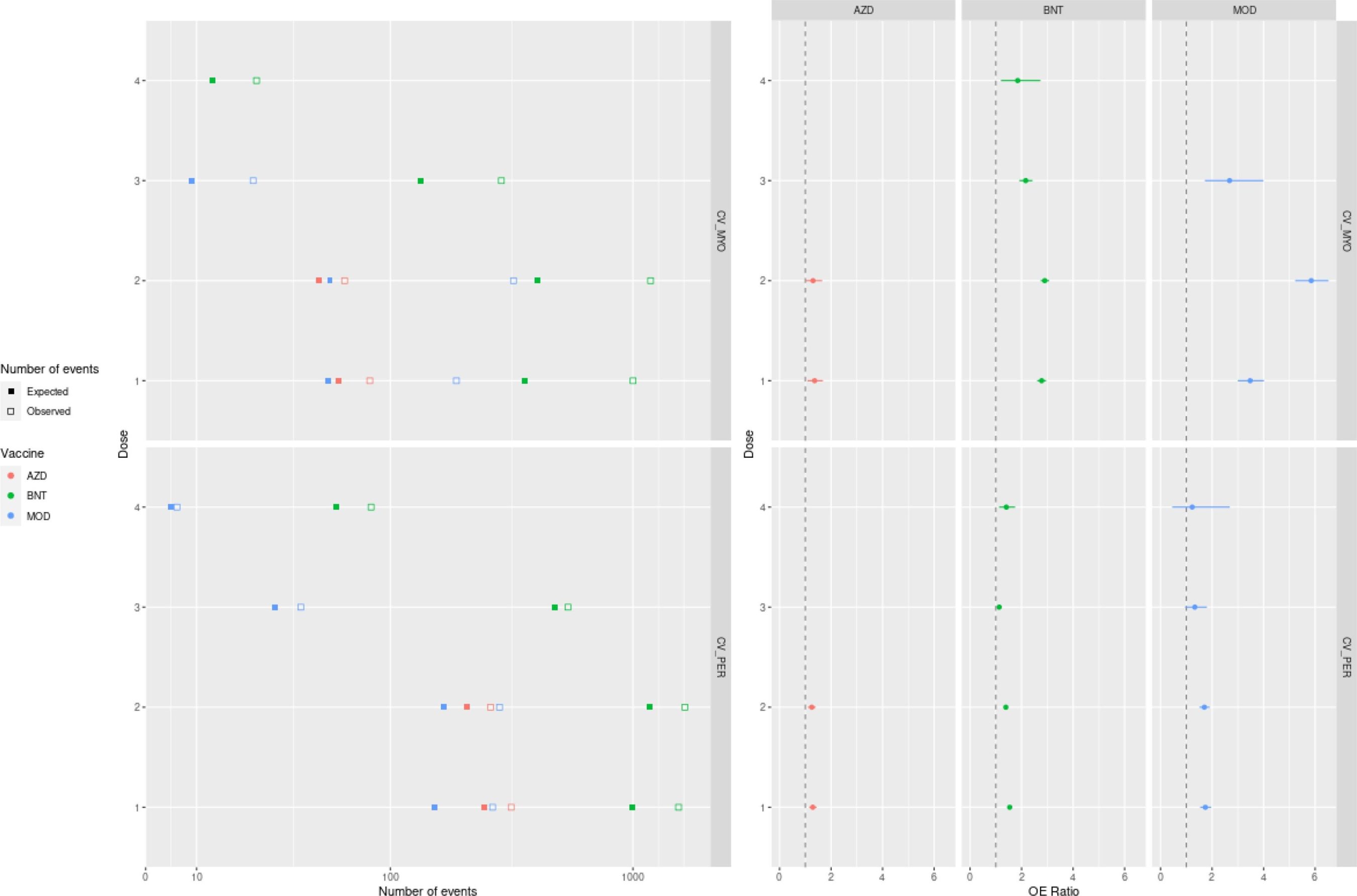
A proporção de OE do CVST foi de 3,23 (IC 95%: 2,51–4,09) dentro de 42 dias após uma primeira dose de ChAdOx1, cumprindo o limite de um sinal de segurança priorizado (Tabela 4). No total, eram esperados 21 eventos, enquanto 69 eventos foram observados (Fig. 2).
Razões aumentadas de OE também foram identificadas para trombocitopenia após uma primeira dose de ChAdOx1 (1,07; IC 95%: 1,03, 1,12), BNT162b2 (1,11; IC 95%: 1,08, 1,14) e mRNA-1273 (1,33; IC 95% 1,25, 1,42), bem como após uma terceira dose de ChAdOx1 (1,95; IC 95%: 1,29, 2,84). A trombocitopenia imune também demonstrou proporções aumentadas de OE após uma primeira dose de ChAdOx1 (1,40; IC 95%: 1,24, 1,58) e BNT162b2 (1,08; IC 95%: 1,01, 1,16). As proporções de OE de embolia pulmonar aumentaram após as primeiras doses de ChAdOx1 (1,20; IC 95%: 1,16, 1,24), BNT162b2 (1,29; IC 95%: 1,26, 1,32) e mRNA-1273 (1,33, IC 95%: 1,26, 1,40), bem como após uma terceira dose de ChAdOx1 (1,88; IC 95%: 1,32, 2,58). A proporção de OE de CVST foi de 1,49 (IC 95%: 1,26; 1,75) após uma primeira dose e 1,25 (IC 95%: 1,06; 1,46) após uma segunda dose de BNT162b2. Foi encontrada uma proporção aumentada de OE para SVT após uma primeira dose de BNT162b2 (1,25; IC 95%: 1,17, 1,34) e mRNA-1273 (1,23; IC 95%: 1,03, 1,47); uma segunda dose de mRNA-1273 (1,17; IC 95%: 1,01, 1,36); e uma quarta dose de BNT162b2 (1,30, IC 95%: 1,06, 1,59) e mRNA-1273 (1,53, IC 95%: 1,05, 2,16). Estes resultados não atingiram o limiar para um sinal de segurança priorizado após a vacinação.
3.3. Condições cardiovasculares
Proporções aumentadas de OE que atendem ao limite de sinais de segurança priorizados para miocardite foram consistentemente identificadas após uma primeira, segunda e terceira dose de vacinas de mRNA (BNT162b2 e mRNA-1273) (Tabela 4). A proporção de OE mais elevada foi observada após uma primeira e segunda dose de mRNA-1273 (3,48; IC 95%: 3,00, 4,01 e 6,10; IC 95%: 5,52, 6,72, respetivamente). A proporção de OE após uma terceira dose de mRNA-1273 foi de 2,01 (IC 95%: 1,60; 2,49). Os números de eventos para até quatro doses de esquemas homólogos são mostrados na Fig. 3. Os rácios de OE dos calendários homólogos alinham-se com os rácios de OE agregados. O OE homólogo para miocardite após quatro doses da vacina mRNA-1273 não pôde ser estimado devido à falta de eventos observados.
Da mesma forma, a proporção de OE para pericardite cumpriu o limite de um sinal de segurança priorizado após uma primeira e quarta doses de mRNA-1273, com proporções de OE de 1,74 (IC de 95%: 1,54, 1,97) e 2,64 (IC de 95%: 2,05, 3,35) respectivamente. Foi também observada uma proporção aumentada de 6,91 (IC 95%: 3,45; 12,36), cumprindo o limiar de um sinal de segurança priorizado, após uma terceira dose de ChAdOx1. As proporções agregadas de OE para pericardite aumentaram após todas as doses de todas as três vacinas apresentadas (Tabela 4). Os resultados são muito semelhantes às proporções de esquemas homólogos (Fig. 3), exceto pela proporção de OE de 1,23 (IC 95%: 0,45–2,69) após o recebimento da quarta dose de mRNA-1273, que não atingiu o limite para um sinal de segurança. A proporção de OE homóloga após uma terceira dose de ChAdOx1 não foi relatada, pois apenas um pequeno número de terceiras doses de ChAdOx1 foram administradas nos locais de estudo (Tabela 1).
3.4. Análise sensitiva
Análises secundárias foram realizadas para explorar ainda mais GBS, ADEM, TVC, miocardite e pericardite em nível específico do local. Relatamos as proporções agregadas de OE por última dose e local no período de 0 a 42 dias após a vacinação nas Tabelas Suplementares 6 a 10. Não foi possível relatar resultados para todos os locais e resultados do estudo devido a pessoas-ano insuficientes ou a menos de cinco eventos observados pelos critérios de privacidade do local. A maioria dos sinais de segurança identificados após combinações específicas de marcas e doses de vacinas na análise principal foram, no entanto, confirmados por locais individuais onde os dados estavam disponíveis. A análise suplementar com limite de pessoas-ano de 1.000 e incluindo outras vacinas e doses administradas nos locais da GVDN, mostrou um aumento da proporção de OE para alguns resultados, por exemplo, para convulsões generalizadas após uma primeira dose da vacina Gamaleya Research Institute/Sputnik (5,50, 95 % CI: 2,74, 9,84) (Tabelas Suplementares 11–13).
4. Discussão
Este estudo de coorte multinacional foi conduzido no cenário único da GVDN. Até à data, o número de grandes estudos sistematicamente coordenados em diversas localizações geográficas e populações é limitado. No entanto, vários estudos avaliaram anteriormente os riscos dos sinais de segurança identificados após a vacinação contra a COVID-19, principalmente em locais únicos. Investigamos a associação entre a vacinação contra a COVID-19 e 13 EAIEs, abrangendo condições neurológicas, hematológicas e cardiovasculares em 10 locais em oito países, incluindo Europa, América do Norte, América do Sul e Oceania. Neste estudo, que incluiu mais de 99 milhões de pessoas vacinadas contra o SARS-CoV-2, o risco até 42 dias após a vacinação foi geralmente semelhante ao risco de base para a maioria dos resultados; no entanto, foram identificados alguns sinais de segurança potenciais. Observamos potenciais sinais de segurança para SGB e TVC após a primeira dose de ChAdOx1 com base em mais de 12 milhões de doses administradas.
No geral, estudos de vacinas baseadas em vetores, como a ChAdOx1, observaram uma incidência mais elevada de SGB após a vacinação em comparação com a incidência de base; enquanto a maioria dos estudos das vacinas de mRNA, como BNT162b2 e mRNA-1273, não observaram aumentos de GBS. Atzenhoffer et al. relataram uma proporção elevada de OE > 2,0 para vacinas contra COVID-19 com vetor de adenovírus, em países que contribuem para o VigiBase, um banco de dados internacional de eventos adversos a medicamentos, e Patone et al. relataram 38 casos excessivos de SGB por 10 milhões de expostos no período de risco de 1 a 28 dias após a vacinação com ChAdOx1 na Inglaterra. Os autores não observaram risco aumentado naqueles que receberam BNT162b2. Em contraste, um estudo de Li et al. não mostraram risco aumentado de SGB para ChAdOx1, enquanto apenas a infecção por SARS-CoV-2 foi associada a um risco maior. A discrepância, comparada com os resultados de Patone et al., no entanto, poderia ser explicado por um tamanho de amostra menor e diferentes medidas de resultados. No geral, esta evidência apoia as nossas descobertas de um sinal de segurança GBS após a vacinação ChAdOx1. Embora rara, esta associação foi reconhecida pela OMS, pela Agência Europeia de Medicamentos (EMA) e pela Therapeutic Goods Administration (TGA) da Austrália, resultando na lista de GBS como um efeito colateral raro após exposição ao ChAdOx1.
O aumento do risco identificado de TVC após a vacinação ChAdOx1 neste estudo é corroborado por vários estudos. Um aumento da proporção de OE foi observado em um estudo de coorte nacional da Dinamarca e da Noruega, com taxas aumentadas de eventos tromboembólicos venosos, incluindo TVC com uma taxa excessiva de 2,5 eventos por 100.000 vacinações após ChAdOx1. Com base em uma variedade de metodologias, outros estudos também relataram aumento da incidência de TVC após a vacinação. Em última análise, este sinal de segurança raro, mas preocupante, levou à retirada da vacina ChAdOx1 dos programas de vacinas contra a COVID-19 ou à implementação de restrições baseadas na idade em vários países.
É crucial reconhecer o limiar de significância dos sinais de segurança priorizados aplicados neste estudo (LBCI > 1,5). Este limite foi selecionado com base na opinião de especialistas da GVDN e do CDC, para focar nos resultados com maior probabilidade de serem sinais verdadeiros. Alguns eventos observados, embora não cumpram este limiar, podem ainda ter importância clínica e exigir investigação adicional. Por exemplo, ITP com uma relação OE > 1,0 e LBCI de 1,2 após a vacinação com ChAdOx1 alinha-se com os resultados relatados na literatura como um sinal potencial. Esta concordância é destacada num estudo realizado em Victoria, Austrália, que observou uma taxa de PTI substancialmente superior à esperada após a vacinação com ChAdOx1.
Além disso, observamos riscos significativamente maiores de miocardite após a primeira, segunda e terceira doses de BNT162b2 e mRNA-1273, bem como pericardite após a primeira e quarta dose de mRNA-1273 e terceira dose de ChAdOx1, no período de risco de 0 a 42 dias. As taxas elevadas de pericardite após a vacinação com ChAdOx1 identificadas neste estudo baseiam-se num número limitado de contagens observadas na meta-análise. O amplo intervalo de confiança sublinha a incerteza substancial de caracterizar a pericardite como um sinal de segurança após a vacinação com ChAdOx1. No entanto, nosso estudo confirma os achados de casos raros previamente identificados de miocardite e pericardite após a primeira e segunda doses de vacinas de mRNA. Um grande estudo de coorte com 23,1 milhões de residentes em quatro países nórdicos revelou um risco aumentado de miocardite entre jovens do sexo masculino com idade entre 16 e 24 anos, com base em 4 a 7 eventos excessivos em 28 dias por 100.000 vacinados após uma segunda dose de BNT162b2, e entre 9 e 28 por 100.000 vacinados após uma segunda dose de mRNA-1273. Da mesma forma, estudos da Colúmbia Britânica, Canadá, relataram que os casos de miocardite são maiores entre aqueles que recebem uma segunda dose em comparação com uma terceira dose, e para aqueles que recebem uma segunda dose da vacina mRNA-1273 em comparação com a vacina BNT162b2. Patone et al. estimaram eventos extras de miocardite entre um e 10 por milhão de pessoas no mês seguinte à vacinação, o que foi substancialmente inferior aos 40 eventos extras por milhão de pessoas observados após o período de infecção por SARS-CoV-2. Uma revisão sistemática de Alami et al. concluiu que indivíduos vacinados com mRNA tinham duas vezes mais probabilidade de desenvolver miocardite/pericardite em comparação com indivíduos não vacinados, com uma taxa de proporção de 2,05 (IC 95% 1,49–2,82). Dadas as evidências, a OMS emitiu orientações atualizadas sobre esses sinais de segurança e a vacinação com mRNA contra a COVID-19, e a EMA forneceu atualizações nas informações do produto para as vacinas BNT162b2 e mRNA-1273. A TGA e o CDC continuam monitorando e revisando dados sobre miocardite e pericardite após a vacinação contra COVID-19.
Outro sinal de segurança potencial foi identificado para ADEM após a primeira dose da vacina mRNA-1273, com cinco eventos observados a mais do que o esperado com base em 1.035.871 pessoas-ano e 10,5 milhões de doses administradas; no entanto, o número de casos deste evento raro foi pequeno e o intervalo de confiança amplo, portanto os resultados devem ser interpretados com cautela e confirmados em estudos futuros. Embora alguns relatos de casos tenham sugerido uma possível associação entre a vacinação contra COVID-19 e ADEM, não houve um padrão consistente em termos de vacina ou momento após a vacinação, e estudos epidemiológicos maiores não confirmaram qualquer associação potencial. Além disso, relatos de casos podem relatar eventos coincidentes e não estabelecer associação nem indicar causalidade, portanto, estudos observacionais maiores são necessários para investigar mais detalhadamente nosso achado. Para resolver esta questão, está sendo realizado um estudo de acompanhamento no âmbito da GVDN, centrando-se num grupo demográfico não incluído na nossa análise. Com base em relatórios de casos raros de ADEM para a Base de Dados Europeia de Suspeitas de Reações Adversas a Medicamentos, a EMA avaliou a potencial associação de ADEM após vacinação com ChAdOx1. Frontera et al. concluíram que as chances de ocorrer um evento neurológico após infecção aguda por SARS-CoV-2 eram até 617 vezes maiores do que após a vacinação contra COVID, sugerindo que os benefícios da vacinação superam substancialmente os riscos. Foi identificado um sinal de segurança para convulsões generalizadas após a vacinação do Gamaleya Research Institute/Sputnik, no entanto, o número de vacinações foi relativamente baixo em comparação com outras vacinas neste estudo. Mais estudos são necessários para explorar este potencial sinal de segurança.
A realização de uma análise de coorte no contexto multinacional único da GVDN aproveita um vasto e diversificado conjunto de dados. A agregação de dados de vários países sobre mais de 99 milhões de receptores de vacinas aumentou significativamente o tamanho da amostra e o poder estatístico em comparação com muitos estudos de segurança anteriores. Isto aumenta a capacidade de detectar sinais de segurança, especialmente para eventos adversos extremamente raros, uma vez que o tamanho maior da amostra proporciona maior precisão na estimativa das taxas observadas.
Os resultados baseados em dados da Europa, América do Norte e do Sul e Oceânia oferecem uma validade externa mais forte, permitindo que os resultados sejam mais generalizáveis para uma gama mais ampla de populações e ambientes de saúde que participam no programa global de vacinação contra a COVID-19. Além disso, as análises multipaíses facilitam comparações entre países com diferentes estratégias de vacinação, demografia populacional e sistemas de saúde, proporcionando insights sobre como estes fatores podem influenciar os perfis de segurança das vacinas. Os dados utilizados na nossa análise foram extraídos de múltiplas bases de dados, incluindo bases de dados de saúde, registros nacionais de imunização e painéis de vacinação, permitindo a identificação de potenciais sinais de segurança de várias fontes.
Os resultados do nosso estudo devem, no entanto, ser interpretados considerando múltiplas limitações. As nossas análises envolvem inerentemente a heterogeneidade na recolha de dados, na qualidade e nos padrões de comunicação entre países. Estas diferenças nas infraestruturas de saúde e nos sistemas de vigilância podem introduzir preconceitos e afetar a comparabilidade dos resultados. Os locais participantes nos oito países implementaram estratégias de vacinação variadas, incluindo tipos de vacinas, calendários de dosagem e priorização de destinatários de vacinas. Além disso, as análises multipaíses são susceptíveis a fatores de confusão populacionais, tais como diferenças em condições de saúde pré-existentes, fatores genéticos, perfis étnicos e padrões comportamentais, que não foi possível ajustar na nossa análise. Consideramos nossa abordagem adequada para aplicação em grandes conjuntos de dados representando populações médias. No entanto, as taxas históricas específicas por idade e sexo que não são ajustadas a fatores como doenças anteriores podem não fornecer uma comparação adequada, por exemplo, nas fases iniciais de campanhas de vacinação em que pessoas com comorbilidades foram vacinadas antes de outras populações.
A potencial subnotificação entre países pode ter levado a uma subestimação da importância dos potenciais sinais de segurança. É importante reconhecer o potencial para falsos negativos, especialmente ao detectar associações com intervalos de confiança inferiores a 1,5 que mantêm significância estatística. Os sinais de segurança identificados neste estudo devem ser avaliados no contexto da sua raridade, gravidade e relevância clínica. Além disso, as avaliações globais de risco-benefício da vacinação devem ter em conta o risco associado à infeção, uma vez que vários estudos demonstraram maior risco de desenvolvimento dos eventos em estudo, como SGB, miocardite ou ADEM, após a infeção por SARS-CoV-2 do que a vacinação. Finalmente, o uso dos códigos CID-10 está sujeito a considerações sobre especificidade e sensibilidade, e a aplicação pode variar de acordo com o país.
5. Conclusão
As análises observadas versus esperadas em um contexto multinacional da GVDN e do Projeto GCoVS oferecem um conjunto de dados maior e mais diversificado, generalização aprimorada e poder estatístico aprimorado sobre estudos regionais ou de um único local. Apresenta também desafios relacionados com a heterogeneidade dos dados, fatores de confusão da população e variações nas estratégias de vacinação e sistemas de notificação. O envolvimento de investigadores e fontes de dados de diversas regiões do mundo promove a inclusão, reduz potenciais preconceitos e promove a colaboração na prossecução de um objetivo partilhado de saúde pública. Embora nosso estudo tenha confirmado sinais de segurança raros previamente identificados após a vacinação contra COVID-19 e contribuído com evidências sobre vários outros resultados importantes, são necessárias investigações adicionais para confirmar associações e avaliar o significado clínico. Isto poderia ser resolvido através da realização de estudos de associação específicos para resultados individuais, aplicando metodologias como a série de casos autocontrolados para validar as associações.
Isenção de responsabilidade
Todas as análises, inferências tiradas, opiniões, conclusões e declarações são de responsabilidade dos autores e não representam necessariamente as opiniões oficiais nem o endosso do CDC/HHS ou do governo dos EUA. Para obter mais informações, visite cdc.gov.
Partes deste material baseiam-se em dados e/ou informações compilados e fornecidos pelo Instituto Canadense de Informações sobre Saúde e pelo Ministério da Saúde de Ontário. As análises, conclusões, opiniões e declarações aqui expressas são de responsabilidade exclusiva dos autores e não refletem as do financiamento ou das fontes de dados; nenhum endosso é pretendido ou deve ser inferido. Partes deste material baseiam-se em dados e/ou informações fornecidas pelo Ministério da Saúde da Colúmbia Britânica. Todas as inferências, opiniões e conclusões tiradas neste manuscrito são de responsabilidade dos autores e não refletem as opiniões ou políticas do(s) Administrador(es) de Dados.
Declaração de financiamento
O projeto GCoVS é apoiado pelos Centros de Controle e Prevenção de Doenças (CDC) do Departamento de Saúde e Serviços Humanos (HHS) dos EUA como parte de um prêmio de assistência financeira totalizando US$ 10.108.491, com 100% financiado pelo CDC/HHS.
O local de Ontário que contribuiu para este estudo foi apoiado pela Public Health Ontario e pelo ICES, que é financiado por uma subvenção anual do Ministério da Saúde de Ontário. JCK é apoiado por um Prêmio Clínico-Cientista do Departamento de Medicina de Família e Comunidade da Universidade de Toronto.
Declaração de contribuição de autoria CRediT
K. Faksova: Visualização, Redação – rascunho original, Redação – revisão e edição. D. Walsh: Curadoria de dados, Análise formal, Investigação, Metodologia, Software, Validação, Conceitualização, Redação – revisão e edição, Visualização. Y. Jiang: Conceitualização, Curadoria de dados, Análise formal, Investigação, Metodologia, Software, Supervisão, Validação, Visualização, Redação – revisão e edição. J. Griffin: Conceitualização, Redação – revisão e edição, Metodologia. A. Phillips: Conceituação, Metodologia, Redação – revisão e edição, Investigação, Validação. A. Gentile: Curadoria de dados, Investigação, Supervisão, Validação. JC Kwong: . K. Macartney: Curadoria de dados, Supervisão, Validação, Redação – revisão e edição, Investigação, Metodologia. M. Naus: Curadoria de dados, Supervisão, Validação, Investigação, Metodologia. Z. Grange: Curadoria de dados, Supervisão, Validação, Conceituação, Investigação, Metodologia. S. Escolano: Curadoria de dados, Supervisão, Validação, Investigação, Metodologia, Redação – revisão e edição. G. Sepulveda: Curadoria de dados, Análise formal, Software, Validação. A. Shetty: Curadoria de dados, Validação, Investigação, Metodologia. A. Pillsbury: Curadoria de dados, Validação, Investigação, Metodologia, Redação – revisão e edição. C. Sullivan: Curadoria de dados, Validação, Investigação, Metodologia, Redação – revisão e edição. Z. Naveed: Curadoria de dados, Validação, Investigação, Metodologia, Redação – revisão e edição. NZ Janjua: Curadoria de dados, Redação – revisão e edição. N. Giglio: Curadoria de dados, Investigação, Metodologia, Validação. J. Perälä: . S. Nasreen: Conceitualização, Curadoria de dados, Validação, Redação – revisão e edição. H. Gidding: Conceituação, Validação, Redação – revisão e edição, Investigação, Metodologia. P. Hovi: Conceituação, Validação, Redação – revisão e edição, Investigação, Metodologia. T. Vo: Conceitualização, Validação, Análise formal, Investigação, Metodologia, Redação – revisão e edição. F. Cui: Conceituação, Investigação, Metodologia, Validação. L. Deng: Conceituação, Investigação, Metodologia, Validação, Redação – revisão e edição. L. Cullen: Conceitualização, Investigação, Metodologia, Validação, Redação – revisão e edição. M. Artama:Conceitualização, Investigação, Metodologia, Validação, Redação – revisão e edição. H. Lu: Curadoria de dados, Análise formal, Software, Validação. HJ Clothier: Conceituação, Metodologia, Validação, Redação – revisão e edição, Curadoria de dados, Análise formal, Administração de projetos. K. Batty: Conceitualização, Metodologia, Administração do projeto, Validação, Redação – revisão e edição. J. Paynter: Conceituação, Metodologia, Supervisão, Curadoria de dados, Análise formal, Redação – revisão e edição. H. Petousis-Harris: Conceitualização, Aquisição de financiamento, Investigação, Metodologia, Recursos, Supervisão, Redação – revisão e edição, Administração do projeto. J. Buttery: Conceitualização, Aquisição de financiamento, Investigação, Metodologia, Recursos, Supervisão, Validação, Redação – revisão e edição, Administração de projetos. S. Black: Conceitualização, Aquisição de financiamento, Investigação, Metodologia, Administração do projeto, Recursos, Supervisão, Validação, Redação – revisão e edição. A. Hviid: Conceitualização, Investigação, Metodologia, Supervisão, Validação, Redação – revisão e edição.
Declaração de interesse concorrente
Os autores declaram os seguintes interesses financeiros/relações pessoais que podem ser considerados potenciais interesses concorrentes: Jeffrey C. Kwong relata que o apoio financeiro foi fornecido pelos Centros de Controle e Prevenção de Doenças. Naveed Z. Janjua relata que o apoio financeiro foi fornecido pelos Centros de Controle e Prevenção de Doenças. Anders Hviid relata que o apoio financeiro foi fornecido pela Global Vaccine Data Network. Helen Petousis-Harris relata que o apoio financeiro foi fornecido pelo Ministério da Saúde da Nova Zelândia. Steven Black relata um relacionamento com a GSK que inclui: consultoria ou assessoria. Jeffrey C. Kwong relata um relacionamento com Institutos Canadenses de Pesquisa em Saúde que inclui: subsídios de financiamento. Jeffrey C. Kwong relata um relacionamento com a Agência de Saúde Pública do Canadá que inclui: subsídios de financiamento. Naveed Z. Janjua relata um relacionamento com a AbbVie Inc que inclui: consultoria ou assessoria e taxas de palestras e palestras. Naveed Z. Janjua relata um relacionamento com a Gilead Sciences Inc que inclui: taxas para palestras e palestras. Anders Hviid relata um relacionamento com o Independent Research Fund Denmark que inclui: financiamento de subsídios. Anders Hviid relata um relacionamento com a Fundação Lundbeck que inclui: subsídios de financiamento. Anders Hviid relata um relacionamento com a Fundação Novo Nordisk que inclui: subsídios de financiamento. Anders Hviid relata um relacionamento com VAC4EU que inclui: consultoria ou assessoria. O Instituto Finlandês de Saúde e Bem-Estar (THL) conduz parcerias público-privadas com fabricantes de vacinas e recebeu financiamento de investigação da Sanofi Inc. Petteri Hovi foi investigador nestes estudos, mas não recebeu qualquer remuneração pessoal. Helen Petousis-Harris atuou em conselhos consultivos de especialistas e fez palestras para a Pfizer e GSK. Ela também recebeu financiamento de pesquisa da GSK. Ela não recebeu nenhum honorário pessoal. Se houver outros autores, eles declaram que não têm interesses financeiros concorrentes ou relações pessoais conhecidas que possam ter influenciado o trabalho relatado neste artigo.