Mansour Tobaiqy, Hajer Elkout, e Katie MacLure
Abstrato
O desenvolvimento de vacinas seguras, eficazes e acessíveis contra a COVID-19 continua a ser a pedra angular para mitigar esta pandemia. No início de dezembro de 2020, vários grupos de investigação conceberam vacinas potenciais. A partir de 11 de março de 2021, vários países europeus suspenderam temporariamente o uso da vacina Oxford-AstraZeneca em meio a relatos de eventos de coágulos sanguíneos e a morte de uma pessoa vacinada, apesar da Agência Europeia de Medicamentos (EMA) e da garantia da Organização Mundial de Saúde de que não havia indicação de que a vacinação estava ligada. Este estudo teve como objetivo identificar e analisar as reações adversas trombóticas associadas à vacina Oxford-AstraZeneca. Este foi um estudo descritivo retrospectivo utilizando notificações espontâneas submetidas à base de dados EudraVigilance no período de 17 de fevereiro a 12 de março de 2021. Houve 54.571 notificações de reações adversas, das quais 28 foram associadas a reações adversas trombóticas. Três mortes foram relacionadas à embolia pulmonar; uma fatalidade por trombose. Com 17 milhões de pessoas que receberam a vacina AstraZeneca, estes são eventos extremamente raros. O Comitê de Avaliação do Risco de Farmacovigilância da EMA (18 de março de 2021) concluiu que a vacina era segura, eficaz e que os benefícios eram superiores aos riscos. A realização de análises adicionais com base em relatos mais detalhados de eventos adversos trombóticos, incluindo características e comorbidades dos pacientes, pode permitir a avaliação da causalidade com maior especificidade.
Palavras-chave: COVID-19, eventos adversos, reação adversa a medicamentos, trombótica, vacina
- Introdução
A pandemia do SARS-CoV 2, o agente causador da COVID-19, representa um desafio sem precedentes para as economias mundiais e para a saúde comunitária. O desenvolvimento de vacinas seguras, eficazes e acessíveis contra a COVID-19 continua a ser a pedra angular para mitigar novas estirpes virais nesta crise pandêmica e restabelecer a normalidade no futuro. Várias terapêuticas farmacológicas foram sugeridas no início da pandemia para o tratamento desta doença, como remdesivir, favipiravir, hidroxicloroquina, tocilizumab, lopinavir-ritonavir (LPV / RTV) e plasma convalescente. No início de dezembro de 2020, vários grupos de pesquisa haviam desenvolvido vacinas potenciais contra COVID-19, com a maioria nos estágios iniciais de aprovação pelas autoridades reguladoras farmacêuticas mundiais.
O adenovírus de chimpanzé que codifica a glicoproteína spike SARS-CoV-2 (ChAdOx1-S) é a vacina Oxford-AstraZeneca projetada para prevenir a infecção por COVID-19. Foi autorizado pela Agência Europeia de Medicamentos (EMA) para utilização em toda a União Europeia (UE) após aprovação pela Comissão Europeia em 29 de janeiro de 2021. A eficácia e segurança da vacina AstraZeneca foram determinadas após uma análise de curto prazo de dados coletados de ensaios clínicos realizados no Reino Unido, Brasil e África do Sul. Aproximadamente 23.745 participantes com 18 anos ou mais foram randomizados e receberam a vacina AstraZeneca contra COVID-19 ou um controle. Os participantes que apresentavam uma ou mais comorbidades tiveram eficácia da vacina de 73,4% (IC 95%: 48,5; 86,3); e na análise atualizada, a eficácia da vacina em participantes com uma ou mais comorbidades foi de 62,7% (IC 95%: 44,8; 74,8). As reações adversas mais frequentemente notificadas (Ars) desde a primeira vacinação foram: sensibilidade no local da injeção (63,7%), dor no local da injeção (54,2%), fadiga (53,1%), dor de cabeça (52,6%), mal-estar (44,2%), mialgia ( 44,0%), pirexia (inclui febre (33,6%) e febre> 38 ° C (7,9%)). A maioria dos Ars foi de gravidade leve a moderada e resolvida dentro de um curto período após a vacinação. As reações adversas às segundas vacinações foram da mesma natureza, mas “mais leves e menos frequentes”.
Desde 11 de março de 2021, vários países europeus (incluindo Dinamarca, França, Itália, Letônia, Noruega, Espanha, Suécia e Países Baixos) suspenderam temporariamente o uso da vacina Oxford-AstraZeneca COVID-19 em meio a relatos de eventos de coágulos sanguíneos e a morte de uma pessoa vacinada. No espaço de uma semana, cerca de 18 países em todo o mundo suspenderam ou restringiram a utilização da vacina por idade. A lista inclui Islândia, Bulgária, República Democrática do Congo, Irlanda, Indonésia, Alemanha, Chipre, Portugal, Eslovênia, Luxemburgo e Tailândia. Esta medida de precaução foi tomada apesar da garantia da Agência Europeia de Medicamentos (EMA) e da Organização Mundial de Saúde de que não havia indicação de que a vacinação estivesse associada a eventos tromboembólicos. De acordo com o resumo das características do produto da vacina AstraZeneca COVID-19 (para profissionais de saúde), distúrbios do sangue e do sistema linfático como reações adversas eram incomuns, no entanto, nenhum detalhe sobre as ocorrências e frequências dessas reações estava disponível neste momento. A AstraZeneca enfatizou a segurança de sua vacina, afirmando que a prevalência de coágulos sanguíneos era “muito menor do que seria esperado que ocorresse naturalmente em uma população geral deste tamanho”.
Tradicionalmente, a monitoramento da segurança das vacinas após o licenciamento está sujeita a uma combinação de vigilância passiva e ativa. O sistema de vigilância passiva é a base da farmacovigilância, que compreende os bancos de dados nos quais são coletados relatos espontâneos de suspeitas de reações adversas a medicamentos (RAMs) e eventos adversos pós-vacinação (EAPV) de médicos e pacientes. O EudraVigilance (EV) é um sistema de farmacovigilância passivo para recolha, gestão e análise de suspeitas de RAM e notificações de EAAV para medicamentos aprovados na UE e é operado pela EMA.
O monitoramento dos relatórios de segurança de medicamentos e vacinas é fundamental porque os ensaios clínicos são concebidos para avaliar principalmente a eficácia; a segurança é normalmente um objetivo secundário. Estes ensaios são capazes de identificar apenas eventos adversos comuns, como reações locais e sistêmicas relacionadas à imunogenicidade da vacina que ocorrem logo após a administração. É improvável que os ensaios detectem eventos adversos raros que ocorrem em ensaios em populações maiores ou reações tardias que ocorrem muito tempo após o uso, portanto, a farmacovigilância e a vigilância pós-comercialização são de grande importância para detectar eventos adversos incomuns.
Este estudo teve como objetivo identificar e analisar as reações adversas trombóticas associadas à vacina Oxford-AstraZeneca após a sua suspensão temporária em vários países da UE, utilizando a base de dados europeia de EV.
- Materiais e métodos
Este foi um estudo descritivo retrospectivo utilizando notificações espontâneas submetidas ao banco de dados de VE no período de 17 de fevereiro a 12 de março de 2021. Os dados foram extraídos da seção de listagem de linha de notificações submetidas ao VE em relação à vacina COVID-19 AstraZeneca (ChAdOx1- S). Foram aplicados os seguintes termos de busca independente de faixa etária, sexo, área geográfica, relator ou nível de gravidade: trombose; embolia; tromboembolismo; embólico e trombótico. Os dados foram limpos com a retirada de colunas e campos irrelevantes, tabulados e apresentados de acordo com o tipo de trombose e desfecho clínico, por sexo e idade.
Consideração ética: Foram utilizados dados de acesso aberto, portanto não foi solicitada autorização de acesso. A política de acesso da EMA afirma que “Não é necessária qualquer autorização para aceder ao conjunto de dados ICSR (Nível 1) através do portal adrreports.eu, ou seja, todos os investigadores acadêmicos podem aceder a dados de reações adversas de interesse”.
- Resultados
No geral, houve 54.571 notificações de reações adversas para ChAdOx1-S relatadas no banco de dados de VE. O número total de notificações tromboembólicas foi de 28, das quais 19 (67%) foram apresentadas por profissionais de saúde. Mais da metade (n = 16; 57%) das notificações referiam-se a pessoas com idade superior a 85 anos; 13 (47%) relatórios eram provenientes da UE (tabela 1 e mesa 2).

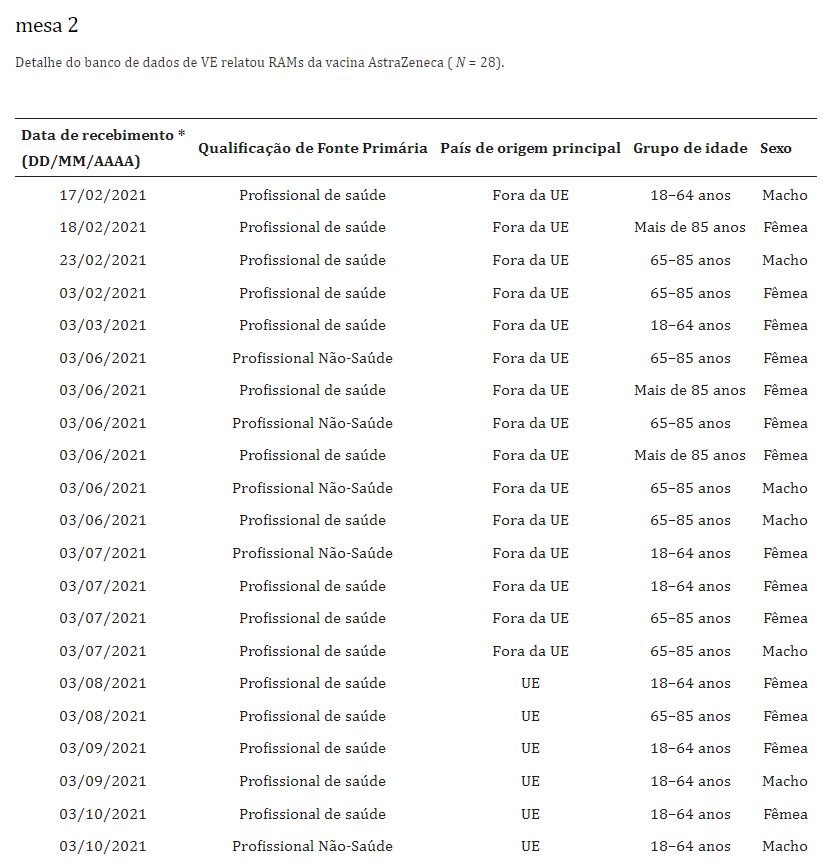

Dos seis casos que relataram embolia pulmonar, dois tiveram desfecho fatal, ambos em mulheres, um em cada uma das faixas etárias de 18 a 64 anos e acima de 85 anos. Entre os homens, houve uma fatalidade após trombose num paciente com idade entre 18 e 64 anos.Tabela 3 (feminino; n = 19) e Tabela 4 (masculino; n = 9) ilustram o tipo de reação tromboembólica relatada juntamente com a evolução clínica dos casos por faixa etária (Tabela 3 e Tabela 4).
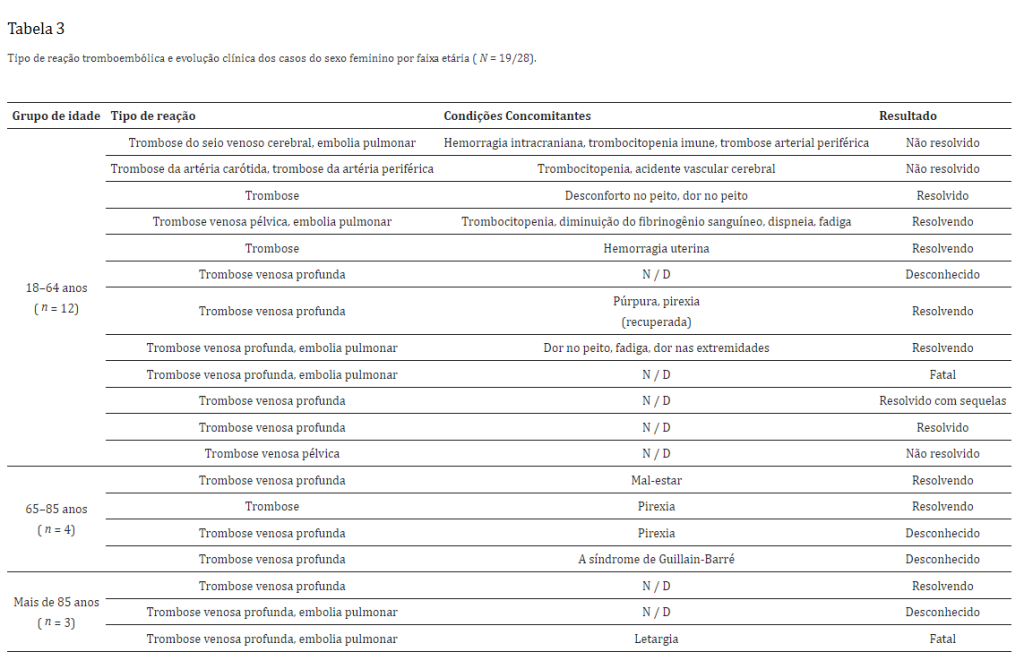
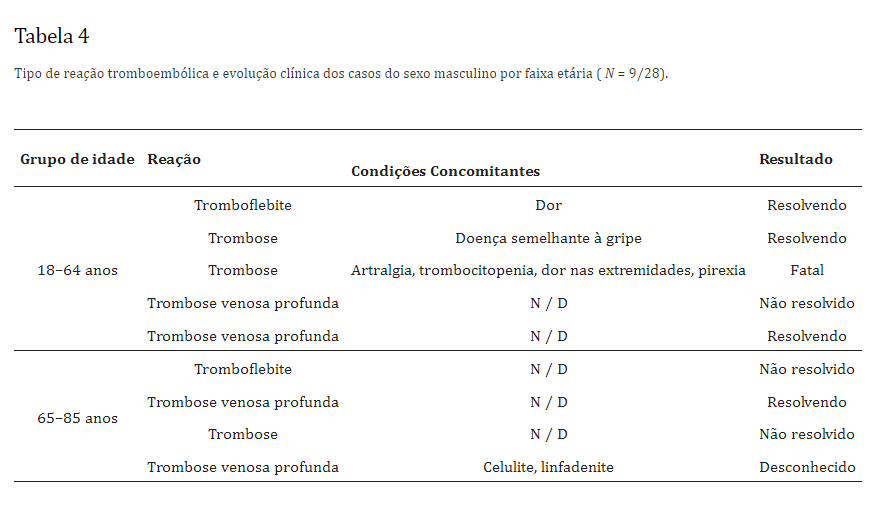
- Discussão
Até à data, 17 milhões de pessoas na UE e no Reino Unido receberam pelo menos a primeira dose da vacina AstraZeneca. Este estudo identificou 28 eventos adversos trombóticos associados ao uso da vacina AstraZeneca através do banco de dados de VE, três dos quais foram desfechos fatais de embolia pulmonar (EP).
A embolia pulmonar (EP) e a trombose venosa profunda (TVP) geralmente têm sido associadas a múltiplos fatores causais. Estas podem ser causas hereditárias ou naturais, incluindo cancro, idade avançada, trauma, tabagismo, estados trombofílicos hereditários ou adquiridos, tromboembolismo prévio e hospitalização por insuficiência cardíaca congestiva ou exacerbação aguda de doença pulmonar obstrutiva crônica (DPOC). EP e TVP estão tipicamente associadas a morbidade e mortalidade. A sua incidência natural varia de 56 eventos por 100.000 pessoas a 182 eventos por 100.000 pessoas, o que deve ser considerado contra as três mortes por EP em 17 milhões após a vacinação. Um único estudo recente da Croácia relatou um aumento na prevalência de “TVP combinada com EP, mas não com EP isolada ou TVP isolada”. Os autores observaram, a partir de sua comparação de pacientes não-COVID-19 em períodos correspondentes de 8 meses em 2019 antes e em 2020 durante a pandemia, uma faixa etária significativamente mais avançada internada no hospital (60,8 ± 17,2 anos versus 68,5 ± 16,8 anos). Foi postulado que a restrição da atividade física devido aos bloqueios pandêmicos pode ser a causa.
Na Europa, uma doença rara (EA – evento adverso – neste cenário) é definida quando afeta cinco em cada 10.000 pessoas (prevalência: 500/milhão). EA ultra ou muito raro é definido como quando afeta uma em 50.000 pessoas ou 20/milhão. Com um cálculo simples de 28 eventos trombóticos relatados em relação à vacina AstraZeneca para 17 milhões de pessoas que receberam a vacina, estes seriam cautelosamente rotulados como eventos extremamente raros.
Notavelmente, seria desafiador e difícil determinar a causalidade e vincular os eventos trombóticos à vacina AstraZeneca utilizando notificações espontâneas. Além disso, a aplicação de cálculos estatísticos pode ser enganosa devido aos dados clínicos e de segurança muito limitados sobre a utilização da vacina nas pessoas afetadas, juntamente com a subnotificação e o baixo número de indivíduos expostos. Esta situação é ainda mais complicada por diferentes fatores de confusão, como as indicações e o amplo espectro de comorbidades desconhecidas dos pacientes.
Embora a vacina AstraZeneca tenha sido o foco, outras vacinas também têm relatado eventos adversos. A pesquisa na base de dados EV da EMA em busca de relatórios de vacinas da Moderna para trombose venosa profunda e embolia pulmonar identificou 29 TVP, das quais 12 também tinham embolia pulmonar; nenhuma morte relatada ou eventos fatais. Da mesma forma, pesquisando os relatórios da vacina Pfizer, foram encontradas 13 TVP no mesmo período de estudo, de 17 de fevereiro a 12 de março, como este artigo relata sobre os eventos adversos da vacina AstraZeneca. Com a vacina Pfizer, 11 pessoas também desenvolveram embolia pulmonar e duas morreram.
Este estudo também identificou aproximadamente o dobro da ocorrência de potenciais eventos trombóticos relatados em mulheres ( n = 19) do que em homens ( n = 9). Eventos trombóticos em mulheres mais jovens estão tipicamente associados à síndrome de hiperestimulação ovariana (OHSS) após tratamento reprodutivo. Embora o mecanismo exato de desenvolvimento de trombose seja desconhecido, foi postulado que os fatores de coagulação podem resultar em níveis elevados do hormônio estradiol. Outros fatores específicos para o desenvolvimento de tromboembolismo venoso (TEV) durante a gravidez incluem parto cesáreo, história de TEV anterior, história familiar de TEV, trombofilia hereditária ou adquirida, obesidade, idade materna mais avançada e imobilização prolongada.
Além disso, e de acordo com uma revisão sistemática e estudo de meta-análise de rede, todos os contraceptivos orais combinados foram associados a um risco aumentado de trombose venosa, dependendo tanto do progestágeno utilizado quanto da dose de etinilestradiol.
Atualmente, o Comitê Misto de Vacinação e Imunização do Reino Unido (JCVI) aconselhou que a vacinação durante a gravidez deve ser considerada em mulheres que são assistentes de saúde ou de assistência social na linha da frente ou que têm condições subjacentes que as colocam em risco muito elevado de serem infectadas, transmitirem ou sofrerem complicações graves de COVID-19, no entanto, nenhum detalhe deste grupo estava disponível para análise neste estudo.
Os próprios componentes da vacina incluem antígenos imunizantes ativos, agentes conjugantes, conservantes, estabilizantes, adjuvantes e meios de cultura utilizados na preparação da vacina, que podem ser considerados potenciais desencadeadores de uma reação alérgica. Muitas reações retardadas são classificadas como reações de hipersensibilidade do Tipo III, que são atribuídas principalmente à formação de complexos imunes que incluem processos mediados por células T. Os sinais mais comuns de reações do tipo retardado incluem erupções cutâneas, que podem incluir urticária, eritema e angioedema.
As limitações deste estudo incluem o pequeno número de potenciais eventos adversos trombóticos e os dados de segurança limitados atualmente disponíveis para a vacina. Pode haver subnotificação por parte de profissionais de saúde e pacientes; a qualidade dos relatórios pode desempenhar um papel significativo que pode causar sinais de segurança falsos negativos ou falsos positivos. Muitos fatores de confusão e dados incompletos, juntamente com vieses de relato, também podem limitar a generalização dos resultados.
No entanto, este estudo forneceu informações valiosas sobre esta área atual a partir de um banco de dados confiável. Identificou um número muito baixo de reações adversas investigadas relacionadas com a vacina AstraZeneca que poderiam ser atribuídas a múltiplos fatores causais e não apenas às vacinas. O Comité de Avaliação do Risco de Farmacovigilância (PRAC) da EMA reuniu-se em 18 de março de 2021. Concluiu que a vacina AstraZeneca era segura, eficaz e os benefícios compensavam os riscos e, por isso, instou as pessoas a aceitarem a vacinação quando oferecida.
Foi sugerido que a administração da vacina AstraZeneca contra a COVID-19 deve ser considerada cuidadosamente e apenas quando o benefício potencial superar quaisquer riscos potenciais, particularmente em pacientes com histórico de trombose do seio venoso cerebral, trombofilia adquirida ou hereditária, trombocitopenia induzida por heparina. Os profissionais de saúde devem estar atentos aos sinais e sintomas de tromboembolismo e/ou trombocitopenia. Os indivíduos vacinados devem ser instruídos a procurar atendimento médico imediato se desenvolverem novos sintomas, como falta de ar, dor no peito, inchaço nas pernas ou hematomas incomuns na pele e/ou petéquias após a vacinação.
A realização de análises adicionais com base em relatos mais detalhados de eventos adversos trombóticos, incluindo características e comorbidades dos pacientes, pode permitir a avaliação da causalidade com maior especificidade. Deve ser realizado por pessoal experiente para identificar quaisquer riscos reais associados a toda e qualquer vacina contra a COVID-19.
- Conclusões
Este estudo identificou apenas 28 eventos trombóticos ligados à vacina AstraZeneca entre 54.571 reações adversas notificadas na base de dados de VE. Esta conclusão deve ser interpretada com cautela, uma vez que a subnotificação, juntamente com os enviesamentos de notificação, podem limitar a generalização dos resultados.
É difícil determinar um efeito causal da vacina no número de doenças tromboembólicas notificadas. Nenhum efeito causal claro pode ser confirmado e múltiplos fatores causais para eventos trombóticos não foram testados e foram indeterminados. É necessária mais investigação para ajudar os conselhos consultivos nacionais de vacinas e as pessoas resistentes às vacinas a tomarem decisões mais bem informadas e baseadas em evidências.
Abreviações
Agência Europeia de Medicamentos (EMA); União Europeia (UE); Reações Adversas (RA); Reações Adversas a Medicamentos (RAM); EudraVigilance (EV); Organização Mundial da Saúde (OMS); Eventos Adversos Pós-Vacinação (EAPV); Embolia pulmonar (EP); Trombose Venosa Profunda (TVP); Doença Pulmonar Obstrutiva Crônica (DPOC); síndrome de hiperestimulação ovariana (OHSS); Comitê Misto de Vacinação e Imunização do Reino Unido (JCVI); tromboembolismo venoso (TEV); Comitê de Avaliação do Risco de Farmacovigilância (PRAC) da EMA.
ANÁLISE DE REAÇÕES ADVERSAS TROMBÓTICAS DA VACINA COVID-19 ASTRAZENECA RELATADAS NO BANCO DE DADOS EUDRAVIGILANCE