Revisitando uma de minhas hipóteses originais sobre a proteína Spike sob uma nova luz: o mimetismo molecular da proteína Spike induzirá doenças autoimunes
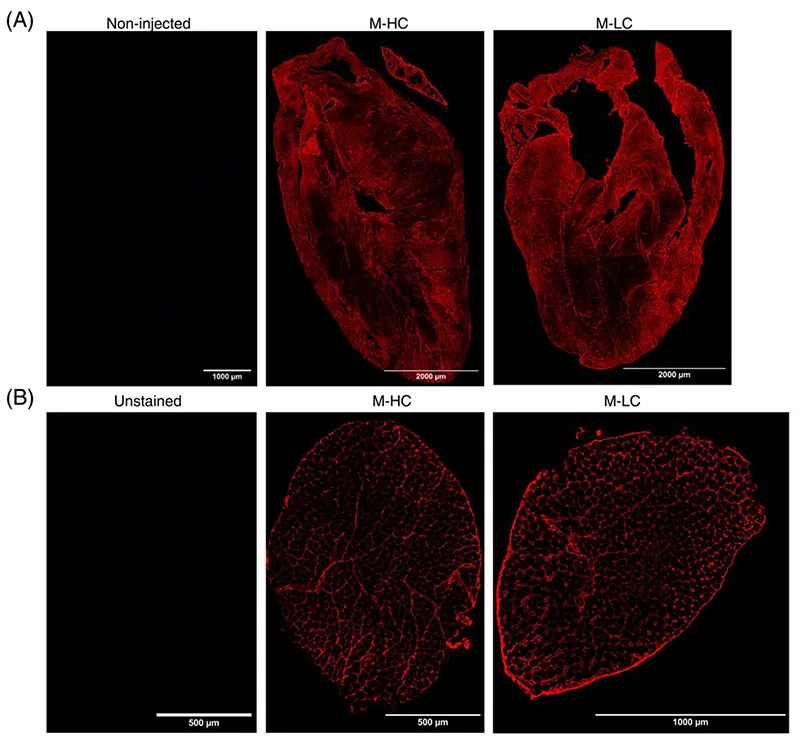
IgG humana injetada (hIgG) de pacientes com COVID Longa (LC) e doadores saudáveis (HC) localiza-se no coração murino e nos músculos esqueléticos. (A) Coloração representativa de hIgG (vermelho) no coração de M-HC (painel do meio) e M-LC (painel direito). Como controlo negativo, foram incluídos corações de ratinhos não vacinados e corados quanto à presença de hIgG (painel esquerdo). (B) Coloração representativa de hIgG no músculo esquelético de M-HC (painel do meio) e M-LC (painel direito). Como controle negativo, o músculo esquelético não corado foi levado junto (painel esquerdo).
Em 23 de novembro de 2021, escrevi que o mimetismo molecular da proteína Spike estava induzindo uma doença autoimune que por sua vez imita a doença do enxerto versus hospedeiro.
FASE 2 – ATIVAÇÃO DE CÉLULAS T DO DOADOR
É aqui que as coisas ficam complicadas e interessantes. Na Fase 2 da GVHD, a ativação, proliferação, diferenciação e migração de células T do doador em resposta às APCs iniciadas ocorrem durante a segunda fase da GVHD aguda. Os receptores de células T (TCR) das células T do doador reconhecem aloantígenos nas APCs do tipo hospedeiro e doador que estão presentes em órgãos linfóides secundários. Durante a apresentação direta, as células T do doador reconhecem o peptídeo ligado às moléculas hospedeiras do MHC ou as próprias moléculas estranhas do MHC.
No entanto, na COVID-19 são as SUAS PRÓPRIAS células T que estão a ativar, proliferar, diferenciar-se e migrar em resposta às APCs preparadas. As homologias na Proteína Spike são os “aloantígenos” – exceto que eles também são seus.
FASE 3 – FASE EFETORA CELULAR E INFLAMATÓRIA
Uma cascata complexa de mediadores celulares e inflamatórios ocorre durante a fase efetora da DECH aguda e da COVID-19. Esses mediadores sinergizam para amplificar a lesão tecidual local e danificar os tecidos alvo. Como tal, a fase efetora da GVHD e da COVID-19 envolve aspectos da resposta imune inata e adaptativa, bem como interações com as células pró-inflamatórias e citocinas geradas durante as fases 1 e 2.
DESTRUIÇÃO DE TECIDOS ALVO. Coração. Pulmão. Gastrointestinal. Cérebro. Etc. Seguido por – FIBROSE.
Este é o COVID grave. Este é o Longo COVID. Estes são MIS-C, MIS-A e MIS-V.
COVID-19 E DOENÇA DO ENXERTO VS HOST https://wmcresearch.org/covid-19-and-graft-vs-host-disease/
Uma pré-impressão foi publicada em 30 de maio e detalha como Long COVID é, pelo menos em parte, uma doença autoimune. Mas primeiro, deixe-me explicar um mecanismo que pode melhorar o mimetismo molecular indutor autoimune da Proteína Spike. Este exemplo vem do estudo de vacinas.
No entanto, raramente se chama a atenção para um fator ambiental significativo aplicado regularmente com o único propósito de prejudicar a tolerância imunológica – os adjuvantes.
O termo adjuvante refere-se a uma variedade de compostos utilizados para estimular a resposta imunitária. Na verdade, a investigação das respostas imunitárias depende destes compostos, uma vez que a indução de uma resposta imunitária “pesquisável” significativa a elementos patogênicos é possível quase exclusivamente quando se injetam estes elementos juntamente com um adjuvante.
Kanduc11 sugeriu que a necessidade de adjuvantes decorre da tolerância inerente do sistema imunológico humano a muitos motivos patogênicos, que são repetidamente compartilhados com o proteoma humano. Portanto, ela sugeriu que após a exposição do sistema imunológico a esses motivos compartilhados, ao mesmo tempo em que prejudica a tolerância imunológica (através da adição de um adjuvante), um resultado razoável pode ser o desenvolvimento de reatividade cruzada e autoimunidade.
Esta aplicação da teoria do mimetismo molecular pode servir para explicar o desenvolvimento potencial de fenômenos autoimunes pós-vacinação.
Autoimunidade induzida por vacina: o papel do mimetismo molecular e da reação imunológica cruzada https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6078966/
Agora, o que torna isso muito interessante e único é que a Proteína Spike É SEU PRÓPRIO ADJUVANTE! Ele, por si só, “acelera” o sistema imunológico, como um adjuvante.
Assim, a “teoria” da vacina de mRNA negligencia a possibilidade de que qualquer célula que produza a proteína Spike e a apresente na sua membrana (associada ou não ao MHC-I) seja atacada e destruída pelas células T CD8+. A gravidade das consequências para o hospedeiro após a vacinação dependerá do tipo e número de células afetadas e do tecido onde ocorre a reação. Por exemplo, a miocardite é considerada uma reação adversa à vacinação com mRNA [85,86]. O fato de esse evento ser mais frequente após a segunda dose e ocorrer alguns dias após a inoculação [27], sugere um mecanismo imunomediado análogo a uma reação autoimune. Concluindo, a proteína Spike atua de forma peculiar, não apenas como imunógeno, mas como agente causador de doenças.
Resposta imunológica e mecanismos moleculares de efeitos adversos cardiovasculares de proteínas Spike de vacinas SARS-CoV-2 e mRNA https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9953067/
Então, tudo isso nos leva à pré-impressão. O que foi descoberto foi que se você pegar anticorpos de indivíduos com COVID Longa e injetá-los em ratos, você induzirá sintomas de COVID Longa. É claro que isso parece lógico, mas não é esse o ponto. A questão é que os anticorpos estão atacando a si mesmos.
Aqui, demonstramos que a transferência de IgG de pacientes com COVID Longa induziu sintomas comportamentais em camundongos, indicando o papel causal da IgG na fisiopatologia do COVID Longa. É importante ressaltar que o padrão e a natureza das mudanças comportamentais foram diferentes dependendo de qual subgrupo de pacientes com LOC o IgG foi derivado. Camundongos injetados com IgG de LC-1, os pacientes com níveis plasmáticos elevados de proteínas neurodegenerativas (GFAP e NFL), exibiram aumento significativo na sensibilidade mecânica e térmica do dia 3 ao 15 após a injeção intraperitoneal de IgG. Isso se alinha com a associação entre astrogliose, danos nos nervos e dor crônica [53]. Além disso, a MMP1, o marcador plasmático mais elevado em pacientes com LC-1 (Supp. Fig. 3A), pode promover dor sustentada induzindo alterações neuroestruturais e sinalização PAR1 [54, 55]. Os ratos que receberam IgG de LC-3 desenvolveram um início mais rápido de hipersensibilidade pós-injeção. O plasma dos pacientes com LC-3 apresentou níveis mais elevados de proteínas de ativação de leucócitos, sendo uma das principais proteínas reguladas positivamente a EIF5A (Supp. Fig. 3C). Curiosamente, a inibição de EIF5A reduz o disparo em neurônios derivados de células-tronco pluripotentes induzidas por humanos (iPSC) e previne a hipersensibilidade mecânica em um modelo de priming hiperalgésico (56). MO detentor dos direitos autorais desta pré-impressão bioRxiv pré-impressão doi: https://doi.org/10.1101/2024.05.30.596590; esta versão publicada em 31 de maio de 2024. (que não foi certificada pela revisão por pares) é o autor/financiador, que concedeu ao bioRxiv uma licença para exibir a pré-impressão perpetuamente. É disponibilizado sob licença CC-BY-NC 4.0 Internacional. Os camundongos LC2 não desenvolveram hipersensibilidade significativa à estimulação mecânica e térmica. Curiosamente, em comparação com os pacientes LC-1 e LC-3, os pacientes correspondentes (LC-2) exibiram níveis plasmáticos mais baixos de proteínas neurais, particularmente envolvidas na regulação do transporte e secreção de neurotransmissores (Fig. 3B). Em contraste, o plasma dos pacientes com LC-2 foi enriquecido em proteínas nas vias do músculo esquelético e cardíaco. Por exemplo, o TTN, uma das proteínas mais enriquecidas nesses pacientes (Fig. 3B), é responsável pela elasticidade passiva do músculo, e sua mutação tem sido associada a distúrbios musculares e cardiomiopatias (57). Os ratos que receberam IgG LC-2 exibiram uma redução significativa na distância percorrida, mas sem defeitos claros de coordenação motora e/ou força de preensão. Como os defeitos de coordenação motora estão frequentemente associados à patologia neurológica, as assinaturas das proteínas plasmáticas estão alinhadas com as alterações motoras observadas em camundongos que receberam IgG de LC-2. Além disso, estratificamos LC-2 com base no aumento de IFN-β, e altos níveis de IFN tipo I diminuem a proliferação de células-tronco musculares saudáveis [58] e induzem fraqueza contrátil, particularmente por IFN-β [59]. A potencial associação patológica entre assinaturas do proteoma plasmático e resultados comportamentais murinos induzidos por IgG ressalta o papel fundamental da IgG na patogênese heterogênea de COVID Longa.Mais investigações são necessárias para elucidar se as IgGs de pacientes individuais induzem efeitos patológicos variados.
A transferência de IgG de pacientes com COVID Longa induz sintomatologia em camundongos https://www.biorxiv.org/content/10.1101/2024.05.30.596590v1.full.pdf
Acredito que isto fornece evidências fortes e convincentes de que COVID Longa é, de fato, uma doença autoimune quase certamente induzida pela proteína Spike. Continuarei investigando para compreender melhor os mecanismos em ação e encontrar terapêutica para tratar esta doença latente.
Fonte: https://wmcresearch.substack.com/p/long-covid-is-an-autoimmune-disease
