Publicada na semana passada, a evidência mais convincente até o momento apoiando minha hipótese SPED (doença endotelial da proteína spike).
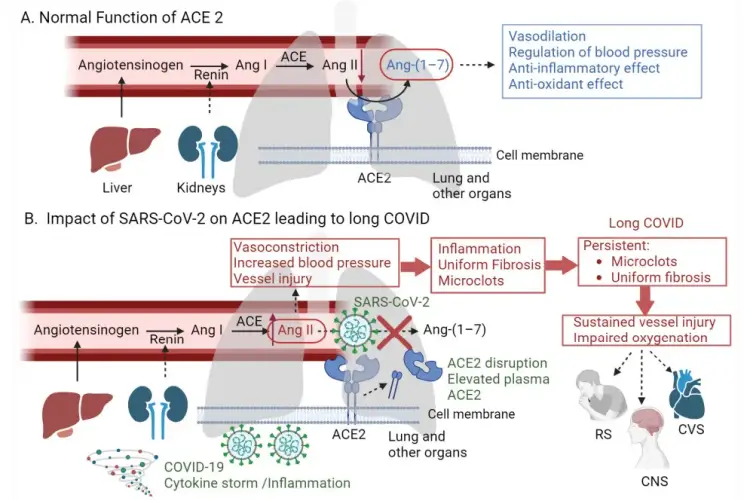
Uma representação gráfica da hipótese proposta. (A) Função normal da ECA2 no sistema renina-angiotensina (SRA): A renina converte o angiotensinogênio em angiotensina I (Ang I). Ang Infect. Dis. Rep. 2024, 16 565 I é então convertida em angiotensina II (Ang II) pela ECA, que está presente nas superfícies das células endoteliais, principalmente nos pulmões e rins. A ECA2 atua como um contra-regulador convertendo Ang II em angiotensina 1–7 (Ang-(1–7)), que exibe atividades vasodilatadoras e anti-inflamatórias, regulando assim a pressão arterial. (B) Impacto do SARS-CoV-2 na ECA2 levando à COVID longa: O SARS-CoV-2 se liga à ECA2, reduzindo sua presença no endotélio do pulmão e de outros órgãos, o que interrompe a função normal da ECA2. Isso aumenta os níveis de Ang II, levando à vasoconstrição, lesão vascular e inflamação. Além disso, a ligação do SARS-CoV-2 ao ACE2 causa a eliminação desses receptores por várias proteases, levando a níveis elevados de ACE2 plasmático. Esses eventos contribuem para a formação de microcoágulos persistentes e fibrose uniforme, levando à oxigenação prejudicada — um sintoma característico da COVID longa que afeta vários sistemas, incluindo os sistemas respiratório (RS), nervoso central (CNS) e cardiovascular (CVS) (criado com BioRender.com, acessado em 1º de abril de 2024).
Primeiro, gostaria de começar com a declaração mais significativa deste artigo, publicado na semana passada, que oferece a evidência mais convincente para minha hipótese SPED:
Da mesma forma, camundongos infectados com o vírus SARS-CoV, ou sua proteína S, exibiram sintomas graves como aqueles de camundongos com deficiência de ACE2, incluindo piores resultados de danos pulmonares induzidos por ácido, caracterizados por alterações estruturais no tecido pulmonar, aumento do edema pulmonar e maior presença de leucócitos.
Eu disse isso desde o começo. Todas as minhas pesquisas me indicaram que a própria proteína Spike induziria a disfunção endotelial encontrada em infecções por SARS-CoV-2, COVID longa e, eventualmente, lesão por vacina.
Há três anos publiquei o seguinte:
O SARS-CoV-2 É PRINCIPALMENTE UMA DOENÇA DA INTERAÇÃO DA PROTEÍNA SPIKE COM A MICROVASCULATURA https://wmcresearch.org/the-spike-protein-and-the-microvasculature/
É isso que eu terminaria de chamar de Doença Endotelial da Proteína Spike (SPED). Eu afirmo que é a base para a destruição lenta e progressiva de órgãos a longo prazo, que as evidências mostram estar ocorrendo em pessoas com COVID Longa. Testes precisam ser conduzidos para determinar em qual porcentagem da população isso pode ocorrer.
Parte do SPED, eu hipotetizei, envolve a indução de microcoágulos, que formariam agregados (propriedades amiloides) e seriam resistentes à degradação. O artigo que estamos revisando mostra que esse é, de fato, o caso.
É importante ressaltar que a introdução da proteína spike S1 do SARS-CoV-2 purificada e recombinante no plasma normal capaz de coagular pode desencadear a formação de coágulos anormais. Esses coágulos não apenas assumem estados amiloides, mas também mostram resistência à fibrinólise, o processo que decompõe os coágulos sanguíneos.
Outro aspecto importante do SPED é a perda de ACE2. Eu também havia previsto que a Spike Protein induziria esse fenômeno, novamente, três anos atrás.
A COVID-19 É UMA DOENÇA DE ANG II SUPEREXPRESSA: A DEGRADAÇÃO/REGULAÇÃO NEGATIVA DA ACE2 PELA PROTEÍNA SPIKE RESULTA EM HIPERTENSÃO ARTERIAL PRIMÁRIA, DOENÇA MICROVASCULAR E DANOS AO DNA.
A PROTEÍNA SPIKE FAZ COM QUE OS HUMANOS SE “AUTOINJETEM” COM ANG II. ASSIM COMO É FEITO EM EXPERIMENTOS COM RATOS DE LABORATÓRIO
HIPERATIVAÇÃO DO RAAS – ANG II “INFUSÃO” https://wmcresearch.org/raas-hyperactivation-ang-ii-infusion/
O artigo também prova que a entrada viral (proteína Spike) causa essa perda de ACE2.
Uma vez que o vírus entra na célula hospedeira, ele reduz a expressão de ACE2, levando a um aumento de Ang II, que por sua vez se liga ao seu receptor, o receptor Ang II tipo 1, e influencia a expressão de várias metaloproteinases de matriz como MMP-1 e MMP-3, e citocinas inflamatórias como TNF-α, IL-6, IL-8, IL-1 e MCP1 por meio da sinalização do fator nuclear κB [50,51].
Isso, como meu artigo demonstra, também induz muitas outras patologias e doenças do envelhecimento.
Além disso, propus que esses efeitos da proteína Spike induziriam fibrose sistêmica, precisamente paralela à encontrada na Síndrome da Fibrose por Radiação.
SÍNDROME DE FIBROSE DE PROTEÍNA DE SPIKE https://wmcresearch.org/spike-protein-fibrosis-syndrome/
O artigo também mostra que esse é o caso.
Os microcoágulos, compostos de fibrina e outros materiais gerados por lesão vascular, persistem por meses após a diminuição da inflamação pulmonar, indicando lesão vascular em andamento. Isso pode ser parcialmente atribuído à privação de oxigênio devido à fibrose [68].
iii. Esses sintomas persistentes têm maior probabilidade de resultar em fibrose pulmonar pós-COVID-19 (PCPF). Curiosamente, a PCPF foi relatada em aproximadamente 44,9% dos sobreviventes da COVID-19. Pacientes com fibrose frequentemente apresentam sintomas persistentes, como dispneia, tosse, dor no peito, fadiga e mialgia [69]. Notavelmente, o padrão de fibrose na COVID-19 difere acentuadamente daquele observado em ambientes ocupacionais [70]. É mais uniforme e menos detectável por imagens convencionais (ou seja, raio-X) e indica um mecanismo patológico distinto. Essa fibrose uniforme pode agravar ainda mais a falta de oxigênio e contribuir para complicações vasculares.
Complicações vasculares persistentes na COVID longa: o papel da desativação da ACE2, microcoágulos e fibrose uniforme https://www.mdpi.com/2036-7449/16/4/42
Todos os pontos acima apontam para minha grande preocupação atual de longo prazo sobre reinfecções ou exposições repetidas à proteína Spike. É DIFÍCIL DE DETECTAR (veja a citação acima) a fibrose microvascular fechando lenta e inexoravelmente o suprimento de sangue para nossos órgãos? Respostas são necessárias imediatamente. Como mencionei anteriormente, precisamos procurar evidências disso na população saudável, não apenas naquelas com COVID Longa. Veja minha postagem da semana passada para mais detalhes.
Investigarei terapêuticas para aumentar os níveis de ACE2. Isso pode provar ser uma ferramenta valiosa para melhorar a perda de ACE2 que a proteína Spike induz.
Fonte: https://wmcresearch.substack.com/p/reviewing-persistent-vascular-complications