George B. Stefano, Pascal Büttiker, Simon Weissenberger, Martin Anders, Jiri Raboch, Radek Ptacek, e Richard M. Kream
Abstrato
‘Príon’ é um termo usado para descrever uma partícula infecciosa proteica responsável por várias doenças neurodegenerativas em mamíferos, por exemplo, a doença de Creutzfeldt-Jakob. A novidade é que é um agente infeccioso baseado em proteína que não envolve um genoma de ácido nucleico como encontrado em vírus e bactérias. Os distúrbios de príon exibem, em parte, períodos de incubação, perda neuronal e induzem o dobramento anormal de proteínas celulares normais específicas devido ao aumento de espécies reativas de oxigênio associadas ao metabolismo energético das mitocôndrias. Esses agentes também podem induzir anormalidades de memória, personalidade e movimento, bem como depressão, confusão e desorientação. Curiosamente, algumas dessas mudanças comportamentais também ocorrem na COVID-19 e mecanicamente incluem danos mitocondriais causados pelo SARS-CoV-2 e a produção subsequente de espécies reativas de oxigênio. Tomados em conjunto, supomos, em parte, que a COVID longa pode envolver a indução do surgimento espontâneo de príons, especialmente em indivíduos suscetíveis à sua origem, podendo assim explicar algumas de suas manifestações pós-infecção viral aguda.
Palavras-chave: SARS-CoV-2, COVID-19, COVID Longa, Príon, Distúrbios de Príons, Mitocôndrias, Confusão, Depressão
Introdução
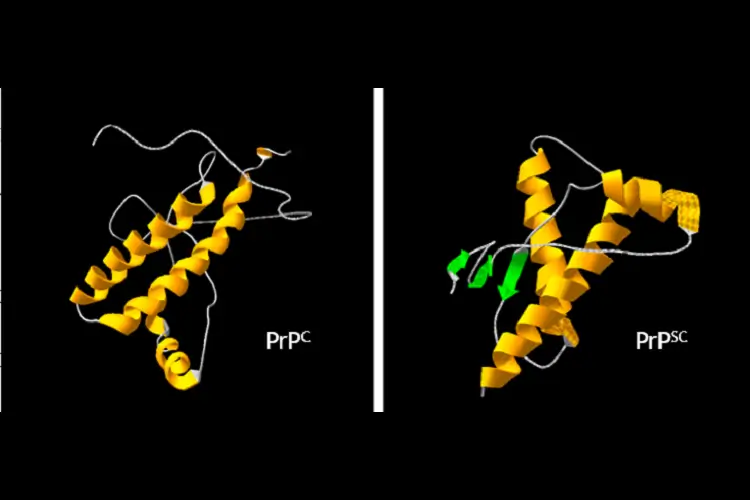
As doenças priônicas são um grupo de distúrbios neurodegenerativos incuráveis que resultam do acúmulo de proteínas priônicas anormalmente dobradas no cérebro. Embora não contenham DNA ou RNA, essas proteínas anormalmente dobradas se propagam como agentes infecciosos e servem como modelos para a conversão de proteína sensível à protease (PrP C ) em isoformas patológicas resistentes à protease e conformacionalmente correspondentes (PrP Sc ). As doenças priônicas (também conhecidas como encefalopatias espongiformes transmissíveis, ou TSEs) são uniformemente fatais e foram diagnosticadas em humanos e em inúmeras espécies animais (Tian e Dong 2013). A doença de Creutzfeldt-Jakob (CJD), a doença de Gerstmann-Straussler-Scheinker, o kuru e a insônia familiar fatal estão entre os distúrbios que foram identificados como doenças priônicas (De Armond e Bouzamondo 2002 ; McKintosh et al. 2003).
Discussão
Papel das mitocôndrias na patogênese das doenças priônicas
Pelas estimativas atuais, ~ 1–2 milhões de pessoas no mundo são afetadas por doenças de príons (Zambrano et al. 2022). Essas proteínas de príons infecciosas e propagantes se agrupam em células cerebrais, onde induzem a morte celular e a degeneração do tecido. Mecanicamente, os príons induzem mudanças patológicas no metabolismo celular e na produção de energia por meio de sua capacidade de danificar as mitocôndrias e prejudicar a função mitocondrial (Zambrano et al. 2022). Dado seu papel crucial na manutenção do suprimento de energia celular, o dano mitocondrial e a disfunção subsequente podem ser um primeiro passo crítico na patogênese das doenças de príons (Zambrano et al. 2022). É importante ressaltar que as proteínas mitocondriais (por exemplo, mitofilina, proteína de choque térmico e fator indutor de apoptose) são acopladas à morte celular induzida por príons (Moore et al. 2014). Além disso, hamsters com doença de príons apresentam diminuição estatisticamente significativa na respiração mitocondrial juntamente com aumento do estresse oxidativo (Faris et al. 2017; Choi et al. 1998). Zambrano e colegas (Zambrano et al. 2022) levantaram a hipótese de que intervenções projetadas para preservar a função mitocondrial podem ajudar as células a resistir à rápida disseminação desses agentes e aos danos provocados por essas proteínas de príons mal dobradas, e podem até mesmo promover sua eliminação. Seguindo essa linha de pensamento, especulamos que mitocôndrias disfuncionais podem ser mais suscetíveis à infecção e mais eficazes na geração e propagação de proteínas de príons mal dobradas, contribuindo assim para a patogênese da doença de príons.
O direcionamento mitocondrial e sua sensibilidade aumentada a espécies reativas de oxigênio e nitrogênio (ROS e RNS, respectivamente) ressaltam o papel dessas organelas na patogênese de distúrbios de príons. A superprodução e o acúmulo de ROS e RNS, combinados com uma resposta inadequada dos sistemas de enzimas antioxidantes, destroem lipídios celulares, proteínas, DNA e RNA (Islam 2017; Benz et al. 2002), incluindo aqueles associados às mitocôndrias. As contribuições do estresse oxidativo foram associadas às etiologias de inúmeras doenças neurodegenerativas (NDDs), incluindo doença de Alzheimer, esclerose lateral amiotrófica, ataxia de Friedreich, doença de Huntington, esclerose múltipla e doença de Parkinson (Islam 2017; de la Torre e Stefano 2000). Além disso, pode-se supor que o estresse oxidativo contínuo pode agravar o dobramento incorreto das proteínas e levar a outros NDDs (Islam 2017; de la Torre e Stefano 2000).
Especificamente, o controle de qualidade mitocondrial aberrante (ou seja, mitofagia disfuncional) foi implicado como contribuinte para a patogênese de inúmeras doenças humanas, incluindo câncer, disfunção cardíaca e distúrbios neurológicos, notavelmente a doença do príon (Kim et al. 2022). Por exemplo, Kim e colegas (Kim et al. 2022) usaram modelos experimentais infectados por scrapie para explorar o papel do controle de qualidade mitocondrial na patogênese da doença. Entre suas descobertas, eles relataram que a infecção por scrapie levou à indução de espécies reativas de oxigênio mitocondriais (mtROS) e à perda do potencial de membrana mitocondrial (ΔΨm). Essas respostas iniciais levaram à fosforilação aumentada da proteína 1 relacionada à dinamina (Drp1) em Ser616 e seguida por sua translocação para as mitocôndrias seguida por mitofagia excessiva. A fissão mitocondrial aberrante associada à infecção e a mitofagia também levaram a aumentos na sinalização apoptótica, ou seja, ativação da caspase 3 e clivagem da poli (ADP-ribose) polimerase. Esses resultados sugerem que a infecção por scrapie levou a deficiências nos processos de controle de qualidade mitocondrial seguidos pela morte de células neuronais. Coletivamente, esses mecanismos podem desempenhar papéis importantes na neuropatogênese de doenças de príons.
Doenças de Príons e SARS-CoV-2
De acordo com nosso entendimento atual, o dobramento incorreto da proteína príon celular (PrP C ) em sua isoforma patológica (PrP Sc ) é patognomônico da doença príon primária (Hara et al. 2021). Curiosamente, Hara e colegas (Hara et al. 2021) realizaram uma série de experimentos que revelaram que a infecção com uma cepa neurotrópica do vírus influenza A (IAV/WSN) resultou no dobramento incorreto de PrP C em PrP Sc e na geração de príons infecciosos em células de neuroblastoma de camundongo. Esses resultados sugerem que a infecção com um vírus não relacionado pode induzir o dobramento incorreto de PrP C em PrP Sc e a formação de príons infecciosos. Recentemente, Young e colegas (Young et al. 2020) descreveram um homem cujas primeiras manifestações da doença de Creutzfeldt-Jakob (CJD) ocorreram em conjunto com o início sintomático da doença do Coronavírus-2019 (COVID-19). Com base em descobertas recentes focadas na patogênese da doença priônica, juntamente com nossa compreensão atual das respostas imunológicas ao SARS-CoV-2, Young e colegas (Young et al. 2020) levantaram a hipótese de que a cascata de mediadores inflamatórios sistêmicos sintetizados e liberados em resposta à infecção pelo SARS-CoV-2 serve para acelerar o desenvolvimento da doença priônica preexistente.
Recentemente, nosso grupo e outros especularam sobre a natureza de potenciais novos mecanismos neuropatológicos moleculares associados à COVID-19, envolvendo bioenergética mitocondrial (Singh et al. 2020; Wu et al. 2020; Wang et al. 2020) e direcionamento de vias de sinalização mediadas por mitocôndrias em resposta às sequelas inflamatórias da infecção por SARS-CoV-2 (Stefano e Kream 2022b; Stefano et al. 2022). É interessante notar que a transferência de DNA das mitocôndrias para o genoma da célula eucariótica representa um antigo fenômeno evolutivo, precedendo a especiação humana (Wei et al. 2022). No entanto, pesquisas recentes de Wei e colegas demonstram que há uma transferência contínua de DNA mitocondrial para o genoma contendo o núcleo (segmentos nucleares-mitocondriais (NUMTs)). Além disso, os processos de metilação inibiram a expressão desse material genético, no entanto, alguns segmentos, uma minoria, são expressos. Especulamos que esse fenômeno comum e antigo pode estar envolvido na estratégia viral de mirar nas mitocôndrias, levando à alteração do genoma da célula eucariótica e ao acesso por meio do qual proteínas aberrantes emergem. Aqui, esse fenômeno pode se tornar mais evidente comportamentalmente em neurônios acoplados à cognição, uma vez que são suscetíveis a um suprimento de energia diminuído.
As mitocôndrias são fontes críticas de ATP e, portanto, de fundamental importância nas células eucarióticas, principalmente aquelas que contribuem para a função neural, cardíaca e do sistema imunológico. O ATP também é necessário para os sistemas responsáveis pela eliminação de depósitos patológicos, incluindo placas beta-amiloides no cérebro que são características da doença de Alzheimer (Zattoni et al. 2022; Colini Baldeschi et al. 2022). Assim, as sequelas neurológicas de longo prazo da infecção por SARS-CoV-2 podem envolver infecção viral direta das mitocôndrias. Alternativamente, a infecção por vírus pode ter um impacto indireto nesta organela por meio de um mecanismo que resulta em comprometimento de longo prazo e incapacidade de realizar suas atividades biológicas. Os resultados de um estudo recente de modelagem computacional revelaram enriquecimento localizado de sequências genômicas e subgenômicas do SARS-CoV-2, principalmente sequências de RNA não traduzidas 5′ e 3′, dentro de uma matriz mitocondrial da célula hospedeira, bem como em estruturas nucleolares. A possibilidade de que o material genético do SARS-CoV-2 possa residir nas mitocôndrias do hospedeiro e potencialmente se integrar ao genoma mitocondrial do hospedeiro sugere que esse vírus pode ter acesso direto ao centro metabólico da célula e subverter o sistema metabólico do hospedeiro para condições favoráveis ao crescimento e replicação do vírus (Stefano et al. 2021; Stefano e Kream 2022a; Singh et al. 2020). Um mecanismo envolvendo o controle viral do metabolismo mitocondrial também pode ser responsável pela disfunção neurológica de longo prazo que frequentemente resulta da infecção pelo SARS-CoV-2. A infecção da microglia pode levar ao comprometimento da aptidão metabólica e, portanto, à redução da autofagia e do suporte metabólico de funções básicas, como a eliminação de placas e depósitos patológicos. A longo prazo, a disfunção microglial associada ao vírus pode levar ao declínio neurocognitivo, que está entre os conceitos emergentes na fisiopatologia da doença de Alzheimer (Ulland et al. 2017; Stefano et al. 2020). É importante reconhecer que o sequestro viral da função metabólica celular não é exclusivo do SARS-CoV-2 ou mesmo dos coronavírus. Esse mecanismo foi proposto para explicar as sequelas de outras infecções virais, incluindo Ebola, Zika e influenza A (Dutta et al. 2020). Nossa hipótese é que a disfunção mitocondrial também pode contribuir para a patogênese de doenças priônicas.
Em uma análise detalhada publicada recentemente da fase pós-aguda da COVID-19, Xu e colegas (Xu et al. 2022) documentaram que indivíduos que se recuperaram desta doença estavam em risco aumentado de inúmeras sequelas neurológicas, incluindo acidente vascular cerebral isquêmico e hemorrágico, distúrbios cognitivos e de memória, distúrbios do sistema nervoso periférico, distúrbios episódicos (por exemplo, enxaqueca e convulsões), distúrbios extrapiramidais e de movimento, distúrbios de saúde mental, distúrbios musculoesqueléticos, distúrbios sensoriais, síndrome de Guillain-Barré e encefalite/encefalopatia, incluindo aqueles que não necessitaram de hospitalização por doença aguda (Xu et al. 2022). Tomados em conjunto, esses achados fornecem evidências de um risco aumentado de distúrbios neurológicos de longo prazo em associação com a COVID-19.
Em um relatório recente, a estimativa dos níveis de células eucarióticas e bacterianas humanas foi determinada como sendo a mesma (aproximadamente 10 13), o que ocorre na mesma concentração observada para vírus em igualar a concentração bacteriana total (Liang e Bushman 2021; Shkoporov e Hill 2019). Considerando a origem procariótica das mitocôndrias e que as células eucarióticas têm o potencial de abrigar milhares dessas organelas basicamente distintas, pode-se supor que a “célula mais avançada” é altamente dependente de entidades que evoluíram muito antes na evolução. Assim, a natureza simultânea e interativa da evolução envolvendo essas entidades surge como componentes mais complexos e diversos da vida de uma célula eucariótica. Portanto, fatores que modificam e/ou inibem a comunicação normal bacteriana e viral do “hospedeiro” também modificariam os processos celulares eucarióticos, contribuindo para a disfunção de um organismo. Isso também explicaria o impacto negativo de micróbios não indígenas. Além disso, uma vez que vírus, bactérias e células eucarióticas, em parte, comunicam e direcionam a síntese de proteínas para executar suas estratégias reprodutivas associadas para a existência, essas proteínas por acaso poderiam direcionar sua própria síntese, ou seja, ignorar a necessidade de direção de ácido nucleico, por exemplo, príons. Especulamos que o príon representa um passo em falso na evolução, dado o potencial das proteínas de mudar de forma e sua aparência espontânea sob estresse celular e estabilidade para transferência interorganísmica e, portanto, emergência como entidades patológicas.
Conclusão
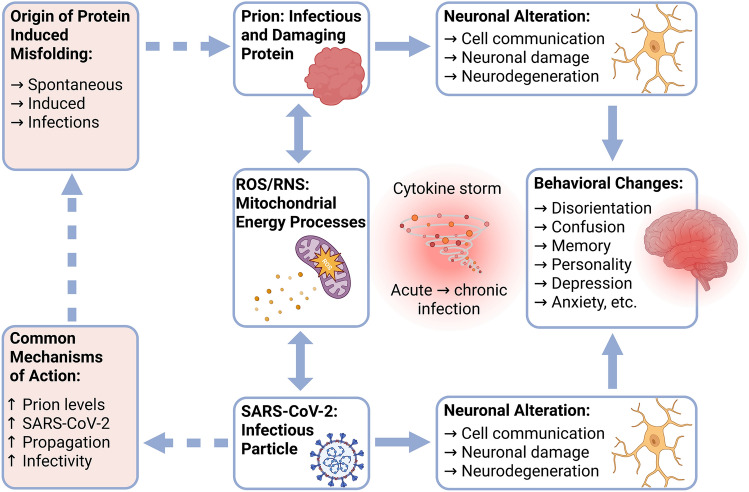
Vários vírus e infecções virais podem induzir disfunção mitocondrial. Assim, levantamos a hipótese de que a disfunção dessa organela derivada de bactérias é um componente crítico de muitos desses distúrbios. Propusemos que esse mecanismo está diretamente relacionado à origem bacteriana dessa organela em um momento da história evolutiva que apresentou altas taxas de interação entre vírus e bactérias, com cada um servindo como alvo primário um do outro. O trabalho atual sugere que há uma ligação entre as sequelas fisiopatológicas da infecção por SARS-CoV-2 e a patogênese das doenças por príons. Especificamente, o SARS-CoV-2 contribui para o resultado patológico de longo prazo da doença por príons, ou seja, neurodegeneração. Aqui, propomos um mecanismo no qual o SARS-CoV-2 tem como alvo as mitocôndrias e promove sua disfunção. Da mesma forma, a superprodução de ROS mediada pelo SARS-CoV-2 pode levar ao dobramento incorreto de proteínas príons que podem então se propagar neste ambiente, acelerando assim o desenvolvimento de patologias de longo prazo (Zhou et al. 2022; Yardeni et al. 2019) (Fig. 1). Observamos que certos tecidos podem ser mais suscetíveis a esse mecanismo, o que pode mascarar a verdadeira origem da doença. Nesse sentido, levantamos a hipótese de que doenças que foram atribuídas à síndrome conhecida como COVID-19 de longa duração podem, na verdade, se originar, em parte, da produção espontânea de príons. Observamos que, embora os distúrbios de príons totalmente desenvolvidos sejam universalmente fatais, proteínas mal dobradas que se acumulam em resposta à infecção por SARS-CoV-2 podem provavelmente ser eliminadas após um breve atraso. Em contraste, na ausência de outro desafio imunológico, os mecanismos de eliminação são severamente sobrecarregados no cenário de doença de príons totalmente desenvolvida. Simplificando, a infecção por vírus altera o processo pelo qual os príons se reproduzem. Embora o SARS-CoV-2 ainda não tenha sido amplamente localizado no SNC, seus danos foram associados à infecção (Douaud et al. 2022; Stein et al. 2022). Esse fenômeno merece atenção adicional, dadas as semelhanças clínicas exibidas pela COVID-19 de longa duração e doenças de príons.
Fonte: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10047479/