Seung-Won Jung, Jae Joon Jeon, You Hyun Kim, Sung Jay Choe e Solam Lee
Resumo
A associação de longo prazo entre a vacinação contra a doença do coronavírus 2019 (COVID-19) baseada em mRNA e o desenvolvimento de doenças autoimunes do tecido conjuntivo (AI-CTDs) permanece obscura. Neste estudo de coorte nacional de base populacional envolvendo 9.258.803 indivíduos, pretendemos determinar se a incidência de AI-CTDs está associada à vacinação de mRNA. O estudo abrange mais de 1 ano de observação e analisa ainda mais o risco de AI-CTDs estratificando dados demográficos e perfis de vacinação e tratando a vacinação de reforço como covariável variável no tempo. Relatamos que o risco de desenvolver a maioria das AI-CTDs não aumentou após a vacinação de mRNA, exceto para lúpus eritematoso sistêmico com um risco de 1,16 vezes em indivíduos vacinados em relação aos controles. Resultados comparáveis foram relatados nas análises estratificadas para idade, sexo, tipo de vacina de mRNA e histórico anterior de vacinação não mRNA. No entanto, uma vacinação de reforço foi associada a um risco aumentado de alguns AI-CTDs, incluindo alopecia areata, psoríase e artrite reumatoide. No geral, concluímos que as vacinações baseadas em mRNA não estão associadas a um risco aumentado da maioria dos AI-CTDs, embora mais pesquisas sejam necessárias sobre sua potencial associação com certas condições.
Introdução
A infecção pelo coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2) resulta no desenvolvimento da doença do coronavírus 2019 (COVID-19) e se espalhou globalmente desde 2020. A COVID-19 surgiu como uma pandemia notável, causando um fardo substancial à saúde pública, já que > 50% da população mundial foi infectada, de acordo com uma pesquisa global de soroprevalência de 2022.
Logo após o surto de COVID-19, as vacinas surgiram como uma intervenção crucial para lidar com a pandemia. Essas vacinas foram desenvolvidas principalmente por duas principais plataformas tecnológicas que replicam vetores adenovirais incompetentes e mRNA. Em particular, embora a eficácia da vacina diminua ao longo do tempo e como variantes do vírus, como Omicron, as vacinas de COVID-19 baseadas em mRNA mostram eficácia geralmente significativa, prevenindo 46–92% das infecções por SARS-CoV-2, 74–87% das hospitalizações e 62–92% das doenças graves, conforme definido pelos critérios do National Institutes of Health. Além disso, pesquisas clínicas recentes ou revisões sistemáticas sobre vacinas de mRNA para COVID-19 confirmaram seus perfis de segurança geralmente favoráveis.
Embora a vacina contra a COVID-19 tenha desempenhado um papel crucial no combate à pandemia, a vacina de mRNA contra a COVID-19 também está associada a eventos adversos, notadamente complicações cardíacas, como miocardite e pericardite. Em particular, a associação potencial entre a vacina de mRNA contra a COVID-19 e doenças autoimunes do tecido conjuntivo (AI-CTDs) tem sido ativamente estudada. Algumas doenças autoimunes sistêmicas, como hepatite autoimune e nefropatias, foram identificadas como potencialmente associadas às vacinas de mRNA. Embora estudos anteriores tenham sugerido uma associação entre vacinas de mRNA e várias doenças autoimunes sistêmicas, há estudos limitados que demonstram o desenvolvimento de AI-CTDs após a vacinação de mRNA em grandes populações ao longo de um período de > 1 ano, apesar da baixa incidência e do desenvolvimento lento de AI-CTDs. Essas incertezas e efeitos adversos das vacinas de mRNA aumentaram o ceticismo público em relação à vacinação e exigiram uma análise de risco-benefício da vacinação.
Neste estudo, pretendemos determinar se a incidência de DTA-IA está associada à vacinação de mRNA contra SARS-CoV2.
Resultados
População do estudo
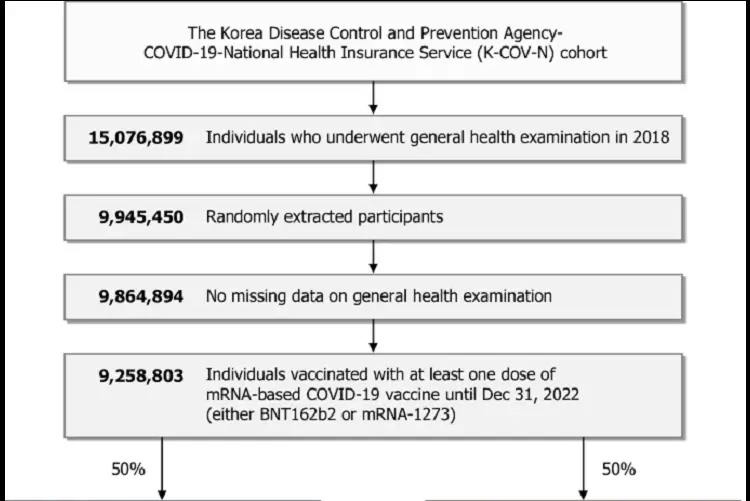
A coorte primária foi estabelecida pela combinação dos bancos de dados do National Health Insurance Service (NHIS) e da Korea Disease Control and Prevention Agency (KDCA), que compreendiam os dados de saúde de > 99% de toda a população coreana e seus perfis de diagnóstico e vacinação contra a COVID-19. No total, 9.258.803 indivíduos que receberam pelo menos uma dose da vacina contra a COVID-19 baseada em mRNA foram incluídos (Fig. 1). Como as vacinas contra a COVID-19 foram administradas em todo o país na Coreia do Sul, a proporção de indivíduos não vacinados foi mínima. Portanto, o uso de indivíduos não vacinados como comparadores pode ter resultado em seleção inadequada da coorte e potencial viés de seleção. Consequentemente, estabelecemos uma coorte de controle histórico dentro de indivíduos vacinados com mRNA, mas o período observacional foi deslocado para trás 2 anos a partir da data da primeira dose da vacinação com mRNA da coorte de controle histórico. No total, 4.445.333 e 4.444.932 pacientes foram incluídos nas coortes de vacinação e controle histórico, respectivamente, e todos foram observados por ≥ 1 ano. As características demográficas e de saúde geral de base de cada coorte estão resumidas na Tabela 1. As covariáveis foram bem balanceadas após a ponderação da probabilidade inversa do tratamento (IPTW). Os perfis de vacinação da COVID-19, como o tipo de vacina de mRNA ou histórico de vacinação não mRNA, estão resumidos na Tabela Suplementar 1. Os tempos médios de acompanhamento para as coortes de vacinação e controle histórico foram de 471,24 ± 66,16 dias e 471,28 ± 66,15 dias, respectivamente.
Fig. 1: Fluxograma de seleção da população do estudo.
Doenças autoimunes do tecido conjuntivo após vacinação com mRNA
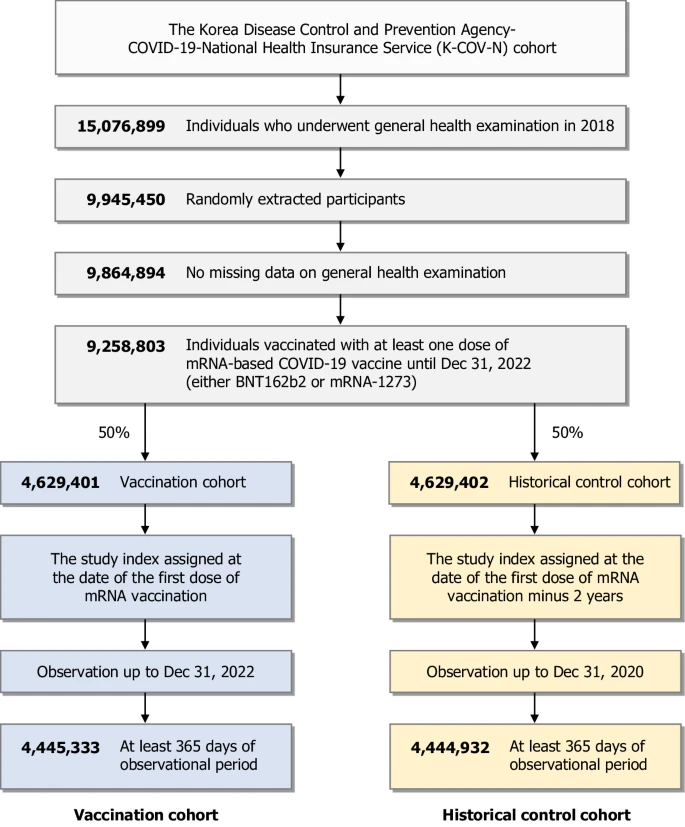
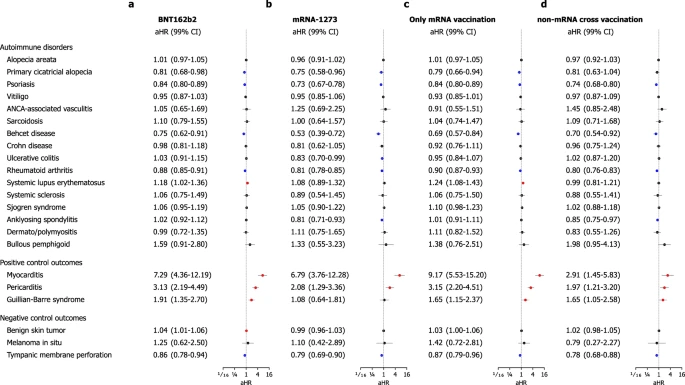
Os gráficos de incidência cumulativa para os AI-CTDs são mostrados na Fig. 2, com a Fig. Suplementar 1 fornecendo detalhes adicionais, incluindo incidência cumulativa para resultados de controle positivo e negativo, bem como o número cumulativo de eventos para cada ponto de tempo. Os riscos de desenvolver AI-CTDs incidentes nas coortes de vacinação e controle histórico são mostrados na Fig. 3. Para mitigar o risco de erro tipo I induzido por múltiplas comparações, empregamos uma correção de Bonferroni para 27 resultados predefinidos e usamos um intervalo de confiança ajustado de 99,81% (IC de 99%) para determinar a significância estatística. Indivíduos que receberam a vacina de mRNA contra a COVID-19 não apresentaram maiores riscos de desenvolver a maioria das DTA-IA, como alopecia areata (razão de risco ajustada [aHR], 1,00; IC de 99%, 0,96–1,04), alopecia total (aHR, 0,79; IC de 99%, 0,68–0,93), psoríase (aHR, 0,80; IC de 99%, 0,77–0,84), vitiligo (aHR, 0,95; IC de 99%, 0,88–1,02), vasculite associada ao anticorpo anticitoplasma de neutrófilos (ANCA) (aHR, 1,09; IC de 99%, 0,72–1,66), sarcoidose (aHR, 1,06; IC de 99%, 0,78–1,44), doença de Behçet (aHR, 0,69; IC de 99%, 0,58–0,82), doença de Crohn (aHR, 0,92; IC de 99%, 0,77–1,09), retocolite ulcerativa (aHR, 0,97; IC de 99%, 0,87–1,08), artrite reumatoide (aHR, 0,86; IC de 99%, 0,84–0,89), esclerose sistêmica (aHR, 1,01; IC de 99%, 0,73–1,38), síndrome de Sjögren (aHR, 1,07; IC de 99%, 0,96–1,18), espondilite anquilosante (aHR, 0,95; IC de 99%, 0,87–1,04), dermato/polimiosite (aHR, 1,02; IC de 99%, 0,77–1,35) e penfigoide bolhoso (BP) (aHR, 1,53; IC de 99%, 0,90–2,60). No entanto, os indivíduos na coorte de vacinação de mRNA apresentaram risco consideravelmente maior de desenvolver lúpus eritematoso sistêmico (LES) (aHR, 1,16; IC de 99%, 1,02–1,32) do que aqueles na coorte de controle histórico.
Fig. 2: Incidências cumulativas de resultados de doenças autoimunes do tecido conjuntivo.
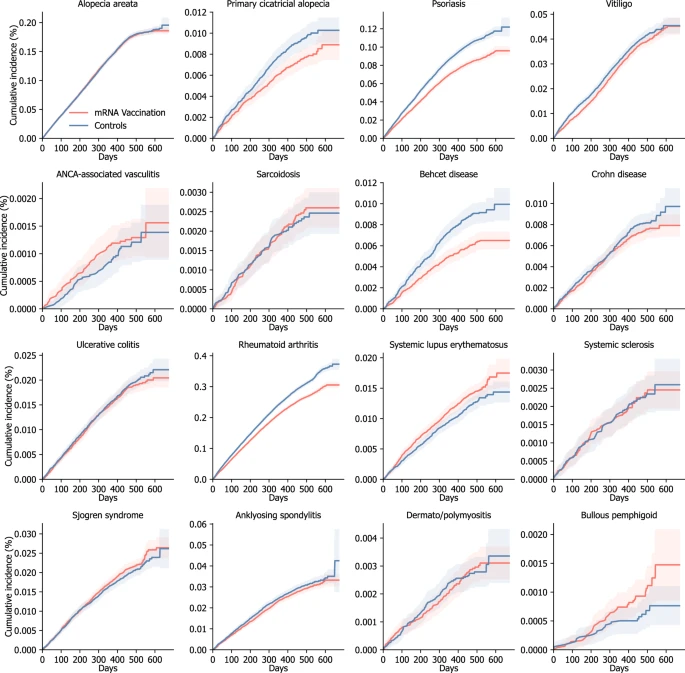
Fig. 3: Riscos de doenças autoimunes incidentes da pele e do tecido conjuntivo na coorte de vacinação contra COVID-19 baseada em mRNA em comparação com a coorte de controle histórica.
Validação dos resultados usando resultados de controle positivo e negativo
Para validar essas descobertas, avaliamos os riscos de resultados de controle positivo e negativo associados à vacinação de mRNA. Para os resultados de controle positivo, o risco de miocardite (aHR, 7,20; IC de 99%, 4,37–11,86), pericardite (aHR, 2,75; IC de 99%, 1,95–3,88) e síndrome de Guillain–Barré (aHR, 1,62; IC de 99%, 1,16–2,25) foi consideravelmente maior na coorte de vacinação do que na coorte de controle histórico (Fig. 3). Por outro lado, o risco de ter resultados de controle negativos não foi consideravelmente maior na coorte de vacinação do que na coorte de controle histórico (tumor benigno de pele (aHR, 1,02; IC de 99%, 1,00–1,05), melanoma in situ (aHR, 1,21; IC de 99%, 0,64–2,29) e perfuração da membrana timpânica (aHR, 0,84; IC de 99%, 0,77–0,91)).
Análise estratificada por sexo, idade e perfil vacinal
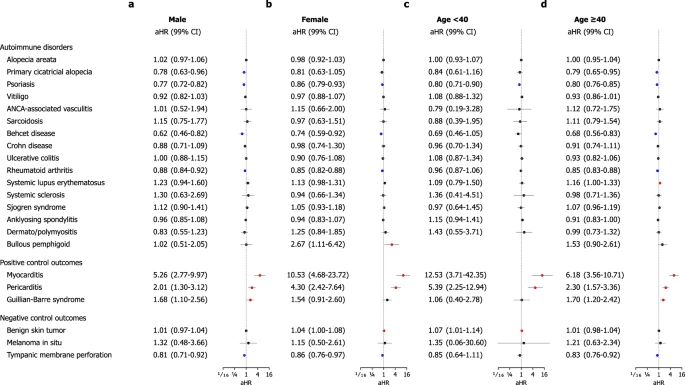
Em análises de subgrupos, comparamos as coortes de vacinação e controle histórico estratificadas por sexo, idade (< 40 vs. ≥ 40), tipo de vacina COVID-19 baseada em mRNA (BNT162b2, Pfizer–BioNTech vs. mRNA-1273, Moderna), status de vacinação cruzada com qualquer histórico de vacinação COVID não-mRNA (ChAdOx1 nCoV-19 [AZD1222], Oxford–AstraZeneca ou Ad26.COV2.S, Janssen–Johnson & Johnson, ou outros) antes da vacinação de mRNA, e qualquer histórico de diagnóstico de COVID-19. Em geral, não houve diferenças significativas entre as duas coortes nas análises de subgrupos para a maioria dos resultados (Figs. 4 – 5), com as Figs. Suplementares 2 – 11 fornecendo detalhes adicionais para cada análise estratificada. No entanto, mulheres que receberam a vacina de mRNA tiveram um risco significativamente maior de desenvolver BP (aHR, 2,67; IC de 99%, 1,11–6,42) (Fig. 4 a, b). Além disso, com idade ≥ 40 anos que foram submetidas à vacinação de mRNA tenderam a ter um risco maior de desenvolver BP (aHR, 1,53; IC de 99%, 0,90–2,61) (Fig. 4 c, d). Na análise estratificada com base no tipo de vacina de mRNA recebida, indivíduos que receberam a vacina BNT162b2 tiveram um risco significativamente maior de desenvolver LES (aHR, 1,18; IC de 99%, 1,02–1,36) (Fig. 5 a, b). Além disso, a vacinação cruzada com vacinas não mRNA não afetou independentemente o risco incidente de quaisquer DTA-IA (Fig. 5 c, d). Nas análises de acordo com o status do diagnóstico de COVID-19, a incidência não foi maior para quase todos os AI-CTDs, exceto LES em indivíduos com diagnóstico de COVID-19 (aHR, 1,23; IC de 99%, 1,05–1,44) (Figs. Suplementares 6 e 7).
Fig. 4: Análises estratificadas dos riscos de distúrbios autoimunes do tecido conjuntivo incidentes na coorte de vacinação contra COVID-19 baseada em mRNA em comparação com a coorte de controle histórico de acordo com sexo e idade.
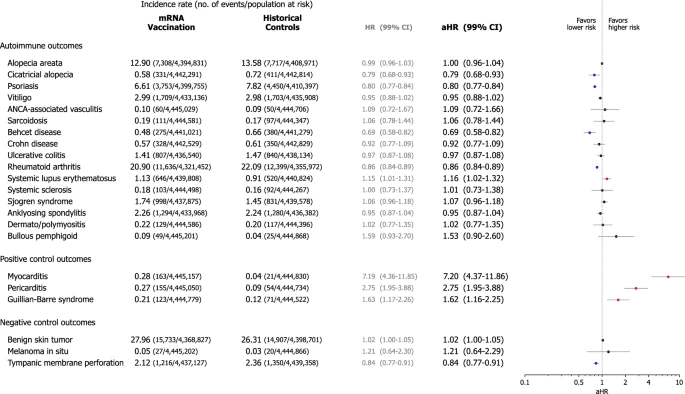
Fig. 5: Análises estratificadas da incidência de distúrbios autoimunes do tecido conjuntivo na coorte de vacinação contra COVID-19 baseada em mRNA em comparação com a coorte de controle histórica de acordo com o tipo de vacina de mRNA e o histórico de vacinação cruzada com vacinação sem mRNA antes do índice do estudo.
Vacinação de reforço
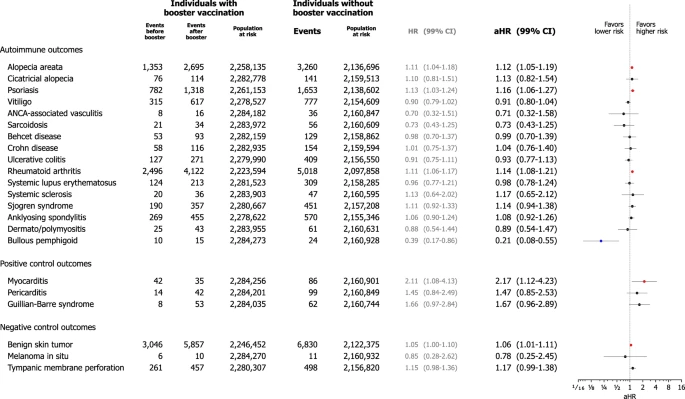
No total, 2.284.342 indivíduos receberam a vacinação de reforço de mRNA (3ª dose de vacinação de mRNA) entre a coorte de vacinação. Em análises de risco proporcional de Cox estendidas tratando a vacinação de reforço como covariável de variação temporal, o risco de alopecia areata (aHR, 1,12; IC de 99%, 1,05–1,19), psoríase (aHR, 1,16; IC de 99%, 1,06–1,27) e artrite reumatoide (aHR, 1,14; IC de 99%, 1,08–1,21) foi maior em indivíduos que receberam a vacinação de reforço em comparação com aqueles que não receberam (Fig. 6).
Fig. 6: Riscos de doenças autoimunes do tecido conjuntivo incidentes na coorte de vacinação contra COVID-19 baseada em mRNA de acordo com histórico prévio de vacinação de reforço.
Discussão
BNT162b2 e mRNA-1273 foram as primeiras vacinas de mRNA aprovadas pela Food and Drug Administration (FDA) dos EUA para combater a COVID-19. Embora estudos anteriores tenham sugerido que as vacinações sem mRNA ou infecções por COVID-19 aumentam o risco de pacientes desenvolverem doenças autoimunes, os dados sobre os efeitos de longo prazo da administração da vacina de mRNA em AI-CTDs são escassos. Nosso estudo investigou o efeito da vacinação de mRNA na ocorrência de AI-CTDs observando pelo menos um período de 1 ano em um cenário populacional nacional compreendendo mais de 8 milhões de indivíduos. Nesta análise, a incidência da maioria dos AI-CTDs não foi associada à vacinação de mRNA. No entanto, observamos um risco aumentado de desenvolver alguns AI-CTDs após a vacinação de reforço.
Não relatamos anteriormente nenhuma diferença significativa no risco de desenvolver AI-CTDs entre o grupo de vacinação de mRNA e o grupo de controle histórico em um acompanhamento médio de 100 dias. Nossos resultados foram geralmente alinhados com o estudo anterior, mas encontramos algumas lacunas em um risco aumentado de alguns AI-CTDs, incluindo LES. Isso pode ser atribuído a diferenças nas características demográficas da população do estudo e períodos observacionais entre os estudos. Dado o curso indolente de AI-CTDs, esses resultados sugerem que a vigilância de longo prazo para o desenvolvimento de AI-CTDs após a vacinação de mRNA pode ser justificada.
Embora a associação entre vacinação de mRNA e LES permaneça obscura, houve casos em que LES se desenvolveu após vacinação de mRNA. A vacinação de mRNA supostamente leva a níveis elevados de anticorpos anti-dsDNA no plasma, e o auto-DNA extracelular influencia a patogênese de AI-CTDs, incluindo LES. Outro estudo descobriu que as vacinações de reforço aumentam o DNA livre de células circulante em células B, células T e monócitos. Além disso, o risco observado de LES variou de acordo com o tipo de vacina de mRNA e o histórico de vacinação não-mRNA. Mais estudos são necessários para elucidar se fatores como a dose de mRNA podem contribuir para essas diferenças.
A associação entre BP e vacinação de mRNA ainda precisa ser esclarecida, no entanto, a população feminina vacinada mostra um risco 2,67 vezes maior de desenvolvimento de BP do que a população feminina não vacinada na análise de subgrupo estratificada por sexo. A série de casos dos EUA de erupções bolhosas subepidérmicas (incluindo BP) após a vacinação de mRNA relatou que é mais comum em mulheres e após os 40 anos. Da mesma forma, nosso estudo tendeu a um risco maior de BP em mulheres e em pacientes com mais de 40 anos de idade após a vacinação de mRNA do que em controles históricos. Este resultado pode sugerir a necessidade de monitorar o desenvolvimento de BP em mulheres que receberam vacinas baseadas em mRNA.
Além disso, nosso estudo descobriu que a vacinação de reforço foi associada a um risco aumentado de desenvolver certos AI-CTDs, como alopecia areata, psoríase e artrite reumatoide, embora o tamanho do efeito tenha sido pequeno. Essa descoberta pode estar associada a surtos autoimunes após a vacinação repetida de mRNA, o que pode fazer com que doenças subclínicas se tornem ativas e diagnosticadas. O resultado do nosso estudo pode indicar a necessidade de monitoramento adicional ao administrar vacinas de reforço. No entanto, deve ser interpretado com cautela devido ao potencial efeito saudável da vacina. Além disso, as vacinas de reforço mostraram segurança substancial e benefícios potenciais de melhorar a resposta imune humoral, prevenindo o diagnóstico de COVID-19 ou reduzindo a gravidade da doença. Além disso, uma dose adicional da vacina pode servir como uma estratégia para abordar a limitação de sua eficácia decrescente ao longo do tempo. Portanto, nossos resultados não são suficientes para desencorajar a vacinação de reforço e sugerem que o monitoramento regular e de longo prazo pode ser necessário para garantir a detecção precoce e o gerenciamento de quaisquer riscos emergentes associados a vacinações repetidas.
Este estudo tem vários pontos fortes. Primeiro, usamos os dados médicos nacionais de ~ 10 milhões de pessoas e informações nacionais sobre perfis de infecção e vacinação por COVID-19. Segundo, o risco de AI-CTDs incidentes foi medido com um grande tamanho de amostra e um período de observação mais longo, mais do que o período médio de acompanhamento de 471 dias, do que o usado em estudos anteriores. Terceiro, projetamos uma coorte de controle histórico para minimizar o viés de seleção e examinamos a confiabilidade da análise avaliando controles de resultados positivos e negativos. Quarto, consideramos vários fatores de confusão, como sexo, idade, tipo de vacina de mRNA, vacinação cruzada e status de diagnóstico de COVID-19 para considerar seus impactos potenciais e projetamos uma análise tratando a vacinação de reforço como uma covariável variável no tempo para explicar sua variabilidade durante a observação.
No entanto, este estudo tem algumas limitações. Primeiro, a análise foi conduzida em indivíduos pertencentes a um único grupo étnico. Como os polimorfismos de nucleotídeo único associados a doenças autoimunes variam de acordo com a etnia, nossos resultados podem não ser generalizáveis para outras populações. Segundo, embora nosso estudo tenha um dos períodos de acompanhamento mais longos entre os estudos de vacinas de mRNA relatados até o momento, essa duração ainda pode ser considerada muito curta, dado que o desenvolvimento de AI-CTDs pode levar anos a décadas após a exposição ao gatilho. Além disso, o período de observação de 2 anos antes da data do índice pode não ter sido longo o suficiente para identificar AI-CTDs preexistentes devido ao seu início indolente. Portanto, alguns casos incidentes neste estudo podem ter tido seu início antes da observação. Terceiro, considerando o declínio global no uso de serviços de saúde durante a pandemia de COVID-19, alguns resultados de interesse podem ter sido subdiagnosticados durante este período. No entanto, investigamos resultados de controle negativo para abordar essas preocupações. Quarto, casos potencialmente classificados incorretamente relacionados ao uso de dados de reivindicação do código CID-10 poderiam existir em nosso estudo. Para mitigar esse risco, consideramos pacientes com três ou mais visitas sob o mesmo código CID-10 como tendo AI-CTDs.
Em conclusão, os resultados do nosso estudo sugerem que a vacinação de mRNA geralmente não está associada a um risco maior da maioria dos AI-CTDs. No entanto, dado que o risco de LES e BP foi aumentado em certas condições demográficas, como idade e sexo, o monitoramento de longo prazo é necessário após a vacinação de mRNA para o desenvolvimento de AI-CTDs. Nossos resultados podem fornecer insights clínicos sobre a terapêutica de mRNA, e mais pesquisas são necessárias sobre a associação entre vacinas baseadas em mRNA e AI-CTDs.
Métodos
Fonte de dados
Este estudo de coorte populacional nacional foi conduzido usando dados da coorte KDCA COVID-19 NHIS (K-COV-N). O banco de dados do NHIS forneceu dados abrangentes consistindo em dados demográficos, dados de elegibilidade de seguro (tipo de seguro e área de residência), status socioeconômico (nível de renda), registros de saúde de internação e ambulatorial (diagnósticos e procedimentos de doenças), prescrições e resultados de exames nacionais de saúde (uso de álcool e tabagismo) de > 99% da população total da Coreia do Sul. A doença subjacente de uma população foi confirmada quando essa doença foi identificada em ≥ 3 visitas de internação ou ambulatorial usando os códigos de diagnóstico correspondentes da Classificação Internacional de Doenças, Décima Revisão (CID-10). Os códigos CID-10 correspondentes para as doenças subjacentes estão resumidos na Tabela Suplementar 2 . Registros médicos que podem identificar histórico médico anterior antes da data índice e eventos incidentes durante o período de observação estão disponíveis desde 1º de janeiro de 2016. O governo sul-coreano gerencia o registro NHIS COVID-19, e o KDCA fornece dados sobre a vacina COVID-19, como o tipo, a dose e a data da vacinação. Este estudo foi aprovado pelo Instituto Nacional Coreano de Política de Bioética, e o número de pesquisa para este estudo foi KDCA-NHIS-2023-1-500.
População do estudo
No banco de dados do NHIS, 15.076.899 indivíduos, aproximadamente 30% da população total da Coreia do Sul, foram submetidos a um exame geral de saúde em 2018. De acordo com os regulamentos do provedor de dados, fomos obrigados a limitar nossa população de estudo a 10 milhões devido a restrições de privacidade e capacidade de dados. Consequentemente, selecionamos aleatoriamente 9.945.450 participantes, aproximadamente 20% da população total da Coreia do Sul. Após excluir indivíduos com relatórios de exame geral de saúde incompletos, 9.258.803 indivíduos vacinados com pelo menos uma dose da vacina COVID-19 baseada em mRNA (BNT162b2 ou mRNA-1273) até 31 de dezembro de 2022 foram selecionados. Posteriormente, extraímos metade da coorte primária para estabelecer a coorte de vacinação, cujo índice foi a data de administração da primeira dose da vacina COVID-19 baseada em mRNA. Como a vacinação contra a COVID-19 foi conduzida em todo o país na Coreia do Sul, em outubro de 2022, a taxa geral de cobertura vacinal entre adultos que atendiam aos requisitos para a série primária de cada vacina contra a COVID-19 introduzida na Coreia do Sul era de 96,6%. Portanto, usar indivíduos não vacinados como controles para comparação poderia ter levado à seleção de coorte inadequada e potencial viés de seleção. Em vez disso, nosso estudo usa controles históricos como comparadores. A outra metade da coorte primária foi usada para formar coortes de controle histórico, enquanto o período observacional do grupo de controle foi deslocado para trás em 2 anos a partir da data da primeira dose de vacinação de mRNA dos indivíduos. Os dois grupos de coorte foram acompanhados da respectiva data do índice do estudo até o diagnóstico da doença, emigração, morte ou o fim do período do estudo. O grupo de vacinação foi observado até 31 de dezembro de 2022, e o grupo de coorte histórico até 31 de dezembro de 2020.
Resultados
Avaliamos a incidência e o risco de desenvolver AI-CTDs associados à vacina COVID-19 baseada em mRNA durante o período de acompanhamento, restringindo a população do estudo a pacientes sem histórico dos respectivos resultados antes da data do índice do estudo. A ocorrência de cada doença de resultado foi definida quando essa doença foi identificada em ≥ 3 visitas ambulatoriais ou hospitalares usando os códigos de diagnóstico CID-10 correspondentes. Estabelecemos e avaliamos três resultados de controle positivo (miocardite, pericardite e síndrome de Guillain-Barré), que são relatados como significativamente associados à vacina COVID-19, bem como resultados de controle negativo (tumor benigno de pele, melanoma in situ e perfuração da membrana timpânica), que são menos propensos a serem associados à vacina COVID-19, para garantir a validade do nosso estudo. Os códigos CID-10 correspondentes de doenças autoimunes do tecido conjuntivo e resultados de controle positivo e negativo predefinidos estão resumidos na Tabela Suplementar 2.
Covariáveis
Embora tanto a vacinação quanto as coortes de controle histórico tenham sido derivadas da mesma coorte primária, pode haver diferenças residuais nas características basais que foram potencialmente vinculadas à ocorrência de desfechos de doenças. Portanto, consideramos covariáveis predefinidas, incluindo dados demográficos e status socioeconômico, como idade, sexo, tipo de seguro (padrão vs Medicaid), nível de renda (dividido em quartis com base nos prêmios de seguro saúde), área de residência (área urbana vs rural) e dados gerais de exame de saúde mencionados anteriormente. Nos dados gerais de exame de saúde, estabelecemos o status atual de tabagismo e definimos o consumo de álcool como consumo rotineiro de álcool, independentemente da quantidade ou frequência. Além disso, definimos várias doenças crônicas como covariáveis predefinidas e listamos seus códigos CID-10 correspondentes na Tabela Suplementar 2. As covariáveis foram balanceadas entre as duas coortes usando IPTW.
Análise estatística
As características demográficas basais são apresentadas como médias com desvios-padrão e frequências com porcentagens, dependendo dos tipos de variáveis. Os escores de propensão para indivíduos foram estimados com base em covariáveis predefinidas que representam a possibilidade de pertencer à coorte de vacinação. Esses escores foram usados para calcular a probabilidade inversa dos pesos do tratamento, obtidos pela divisão da probabilidade de pertencer à coorte de vacinação por 1 menos a probabilidade de estar na coorte de vacinação: a probabilidade de pertencer à coorte de vacinação / (1–a probabilidade de estar na coorte de vacinação). O equilíbrio de covariáveis foi avaliado usando diferenças médias padronizadas antes e depois da aplicação dos IPTWs. Posteriormente, o risco de resultados predefinidos na coorte de vacinação foi estimado e comparado com o da coorte de controle histórico. A análise estatística envolveu análise de riscos proporcionais de Cox multivariável após ajuste para todas as covariáveis predefinidas usadas para calcular os IPTWs. Cada análise para resultados incluiu apenas a população em risco, excluindo aqueles que já haviam sido diagnosticados com o resultado alvo na data do índice ou antes. Análises de subgrupos estratificados foram conduzidas de acordo com sexo, idade (< 40 vs ≥ 40), tipo de vacina COVID-19 baseada em mRNA (BNT162b2 vs mRNA-1273), histórico de ter uma vacina COVID não-mRNA, como a vacina de vetor viral (ChAdOx1 nCoV-19 (AZD1222) ou Ad26.COV2.S) antes da vacinação de mRNA, e se a COVID-19 foi diagnosticada ou não. Também buscamos verificar melhor o impacto da vacinação de reforço, definida pela administração da 3ª dose adicional da vacina baseada em mRNA após a conclusão da série primária de duas doses da mesma vacina baseada em mRNA, na incidência de AI-CTDs. Como o status de vacinação de um indivíduo pode mudar durante a observação, conduzimos análises de risco proporcional de Cox estendidas com a vacinação de reforço como uma covariável variável no tempo. Para minimizar o risco de resultados falsos, como erros do tipo I devido a comparações múltiplas, aplicamos a correção de Bonferroni para 27 resultados predefinidos. Consequentemente, a significância estatística foi determinada com base no intervalo de confiança ajustado para 27 comparações. Todas as análises estatísticas foram conduzidas usando o software estatístico SAS (versão 9.4; SAS Institute, Cary, NC, EUA) e o software estatístico R (versão 3.4.1; R Foundation for Statistical Computing, Viena, Áustria).
Risco de longo prazo de doenças autoimunes após vacinação contra SARS-CoV2 baseada em mRNA em um estudo de coorte populacional coreano de abrangência nacional
Fonte: https://www.nature.com/articles/s41467-024-50656-8?utm_medium=email&utm_source=govdelivery