Resumo gráfico
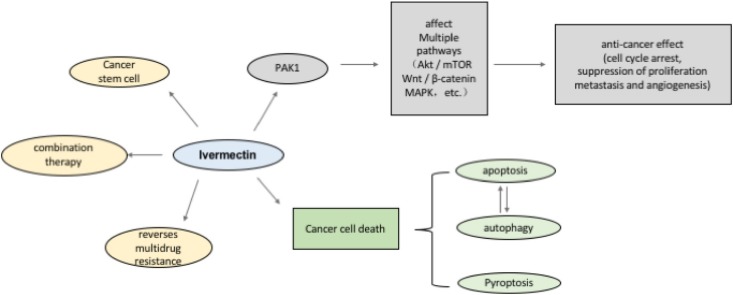
A ivermectina tem efeitos antitumorais poderosos, incluindo a inibição da proliferação, metástase e atividade angiogênica, em uma variedade de células cancerígenas. Isso pode estar relacionado à regulação de múltiplas vias de sinalização pela ivermectina através da cinase PAK1. Por outro lado, a ivermectina promove a morte programada de células cancerígenas, incluindo apoptose, autofagia e piroptose. A ivermectina induz a apoptose e a autofagia é mutuamente regulada. Curiosamente, a ivermectina também pode inibir células-tronco tumorais e reverter a resistência a múltiplos medicamentos e exerce o efeito ideal quando usada em combinação com outros medicamentos quimioterápicos.
Abreviações: ASC, Proteína tipo speck associada à apoptose contendo um CARD; ALCAR, acetil-L-carnitina; CSCs, Células-tronco cancerígenas; DAMP, Padrão molecular associado a danos; EGFR, Receptor do fator de crescimento epidérmico; EBV, vírus Epstein-Barr; EMT, Transição mesenquimal epitelial; GABA, Ácido gama-aminobutírico; GSDMD, Gasdermina D; HBV, vírus da hepatite B; HCV, vírus da hepatite C; HER2, Receptor 2 do fator de crescimento epidérmico humano; HMGB1, Proteína de caixa de grupo de alta mobilidade-1; HSP27, Proteína de choque térmico 27; LD50, dose letal mediana; LDH, Lactato desidrogenase; IVM, Ivermectina; MDR, Resistência a múltiplos medicamentos; NAC, N-acetil-L-cisteína; OCT-4, Proteína de ligação ao octâmero 4; PAK1, cinases ativadas por P-21 1; PAMP, padrão molecular associado a patógenos; PARP, poli (ADP-ribose) polimerase; P-gp, glicoproteína P; PRR, receptor de reconhecimento de padrões; ROS, espécies reativas de oxigênio; STAT3, transdutor de sinal e ativador da transcrição 3; SID, domínio de interação SIN3; siRNA, pequeno RNA interferente; SOX-2, caixa SRY 2; TNBC, câncer de mama triplo negativo; YAP1, proteína 1 associada a Yes
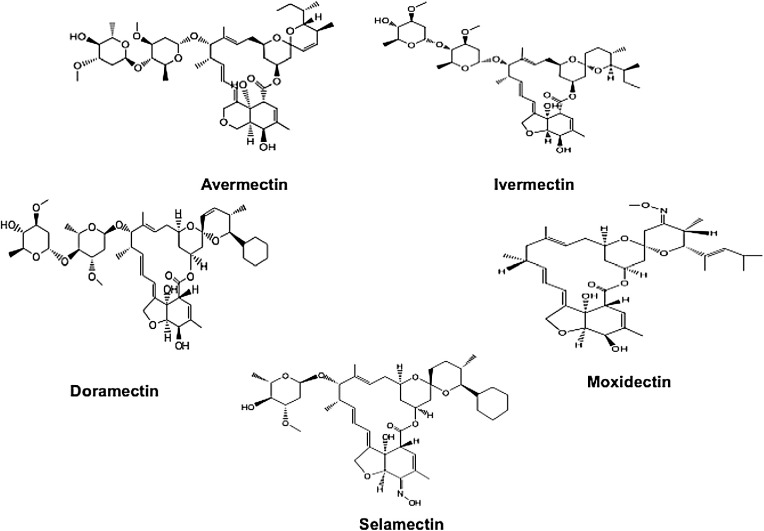
Compostos químicos revisados neste artigo: ivermectina (PubChem CID: 6321424), avermectina (PubChem CID: 6434889), selamectina (PubChem CID: 9578507), doramectina (PubChem CID: 9832750), moxidectina (PubChem CID: 9832912)
Palavras-chave: ivermectina, câncer, reposicionamento de fármacos
Resumo
A ivermectina é um fármaco antiparasitário macrolídeo com um anel de 16 membros que é amplamente utilizado para o tratamento de muitas doenças parasitárias, como oncocercose, elefantíase e sarna. Satoshi ōmura e William C. Campbell ganharam o Prêmio Nobel de Fisiologia ou Medicina de 2015 pela descoberta da excelente eficácia da ivermectina contra doenças parasitárias. Recentemente, foi relatado que a ivermectina inibe a proliferação de várias células tumorais ao regular múltiplas vias de sinalização. Isso sugere que a ivermectina pode ser um fármaco anticâncer com grande potencial. Aqui, revisamos os mecanismos relacionados pelos quais a ivermectina inibiu o desenvolvimento de diferentes tipos de câncer e promoveu a morte celular programada e discutimos as perspectivas para a aplicação clínica da ivermectina como um fármaco anticâncer para terapia de neoplasias.
1. Introdução
A ivermectina (IVM) é um medicamento antiparasitário macrolídeo com um anel de 16 membros derivado da avermectina que é composto de 80% de 22,23-diidroavermectina-B1a e 20% de 22,23-diidroavermectina-B1b. Além da IVM, os atuais membros da família da avermectina incluem selamectina, doramectina e moxidectina (Fig. 1). A IVM é atualmente o medicamento da família da avermectina de maior sucesso e foi aprovada pelo FDA para uso em humanos em 1978. Tem um bom efeito no tratamento de doenças parasitárias, como oncocercose, elefantíase e sarna. Os descobridores do IVM, o cientista japonês Satoshi ōmura e o cientista irlandês William C. Campbell, ganharam o Prêmio Nobel de Fisiologia ou Medicina em 2015. O IVM ativa os canais de cloreto dependentes de glutamato no parasita, causando uma grande quantidade de influxo de íons cloreto e hiperpolarização neuronal, levando assim à liberação de ácido gama-aminobutírico (GABA) para destruir os nervos, e a transmissão nervosa das células musculares induz a paralisia dos músculos somáticos para matar os parasitas. O IVM também demonstrou efeitos benéficos contra outras doenças parasitárias, como malária, tripanossomíase, esquistossomose, triquinose e leishmaniose.
O IVM não só tem efeitos fortes sobre parasitas, mas também tem efeitos antivirais potenciais. O IVM pode inibir a replicação do flavivírus ao atingir a helicase NS3; também bloqueia o transporte nuclear de proteínas virais ao atuar no transporte nuclear mediado por α/β e exerce atividade antiviral contra os vírus HIV-1 e dengue. Estudos recentes também apontaram que ele tem um efeito inibitório promissor sobre o vírus SARS-CoV-2, que causou um surto global em 2020. Além disso, o IVM mostra potencial para aplicação clínica em asma e doenças neurológicas. Recentemente, cientistas descobriram que o IVM tem um forte efeito anticancerígeno.
Desde o primeiro relatório de que a IVM poderia reverter a resistência tumoral a múltiplos fármacos (MDR) em 1996, alguns estudos relevantes enfatizaram o uso potencial da IVM como um novo tratamento contra o câncer.
tratamento. Apesar do grande número de estudos relacionados, ainda existem algumas questões-chave que não foram resolvidas. Em primeiro lugar, o mecanismo específico da citotoxicidade mediada por IVM em células tumorais não está claro; pode estar relacionado ao efeito de IVM em várias vias de sinalização, mas não está muito claro no geral. Em segundo lugar, IVM parece induzir morte celular mista em células tumorais, o que também é uma questão controversa. Portanto, esta revisão resumiu as últimas descobertas sobre o efeito anticâncer de IVM e discutiu o mecanismo de inibição da proliferação tumoral e a maneira como IVM induz morte celular programada por tumor para fornecer uma base teórica para o uso de IVM como um potencial medicamento anticâncer. À medida que o custo da pesquisa e desenvolvimento de novos medicamentos anticâncer continua a aumentar, o reposicionamento de medicamentos se tornou cada vez mais importante. O reposicionamento de medicamentos se refere ao desenvolvimento de novas indicações de medicamentos que foram aprovadas para uso clínico. Para alguns medicamentos mais antigos que são amplamente utilizados para suas indicações originais e têm dados clínicos e informações de segurança, o reposicionamento de medicamentos permite que eles sejam desenvolvidos por meio de um ciclo mais barato e rápido e sejam usados de forma mais eficaz no uso clínico clinicamente. Aqui, resumimos sistematicamente o efeito anticâncer e o mecanismo do IVM, que é de grande importância para o reposicionamento do IVM para tratamento do câncer.
2. O papel do IVM em diferentes tipos de câncer
2.1. Câncer de mama
O câncer de mama é um tumor maligno produzido por mutação genética em células epiteliais da mama causada por múltiplos carcinógenos. A incidência de câncer de mama tem aumentado a cada ano, e se tornou um dos tumores malignos femininos com maior incidência globalmente. Em média, um novo caso é diagnosticado a cada 18 segundos em todo o mundo. Após o tratamento com IVM, a proliferação de múltiplas linhagens de células de câncer de mama, incluindo MCF-7, MDA-MB-231 e MCF-10 foi significativamente reduzida. O mecanismo envolveu a inibição por IVM da via Akt/mTOR para induzir autofagia e a cinase 1 ativada por p-21 (PAK1) foi o alvo de IVM para câncer de mama. Além disso, o estudo de Diao mostrou que a IVM pode inibir a proliferação das linhas celulares de tumor de mama canino CMT7364 e CIPp, bloqueando o ciclo celular sem aumentar a apoptose, e o mecanismo da IVM pode estar relacionado à inibição da via Wnt.
O câncer de mama triplo negativo (TNBC) refere-se ao câncer que é negativo para o receptor de estrogênio, receptor de progesterona e receptor do fator de crescimento epidérmico humano 2 (HER2) e é o subtipo mais agressivo de câncer de mama com o pior prognóstico. Além disso, também não há nenhum medicamento terapêutico clinicamente aplicável atualmente. Um estudo de triagem de medicamentos do TNBC mostrou que o IVM poderia ser usado como um mimetizador do domínio de interação SIN3 (SID) para bloquear seletivamente a interação entre o SID e a hélice α2 pareada. Além disso, o IVM regulou a expressão do gene E-caderina relacionado à transição mesenquimal epitelial (EMT) para restaurar a sensibilidade das células TNBC ao tamoxifeno, o que implica a possibilidade de que o IVM funcione como um regulador epigenético no tratamento do câncer.
Estudos recentes também descobriram que a IVM poderia promover a morte de células tumorais regulando o microambiente tumoral no câncer de mama. Sob a estimulação de um microambiente tumoral com um alto nível de trifosfato de adenosina (ATP) fora das células tumorais, a IVM poderia aumentar a liberação mediada por P2 × 4/ P2 × 7/ Panexina-1 da proteína de caixa de grupo de alta mobilidade-1 (HMGB1). No entanto, a liberação de uma grande quantidade de HMGB1 no ambiente extracelular promoverá a morte imunogênica mediada por células imunes e reações inflamatórias, que terão um efeito inibitório no crescimento de células tumorais. Portanto, acreditamos que o efeito anticâncer da IVM não se limita à citotoxicidade, mas também envolve a regulação do microambiente tumoral. A IVM regula o microambiente tumoral e medeia a morte celular imunogênica, o que pode ser uma nova direção para a pesquisa que explora mecanismos anticâncer no futuro.
2.2. Câncer do sistema digestivo
O câncer gástrico é um dos tumores malignos mais comuns em todo o mundo. No ano passado, mais de um milhão de pacientes com câncer gástrico foram diagnosticados em todo o mundo. O estudo de Nambara mostrou que o IVM poderia inibir significativamente a proliferação de células de câncer gástrico in vivo e in vitro e que o efeito inibitório do IVM dependia da expressão da proteína 1 associada a Yes (YAP1). As linhas de células de câncer gástrico MKN1 e SH-10-TC têm maior expressão de YAP1 do que as células MKN7 e MKN28, então as células MKN1 e SH-10-TC são sensíveis ao IVM, enquanto MKN7 e MKN28 não são sensíveis ao IVM. O YAP1 desempenha um papel oncogênico na tumorigênese, indicando a possibilidade do uso do IVM como um inibidor de YAP1 para tratamento de câncer.
Em um estudo que rastreou inibidores da via Wnt, o IVM inibiu a proliferação de vários cânceres, incluindo as linhagens de células de câncer colorretal CC14, CC36, DLD1 e Ls174 T, e promoveu a apoptose ao bloquear a via Wnt. Após a intervenção com IVM, a expressão da caspase-3 nas células T DLD1 e Ls174 aumentou, indicando que o IVM tem um efeito indutor de apoptose e inibe a expressão dos genes a jusante AXIN2, LGR5 e ASCL2 na via Wnt/β-catenina. No entanto, o alvo molecular exato do IVM que afeta a via Wnt/β-catenina ainda precisa ser explorado.
O carcinoma hepatocelular é a quarta principal causa de morte por câncer no mundo. Aproximadamente 80% dos casos de câncer de fígado são causados por infecção pelo vírus da hepatite B (HBV) e pelo vírus da hepatite C (HCV). O IVM pode inibir o desenvolvimento do carcinoma hepatocelular bloqueando a atividade do YAP1 em camundongos Mob1b -/- com câncer de fígado espontâneo. O colangiocarcinoma é um tumor maligno que se origina no ducto biliar dentro e fora do fígado. O experimento de Intuyod descobriu que o IVM inibiu a proliferação de células de colangiocarcinoma KKU214 de maneira dependente da dose e do tempo. O IVM interrompeu o ciclo celular na fase S e promoveu a apoptose. Surpreendentemente, as células KKU214 resistentes à gemcitabina mostraram alta sensibilidade ao IVM, o que sugeriu que o IVM mostra potencial para o tratamento de tumores resistentes a medicamentos quimioterápicos convencionais.
2.3. Câncer do sistema urinário
O carcinoma de células renais é um tumor maligno fatal do sistema urinário derivado de células epiteliais tubulares renais. Sua morbidade aumentou em média 2% ao ano em todo o mundo e o efeito do tratamento clínico não é satisfatório. Experimentos confirmaram que o IVM poderia inibir significativamente a proliferação de cinco linhas celulares de carcinoma de células renais sem afetar a proliferação de células renais normais, e seu mecanismo pode estar relacionado à indução de disfunção mitocondrial. O IVM poderia reduzir significativamente o potencial da membrana mitocondrial e inibir a respiração mitocondrial e a produção de ATP. A presença do combustível mitocondrial acetil-L-carnitina (ALCAR) e do antioxidante N-acetil-L-cisteína (NAC) poderia reverter a inibição induzida pelo IVM. Em experimentos com animais, os resultados imuno-histoquímicos para tecidos tumorais tratados com IVM mostraram que a expressão do marcador de estresse mitocondrial HEL foi significativamente aumentada, e os resultados foram consistentes com os dos experimentos com células.
O câncer de próstata é um tumor maligno derivado de células epiteliais da próstata, e sua morbidade só perde para a do câncer de pulmão entre homens em países ocidentais. No experimento de Nappi, descobriu-se que a IVM poderia aumentar a atividade medicamentosa do medicamento antiandrogênico enzalutamida na linhagem de células de câncer de próstata LNCaP e reverter a resistência da linhagem de células de câncer de próstata PC3 ao docetaxel. Curiosamente, a IVM também restaurou a sensibilidade do câncer de mama triplo-negativo ao medicamento antiestrogênio tamoxifeno, o que também implica o potencial da IVM para ser usada na terapia endócrina. Além disso, a IVM também demonstrou ter um bom efeito inibitório na linhagem de células de câncer de próstata DU145.
2.4. Câncer hematológico
A leucemia é um tipo de doença clonal maligna causada por células-tronco hematopoiéticas anormais. Em um experimento projetado para rastrear medicamentos potenciais para o tratamento da leucemia, o IVM matou preferencialmente células de leucemia em baixas concentrações sem afetar as células hematopoiéticas normais. O mecanismo foi relacionado ao aumento do influxo de íons cloreto na célula pelo IVM, resultando na hiperpolarização da membrana plasmática e indução da produção de espécies reativas de oxigênio (ROS). Também foi comprovado que o IVM tem um efeito sinérgico com citarabina e daunorrubicina no tratamento da leucemia. O experimento de Wang descobriu que o IVM poderia induzir seletivamente a disfunção mitocondrial e o estresse oxidativo, fazendo com que as células K562 da leucemia mieloide crônica sofressem aumento da apoptose dependente de caspase em comparação com as células normais da medula óssea. Também foi confirmado que o IVM inibiu o crescimento do tumor de maneira dose-dependente, e o dasatinibe teve eficácia melhorada.
2.5. Câncer do sistema reprodutivo
O câncer cervical é uma das malignidades ginecológicas mais comuns, resultando em aproximadamente 530.000 novos casos e 270.000 mortes em todo o mundo a cada ano. A maioria dos cânceres cervicais é causada pela infecção pelo papilomavírus humano (HPV). Foi comprovado que a IVM inibe significativamente a proliferação e migração de células HeLa e promove a apoptose. Após a intervenção com IVM, o ciclo celular das células HeLa foi bloqueado na fase G1/S, e as células apresentaram alterações morfológicas típicas relacionadas à apoptose.
O câncer de ovário é um câncer maligno que não apresenta sintomas clínicos precoces e tem uma resposta terapêutica ruim. A taxa de sobrevivência de 5 anos após o diagnóstico é de aproximadamente 47%. Em um estudo de Hashimoto, descobriu-se que o IVM inibiu a proliferação de várias linhagens de células de câncer de ovário, e o mecanismo estava relacionado à inibição da cinase PAK1. Em pesquisa para rastrear alvos potenciais para o tratamento do câncer de ovário por meio do uso de uma biblioteca shRNA e uma biblioteca CRISPR/Cas9, o oncogene KPNB1 foi detectado. O IVM pode bloquear o ciclo celular e induzir a apoptose celular por meio de um mecanismo dependente de KPNB1 no câncer de ovário. Curiosamente, o IVM e o paclitaxel têm um efeito sinérgico no câncer de ovário, e o tratamento combinado em experimentos in vivo inibiu quase completamente o crescimento do tumor. Além disso, de acordo com um relatório de Zhang, o IVM pode aumentar a eficácia da cisplatina para melhorar o tratamento do câncer epitelial de ovário, e o mecanismo está relacionado à inibição da via Akt/mTOR.
2.6. Glioma cerebral
Glioma é o tumor cerebral mais comum e aproximadamente 100.000 pessoas em todo o mundo são diagnosticadas com glioma a cada ano. Glioblastoma é o glioma mais mortal, com um tempo médio de sobrevivência de apenas 14-17 meses. Experimentos mostraram que IVM inibiu a proliferação de células G de glioblastoma humano U87 e T98 de forma dependente da dose e induziu apoptose de forma dependente de caspase. Isso foi relacionado à indução de disfunção mitocondrial e estresse oxidativo. Além disso, IVM poderia induzir apoptose de células endoteliais microvasculares do cérebro humano e inibir significativamente a angiogênese. Esses resultados mostraram que IVM tinha o potencial de resistir à angiogênese tumoral e à metástase tumoral. Em outro estudo, IVM inibiu a proliferação de células de glioma U251 e C6 ao inibir a via Akt/mTOR.
Em gliomas, o miR-21 pode regular a via de sinalização Ras/MAPK e aumentar seus efeitos na proliferação e invasão. A atividade da helicase DDX23 afeta a expressão do miR-12. O IVM pode inibir a via de sinalização DDX23/miR-12 afetando a atividade da helicase DDX23, inibindo assim comportamentos biológicos malignos. Isso indicou que o IVM pode ser um potencial inibidor da helicase de RNA e um novo agente para tratamento de tumores. No entanto, aqui, devemos enfatizar que, como o IVM não pode passar efetivamente pela barreira hematoencefálica, a perspectiva do uso do IVM no tratamento de gliomas não é otimista.
2.7. Câncer do sistema respiratório
O carcinoma nasofaríngeo é um tumor maligno derivado de células epiteliais da mucosa nasofaríngea. A incidência é obviamente regional e familiar, e a infecção pelo vírus Epstein-Barr (EBV) está intimamente relacionada. Em um estudo que rastreou medicamentos para o tratamento do câncer nasofaríngeo, o IVM inibiu significativamente o desenvolvimento do carcinoma nasofaríngeo em camundongos nus em doses que não eram tóxicas para os timócitos normais [ 69 ]. Além disso, o IVM também teve um efeito citotóxico em uma variedade de células de câncer nasofaríngeo in vitro, e o mecanismo está relacionado à redução da atividade da cinase PAK1 para inibir a via MAPK.
O câncer de pulmão tem a maior morbidade e mortalidade entre os cânceres. Nishio descobriu que o IVM poderia inibir significativamente a proliferação de células de câncer de pulmão H1299 ao inibir a atividade YAP1. O experimento de Nappi também provou que o IVM combinado com erlotinibe alcançou um efeito de morte sinérgico ao regular a atividade do EGFR e em células de câncer de pulmão HCC827. Além disso, o IVM poderia reduzir a metástase de células de câncer de pulmão ao inibir a EMT.
2.8. Melanoma
O melanoma é o tumor maligno de pele mais comum, com alta taxa de mortalidade. Medicamentos que têm como alvo mutações BRAF, como vemurafenib, dabrafenib e anticorpos monoclonais PD-1, incluindo pembrolizumab e nivolumab, melhoraram muito o prognóstico do melanoma. Gallardo tratou células de melanoma com IVM e descobriu que ele poderia efetivamente inibir a atividade do melanoma. Curiosamente, o IVM também pode mostrar atividade contra células de melanoma do tipo selvagem BRAF, e sua combinação com dapafinib pode aumentar significativamente a atividade antitumoral. Além disso, foi confirmado que o PAK1 é o alvo principal do IVM que medeia sua atividade antimelanoma, e o IVM também pode reduzir significativamente a metástase pulmonar do melanoma em experimentos com animais. Deng descobriu que o IVM poderia ativar a translocação nuclear do TFE3 e induzir a morte celular dependente de autofagia pela desfosforilação do TFE3 (Ser321) em células de melanoma SK-MEL-28. Entretanto, o NAC reverteu o efeito do IVM, o que indicou que o IVM aumentou a autofagia dependente de TFE3 através da via de sinalização ROS.
3. Morte celular programada induzida por IVM em células tumorais e mecanismos relacionados
3.1. Apoptose
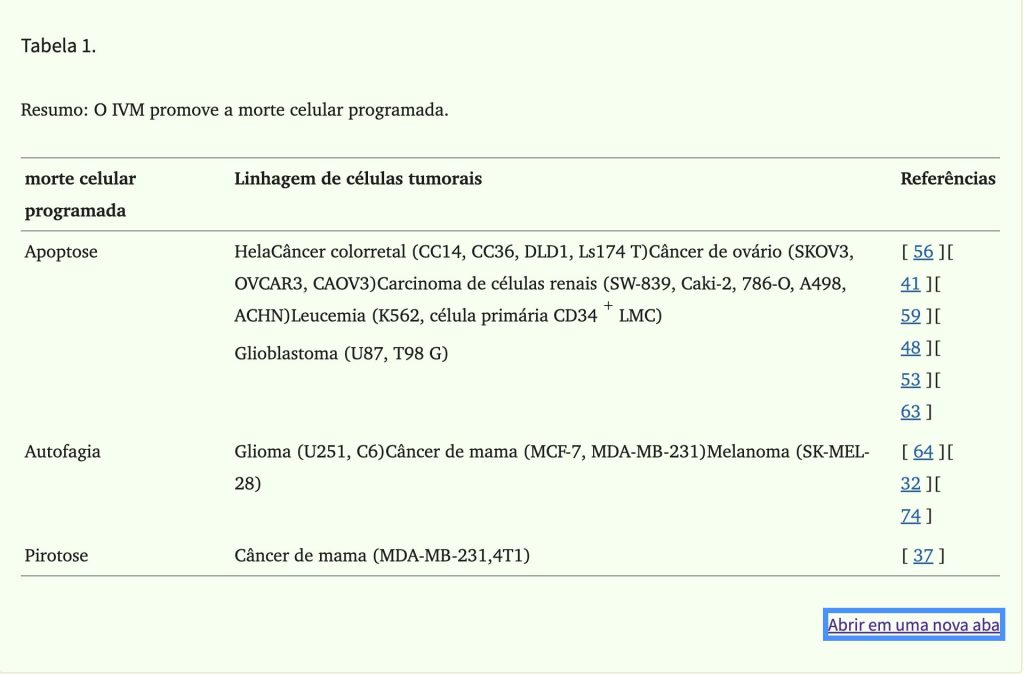
A IVM induz diferentes padrões de morte celular programada em diferentes células tumorais (Tabela 1). Conforme mostrado na Tabela 1 , a principal forma de morte celular programada induzida pela IVM é a apoptose. A apoptose é uma morte celular programada que é regulada por genes para manter a estabilidade celular. Ela pode ser desencadeada por duas vias de ativação: a via de estresse do retículo endoplasmático endógeno/mitocondrial e a via do receptor de morte exógeno. A diminuição do potencial da membrana mitocondrial e a liberação do citocromo c das mitocôndrias para o citoplasma foram detectadas após a intervenção da IVM em células Hela. Portanto, inferimos que a IVM induz a apoptose principalmente pela via mitocondrial. Além disso, foram observadas alterações morfológicas causadas pela apoptose, incluindo condensação da cromatina, fragmentação nuclear, fragmentação do DNA e formação de corpos apoptóticos. Finalmente, o IVM alterou o equilíbrio entre as proteínas relacionadas à apoptose, regulando positivamente a proteína Bax e regulando negativamente a proteína antiapoptótica Bcl-2, ativando assim a caspase-9/-3 para induzir a apoptose (Fig. 2).
3.2. Autofagia
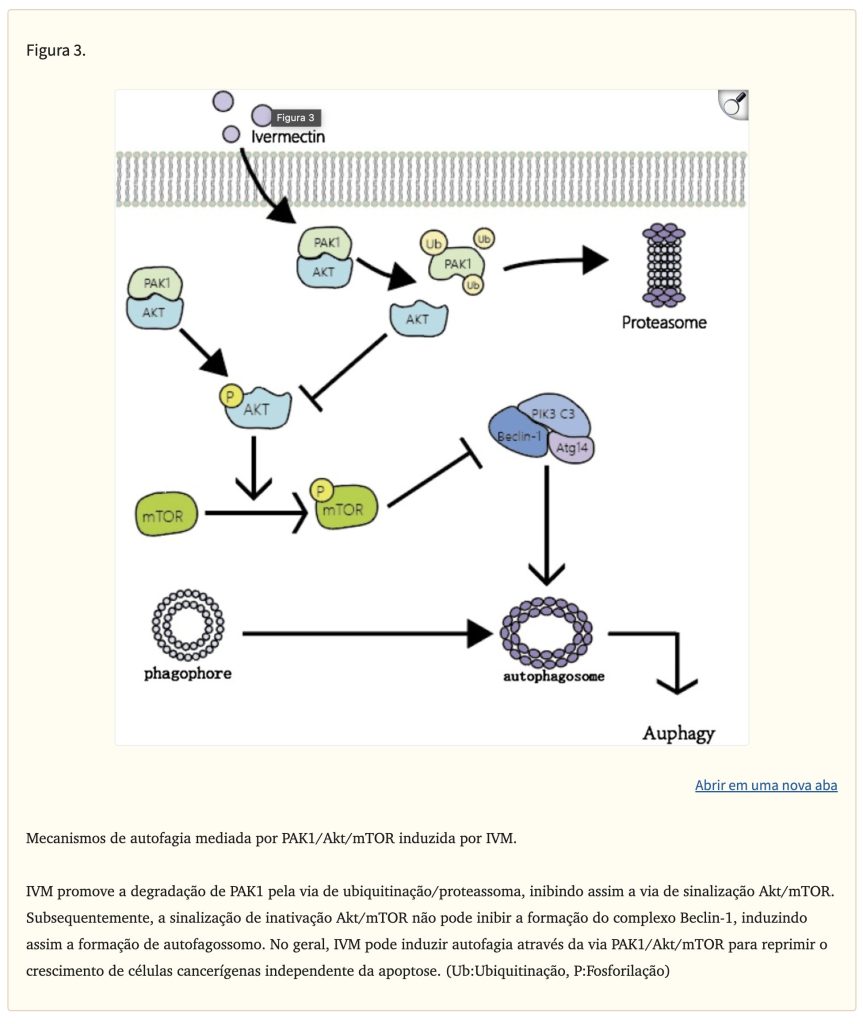
Autofagia é uma forma de morte celular programada dependente de lisossomos. Ela utiliza lisossomos para eliminar organelas supérfluas ou danificadas no citoplasma para manter a homeostase. É caracterizada por estruturas vacuolares de camada dupla ou multicamadas contendo componentes citoplasmáticos, que são conhecidos como autofagossomos. Nos últimos anos, muitos estudos mostraram que a autofagia é uma espada de dois gumes no desenvolvimento de tumores. Por um lado, a autofagia pode ajudar os tumores a se adaptarem à deficiência nutricional do microambiente tumoral e, até certo ponto, proteger as células tumorais de lesões induzidas por quimioterapia ou radioterapia. Por outro lado, alguns ativadores de autofagia podem aumentar a sensibilidade dos tumores à radioterapia e quimioterapia induzindo autofagia, e a ativação excessiva da autofagia também pode levar à morte das células tumorais. No geral, o ambiente específico das células tumorais determinará se a autofagia aumenta ou inibe o desenvolvimento do tumor e melhorar a atividade da autofagia também se tornou uma nova abordagem na terapia do câncer. A morte celular programada mediada pela autofagia após intervenção IVM e o aumento da eficácia anticâncer da IVM pela regulação da autofagia são tópicos interessantes. A intervenção com IVM nas linhas de células de câncer de mama MCF-7 e MDA-MB-231 aumentou significativamente o fluxo autofágico intracelular e a expressão de proteínas-chave da autofagia, como LC3, Bclin1, Atg5, e a formação de autofagossomos podem ser observadas. No entanto, após usar os inibidores de autofagia cloroquina e wortmanina ou derrubar Bclin1 e Atg5 por siRNA para inibir a autofagia, a atividade anticâncer da IVM diminuiu significativamente. Isso prova que a IVM exerce principalmente um efeito antitumoral através da via da autofagia. Além disso, os pesquisadores também usaram o ativador Akt CA-Akt para provar que o IVM induz principalmente a autofagia ao inibir a fosforilação de Akt e mTOR (Fig. 3). O fenômeno da autofagia induzida por IVM também foi relatado em glioma e melanoma. Todas as descobertas acima indicam o potencial do IVM como um ativador de autofagia para induzir morte dependente de autofagia em células tumorais.
3.3. Conversa cruzada entre apoptose induzida por IVM e autofagia
A relação entre apoptose e autofagia é muito complicada, e a conversa cruzada entre as duas desempenha um papel vital no desenvolvimento do câncer. Obviamente, os resultados existentes sugerem que a apoptose e a autofagia induzidas por IVM também exibem conversa cruzada. Por exemplo, foi descoberto em células de melanoma SK-MEL-28 que IVM pode promover apoptose, bem como autofagia. Após usar o inibidor de autofagia bafilomicina A1 ou siRNA para regular negativamente Beclin1, a apoptose induzida por IVM foi significativamente aumentada, o que sugeriu que a autofagia aumentada reduzirá a apoptose induzida por IVM e que a autofagia induzida por IVM pode proteger as células tumorais da apoptose. No entanto, em experimentos com células de câncer de mama, também foi descoberto que IVM poderia induzir autofagia, e a autofagia aumentada poderia aumentar a atividade anticâncer de IVM. As pesquisas mais recentes mostram que, em circunstâncias normais, a autofagia impedirá a indução de apoptose e a ativação da enzima caspase relacionada à apoptose inibirá a autofagia. No entanto, em circunstâncias especiais, a autofagia também pode ajudar a induzir apoptose ou necrose. Em suma, a relação entre a apoptose induzida por IVM e a autofagia envolve um mecanismo regulatório complexo, e o mecanismo molecular específico precisa de mais estudos. Acreditamos que uma exploração mais profunda do mecanismo pode orientar ainda mais o uso de IVM no tratamento do câncer.
3.4. Piroptose
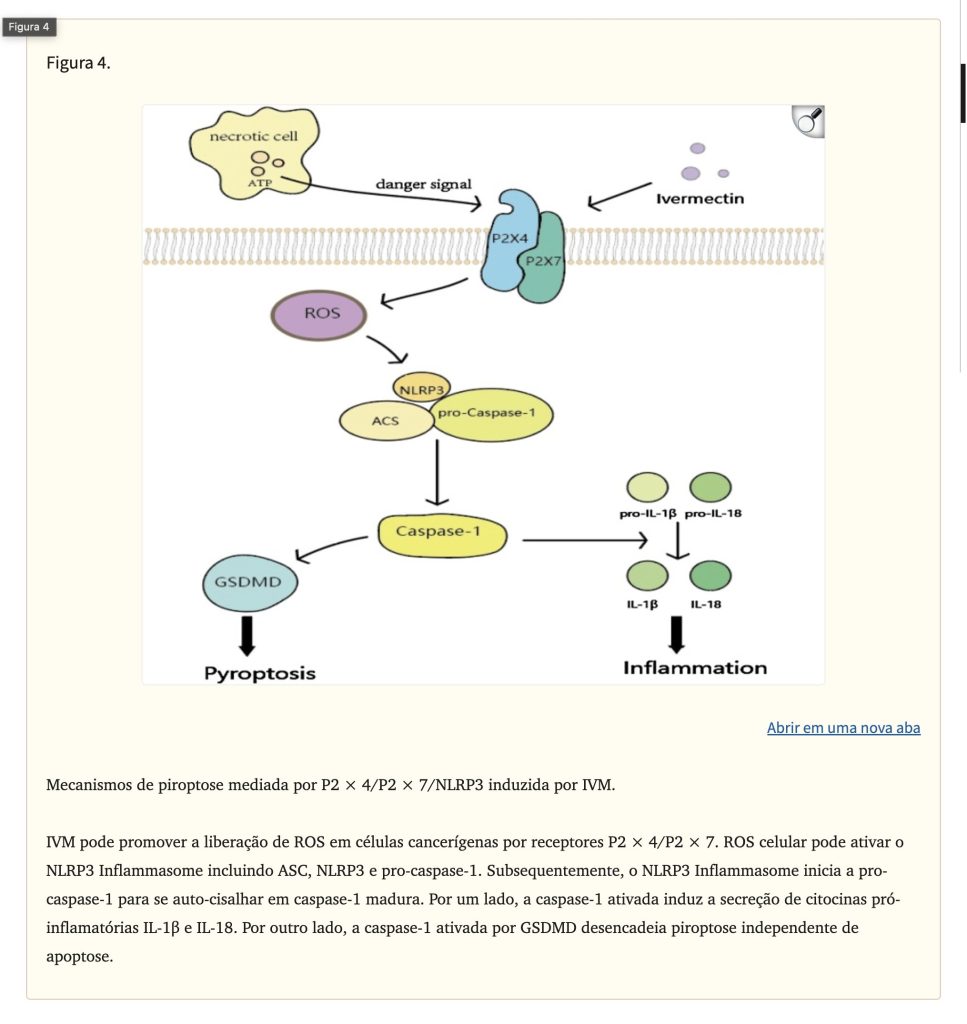
Piroptose é um tipo de morte celular inflamatória induzida por inflamossomos. O inflamossomo é um complexo multimolecular contendo receptor de reconhecimento de padrões (PRR), proteína semelhante a uma partícula associada à apoptose contendo um CARD (ASC) e pró-caspase-1. O PRR pode identificar padrões moleculares associados a patógenos (PAMPs) que são estruturalmente estáveis e evolutivamente conservados na superfície de microrganismos patogênicos e padrões moleculares associados a danos (DAMPs) produzidos por células danificadas. Os inflamossomos iniciam a conversão da pró-caspase-1 por meio de autocisalhamento em caspase-1 ativada. A caspase-1 ativada pode fazer com que a pró-IL-1β e a pró-IL-18 amadureçam e sejam secretadas. A gasdermina D (GSDMD) é um substrato para a caspase-1 ativada e é considerada uma proteína-chave na execução da piroptose. Em um experimento de Draganov, foi descoberto que a liberação de lactato desidrogenase (LDH) e caspase-1 ativada foi significativamente aumentada em células de câncer de mama após intervenção IVM. Além disso, fenômenos característicos de piroptose, como inchaço e ruptura celular, foram observados. Os autores especularam que a IVM pode mediar a ocorrência de piroptose pela via P2 × 4/P2 × 7/NLRP3 (Fig. 4), mas não há evidências específicas para provar essa especulação. Curiosamente, em experimentos de isquemia-reperfusão, a IVM agravou a isquemia renal pela via P2 × 7/NLRP3 e aumentou a liberação de citocinas pró-inflamatórias em células tubulares proximais humanas. Embora atualmente haja poucas evidências mostrando que a IVM induz piroptose, é importante investigar o papel da IVM na indução de piroptose em outros tipos de câncer em estudos futuros e perceber que a IVM pode induzir diferentes tipos de morte celular programada em diferentes tipos de câncer.
4. Efeito anticancerígeno do IVM por outras vias
4.1. Células-tronco cancerígenas
As células-tronco cancerígenas (CSCs) são uma população celular semelhante às células-tronco com características de autorrenovação e potencial de diferenciação no tecido tumoral. Embora as CSCs sejam semelhantes às células-tronco em termos de função, devido à falta de um mecanismo de regulação de feedback negativo para a autorrenovação das células-tronco, suas poderosas habilidades de proliferação e diferenciação multidirecional são irrestritas, o que permite que as CSCs mantenham certas atividades durante a quimioterapia e a radioterapia. Quando o ambiente externo é adequado, as CSCs proliferam rapidamente para reativar a formação e o crescimento dos tumores. Portanto, as CSCs têm sido amplamente reconhecidas como a principal causa de recorrência após o tratamento. Guadalupe avaliou o efeito da IVM nas CSCs na linhagem de células de câncer de mama MDA-MB-231. Os resultados experimentais mostraram que o IVM teria como alvo preferencial e inibiria populações de células ricas em CSCs em comparação com outras populações de células em células MDA-MB-231. Além disso, a expressão da proteína homeobox NANOG, proteína de ligação ao octâmero 4 (OCT-4) e SRY-box 2 (SOX-2), que estão intimamente relacionadas à capacidade de autorrenovação e diferenciação de células-tronco em CSCs, também foram significativamente inibidas pelo IVM. Isso sugere que o IVM pode ser usado como um potencial inibidor de CSCs para terapia do câncer. Estudos posteriores mostraram que o IVM poderia inibir CSCs regulando o eixo PAK1-STAT3
4.2. Reversão da resistência tumoral a múltiplos fármacos
A MDR de células tumorais é a principal causa de recaídas e mortes após quimioterapia. O efluxo de fármacos mediado pela família de transporte de ligação de ATP e a superexpressão da glicoproteína P (P-gp) são amplamente considerados as principais causas da MDR tumoral. Vários estudos confirmaram que a IVM poderia reverter a resistência aos fármacos através da inibição da P-gp e das proteínas associadas à MDR. Nas experiências de Didier que testaram o efeito da IVM na leucemia linfocítica, a IVM poderia ser usada como um inibidor da P-gp para afetar a MDR. Na experiência de Jiang, a IVM reverteu a resistência aos fármacos da linhagem de células de cancro colorretal resistente à vincristina HCT-8, da linhagem de células de cancro da mama resistente à doxorrubicina MCF-7 e da linhagem de células de leucemia mielóide crónica K562. A IVM inibiu a ativação do EGFR e da via de sinalização ERK/Akt/NF-kappa B a jusante para regular negativamente a expressão da P-gp. Anteriormente, mencionamos o papel da IVM no câncer de próstata resistente ao docetaxel e no colangiocarcinoma resistente à gemcitabina. Esses resultados indicaram a importância da aplicação da IVM para o tratamento de pacientes de quimioterapia com MDR.
4.3. Terapia direcionada aprimorada e tratamento combinado
O tratamento direcionado de genes mutados importantes no câncer, como EGFR no câncer de pulmão e HER2 no câncer de mama, pode alcançar efeitos clínicos poderosos. HSP27 é uma proteína chaperona molecular que é altamente expressa em muitos tipos de câncer e associada à resistência a medicamentos e ao mau prognóstico. É considerada um novo alvo para a terapia do câncer. Estudos recentes descobriram que o IVM poderia ser usado como um inibidor da fosforilação do HSP27 para aumentar a atividade de medicamentos anti-EGFR em tumores induzidos por EGFR/HER2. Um experimento descobriu que o IVM poderia aumentar significativamente os efeitos inibitórios do erlotinibe e do cetuximabe no câncer de pulmão e no câncer colorretal. Anteriormente, mencionamos que a IVM combinada com medicamentos quimioterápicos convencionais, como cisplatina, paclitaxel, daunorrubicina e citarabina, ou com medicamentos direcionados, como dasatinibe e dapafenibe, mostra grande potencial para tratamento do câncer. A combinação de medicamentos pode efetivamente aumentar a eficácia, reduzir a toxicidade ou retardar a resistência aos medicamentos. Portanto, a terapia combinada é o método mais comum de quimioterapia. A IVM tem uma variedade de diferentes mecanismos de ação em diferentes tipos de câncer, e seu potencial para efeitos sinérgicos e eficácia aprimorada na terapia combinada foi de particular interesse para nós. Não apenas a IVM não se sobrepõe a outras terapias em termos de seu mecanismo de ação, mas o fato de a IVM ter múltiplos alvos sugere que não é fácil produzir resistência à IVM. Portanto, o estudo e o teste contínuos de terapias medicamentosas combinadas seguras e eficazes são essenciais para maximizar os efeitos anticâncer da IVM.
5. Alvos moleculares e vias de sinalização envolvidas no potencial anticancerígeno do IVM
Conforme mencionado acima, o mecanismo anticâncer do IVM envolve uma ampla gama de vias de sinalização, como Wnt/β-catenina, Akt/mTOR, MAPK e outros alvos possíveis, como PAK1 e HSP27, bem como outros mecanismos de ação (Tabela 2). Descobrimos que o IVM inibe o desenvolvimento de células tumorais de uma maneira dependente de PAK1 na maioria dos cânceres. Consequentemente, nos concentramos em discutir o papel da cinase PAK1 e a conversa cruzada entre várias vias e PAK1 para fornecer novas perspectivas sobre o mecanismo da função do IVM.

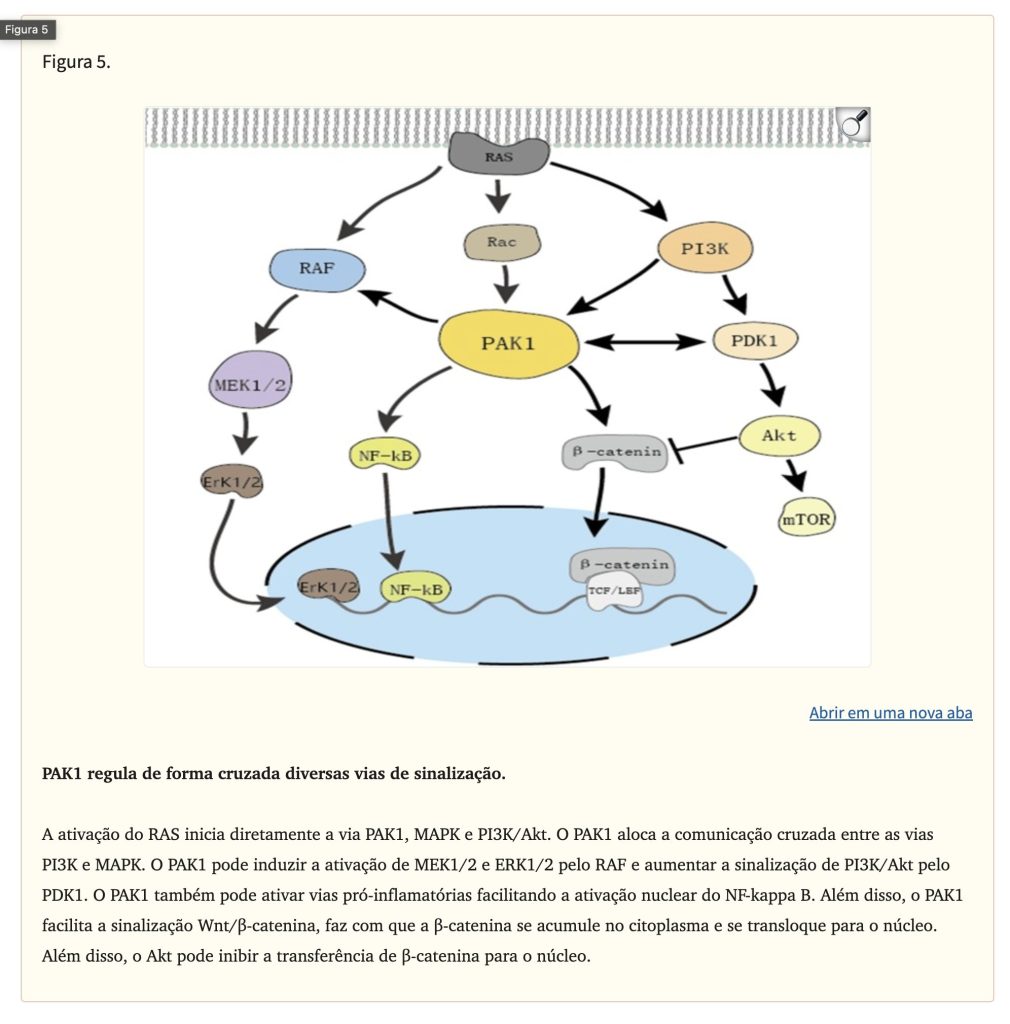
Como membro da família PAK de serina/treonina cinases, PAK1 tem uma infinidade de funções biológicas, como regular a proliferação celular e apoptose, movimento celular, dinâmica citoesquelética e transformação. Estudos anteriores indicaram que PAK1 está localizado na intersecção de múltiplas vias de sinalização relacionadas à tumorigênese e é um regulador chave das redes de sinalização do câncer (Fig. 5). A ativação excessiva de PAK1 está envolvida na formação, desenvolvimento e invasão de vários tipos de câncer. O direcionamento de PAK1 é um método novo e promissor para o tratamento do câncer, e o desenvolvimento de inibidores de PAK1 atraiu ampla atenção. IVM é um inibidor de PAK1 em uma variedade de tumores e tem boa segurança em comparação com a de outros inibidores de PAK1, como IPA-3. No melanoma e no carcinoma nasofaríngeo, a IVM inibiu a atividade de proliferação celular ao inibir a PAK1 para regular negativamente a expressão de MEK 1/2 e ERK1/2. Após a intervenção da IVM no câncer de mama, a expressão da PAK1 também foi significativamente inibida, e o uso de siRNA para regular negativamente a expressão da PAK1 em células tumorais reduziu significativamente a atividade anticâncer da IVM. Curiosamente, a IVM pode inibir a expressão da proteína PAK1, mas não afetou a expressão do mRNA da PAK1. O inibidor do proteassoma MG132 reverteu o efeito supressor da IVM, o que indicou que a IVM degradou principalmente a PAK1 por meio da via de ubiquitinação do proteassoma. Já mencionamos que a IVM desempenha um papel anticâncer em vários tumores ao regular vias intimamente relacionadas ao desenvolvimento do câncer. A PAK1 está na junção dessas vias. No geral, especulamos que o IVM pode regular as vias Akt/mTOR, MAPK e outras que são essenciais para a proliferação de células tumorais, inibindo a expressão de PAK1, que desempenha um papel anticancerígeno na maioria dos cânceres.
6. Resumo e perspectivas
Os tumores malignos são uma das doenças mais sérias que ameaçam a saúde humana e o desenvolvimento social hoje, e a quimioterapia é um dos métodos mais importantes para o tratamento de tumores malignos. Nos últimos anos, muitos novos medicamentos quimioterápicos entraram na clínica, mas as células tumorais são propensas à resistência aos medicamentos e reações adversas óbvias a esses medicamentos. Portanto, o desenvolvimento de novos medicamentos que podem superar a resistência, melhorar a atividade anticâncer e reduzir os efeitos colaterais é um problema urgente a ser resolvido na quimioterapia. O reposicionamento de medicamentos é um atalho para acelerar o desenvolvimento de medicamentos anticâncer.
Conforme mencionado acima, o medicamento antiparasitário de amplo espectro IVM, que é amplamente utilizado no campo do controle parasitário, tem muitas vantagens que sugerem que vale a pena desenvolvê-lo como um novo medicamento anticâncer em potencial. O IVM inibe seletivamente a proliferação de tumores em uma dose que não é tóxica para células normais e pode reverter o MDR de tumores. É importante ressaltar que o IVM é um medicamento estabelecido usado para o tratamento de doenças parasitárias, como oncocercose e elefantíase. Ele tem sido amplamente utilizado em humanos por muitos anos, e suas várias propriedades farmacológicas, incluindo efeitos toxicológicos de longo e curto prazo e características do metabolismo do medicamento são muito claras. Em voluntários saudáveis, a dose foi aumentada para 2 mg/Kg, e nenhuma reação adversa grave foi encontrada, enquanto testes em animais como camundongos, ratos e coelhos descobriram que a dose letal mediana (DL50) de IVM foi de 10-50 mg/Kg. Além disso, IVM também demonstrou apresentar boa permeabilidade em tecidos tumorais. Infelizmente, não houve relatos de ensaios clínicos de IVM como um medicamento anticâncer. Ainda há alguns problemas que precisam ser estudados e resolvidos antes que IVM seja usado na clínica.
1) Embora um grande número de resultados de pesquisa indique que a IVM afeta múltiplas vias de sinalização em células tumorais e inibe a proliferação, a IVM pode causar atividade antitumoral em células tumorais por meio de alvos específicos. No entanto, até o momento, nenhum alvo exato para a ação da IVM foi encontrado. (2) A IVM regula o microambiente tumoral, inibe a atividade das células-tronco tumorais e reduz a angiogênese tumoral e a metástase tumoral. No entanto, não há uma conclusão sistemática e clara sobre o mecanismo molecular relacionado. Portanto, em pesquisas futuras, é necessário continuar a explorar o mecanismo específico da IVM envolvido na regulação do microambiente tumoral, angiogênese e EMT. (3) Tornou-se cada vez mais claro que a IVM pode induzir um modo misto de morte celular envolvendo apoptose, autofagia e piroptose, dependendo das condições celulares e do tipo de câncer. Identificar o contribuinte predominante ou mais importante para a morte celular em cada tipo de câncer e ambiente será crucial para determinar a eficácia dos tratamentos baseados em IVM. (4) A IVM pode aumentar a sensibilidade de drogas quimioterápicas e reduzir a produção de resistência. Portanto, a IVM deve ser usada em combinação com outras drogas para atingir o melhor efeito, enquanto o plano de medicação específico usado para combinar a IVM com outras drogas ainda precisa ser explorado.
A maioria das pesquisas anticâncer realizadas na família da avermectina tem se concentrado na avermectina e na IVM até agora. Medicamentos da família da avermectina, como a selamectina e a doramectina, também têm efeitos anticâncer, conforme relatado anteriormente. Com o desenvolvimento de derivados da família da avermectina que são mais eficientes e menos tóxicos, pesquisas relevantes sobre o mecanismo anticâncer dos derivados ainda têm grande valor. As pesquisas existentes são suficientes para demonstrar o grande potencial da IVM e suas perspectivas como um novo medicamento anticâncer promissor após pesquisas adicionais. Acreditamos que a IVM pode ser mais desenvolvida e introduzida clinicamente como parte de novos tratamentos contra o câncer em um futuro próximo.
Fontes: https://x.com/IceSohei/
https://pmc.ncbi.nlm.nih.gov/articles/PMC7505114/
