RESUMO
Devido às suas propriedades físico-químicas únicas, os nanomateriais da família do grafeno (GFNs) são amplamente utilizados em muitos campos, especialmente em aplicações biomédicas. Atualmente, muitos estudos investigaram a biocompatibilidade e a toxicidade de GFNs in vivo e in vitro. Geralmente, os GFNs podem exercer diferentes graus de toxicidade em animais ou modelos celulares, seguindo diferentes vias de administração e penetrando nas barreiras fisiológicas, sendo posteriormente distribuídos nos tecidos ou localizados nas células, sendo eventualmente excretados para fora dos corpos. Esta revisão reúne estudos sobre os efeitos tóxicos dos GFNs em vários órgãos e modelos celulares. Também destacamos que vários fatores determinam a toxicidade dos GFNs, incluindo o tamanho lateral, estrutura da superfície, funcionalização, carga, impurezas, agregações e efeito corona, etc. Além disso, vários mecanismos típicos subjacentes à toxicidade de GFN foram revelados, por exemplo, destruição física, estresse oxidativo, dano ao DNA, resposta inflamatória, apoptose, autofagia e necrose. Nestes mecanismos, as vias dependentes de (receptores toll-like) TLR-, fator de crescimento transformador β- (TGF-β-) e fator de necrose tumoral alfa (TNF-α) estão envolvidas na rede de vias de sinalização e o estresse oxidativo desempenha um papel crucial nessas vias. Nesta revisão, resumimos as informações disponíveis sobre os fatores reguladores e os mecanismos de toxicidade dos GFNs, e propomos alguns desafios e sugestões para futuras investigações dos GFNs, com o objetivo de completar os mecanismos de toxicologia e fornecer sugestões para melhorar a segurança biológica dos GFNs e facilitar sua ampla aplicação.
Palavras-chave: Nanomateriais da família do grafeno, Toxicidade, Toxicocinética, Mecanismos, Propriedades físico-químicas, Perspectivas futuras
CONTEXTO
O grafeno, que é isolado do grafite cristalino, é uma monocamada plana composta de folhas bidimensionais de um átomo de espessura de uma estrutura em favo de mel hexagonalmente arranjada [1]. Por causa de sua estrutura única, área de superfície específica e características mecânicas, as funções e aplicações do grafeno têm ganhado considerável atenção desde a descoberta do material em 2004 [2, 3]. O grafeno e seus derivados incluem grafeno de monocamada, grafeno de poucas camadas (FLG), óxido de grafeno (GO), óxido de grafeno reduzido (rGO), nanofolhas de grafeno (GNS) e nanofitas de grafeno, etc. [4 – 7] GO é um dos derivados químicos do grafeno mais vitais dos nanomateriais da família do grafeno (GFNs), que atrai cada vez mais atenção por suas potenciais aplicações biomédicas. Os materiais à base de grafeno geralmente têm tamanhos que variam de vários a centenas de nanômetros e têm de 1 a 10 nm de espessura [8, 9], que também é a definição de “nanopartículas” ou “nanomateriais”. Devido às suas excepcionais propriedades físicas e químicas, os materiais de grafeno têm sido amplamente utilizados em vários campos, incluindo armazenamento de energia; dispositivos nanoeletrônicos; baterias [10-12]; e aplicações biomédicas, como antibacterianos [13, 14], biossensores [15-18], imagem celular [19, 20], entrega de drogas [8, 21, 22], e a engenharia de tecidos [23-25].
Junto com o aumento da aplicação e produção de GFNs, o risco de exposição ocupacional ou ambiental não intencional a GFNs está aumentando [26]. E, recentemente, há alguma investigação sobre a exposição de GFNs em ambientes ocupacionais e dados publicados mostraram que a exposição ocupacional de GFNs tinha toxicidade potencial para os trabalhadores e pesquisadores [27-29]. Os GFNs podem ser administrados aos corpos por instilação intratraqueal [30], administração oral [31], injeção intravenosa [32], injeção intraperitoneal [33] e injeção subcutânea [34]. Os GFNs podem induzir lesões agudas e crônicas nos tecidos, penetrando através da barreira sangue-ar, barreira sangue-testículo, barreira sangue-cérebro e barreira sangue-placenta, etc. e acumulando-se no pulmão, fígado e baço, etc. Por exemplo, alguns aerossóis de nanomateriais de grafeno podem ser inalados e causar deposição substancial no trato respiratório, e podem facilmente penetrar pelas vias aéreas traqueobrônquicas e, em seguida, transitar para as vias aéreas pulmonares inferiores, resultando na subsequente formação de granulomas, fibrose pulmonar e efeitos adversos à saúde para as pessoas expostas [2, 29]. Vários comentários delinearam as propriedades únicas [35, 36] e resumiram as mais recentes aplicações biológicas potenciais de GFNs para entrega de drogas, entrega de genes, biossensores, engenharia de tecidos e neurocirurgia [37-39]; avaliou a biocompatibilidade de GFNs em células (bactérias, mamíferos e plantas) [7, 40, 41] e animais (ratos e peixes-zebra) [42]; coletou informações sobre a influência de GFNs nos ambientes de solo e água [43]. Embora essas revisões tenham discutido os perfis de segurança relacionados e nanotoxicologia de GFNs, as conclusões específicas e os mecanismos detalhados de toxicidade foram insuficientes e os mecanismos de toxicidade não foram resumidos completamente. Os mecanismos toxicológicos de GFNs demonstrados em estudos recentes contêm principalmente resposta inflamatória, danos ao DNA, apoptose, autofagia e necrose, etc., e esses mecanismos podem ser coletados para explorar ainda mais a complexa rede de vias de sinalização que regulam a toxicidade de GFNs. É necessário salientar que existem vários fatores que influenciam em grande parte a toxicidade dos GFNs, como a concentração, dimensão lateral, estrutura de superfície e funcionalização, etc.
TOXICIDADE DE GFNs (IN VIVO E IN VITRO)
Os GFNs penetram nas barreiras fisiológicas ou estruturas celulares por diferentes vias de exposição ou vias de administração e entram no corpo ou nas células, resultando eventualmente em toxicidade in vivo e in vitro. As várias vias de administração e vias de entrada, distribuição e excreção de diferentes tecidos, até mesmo os vários padrões de captação de células e localizações, podem determinar o grau de toxicidade dos GFNs [44-46]. Portanto, torná-los claros pode ser útil para entender melhor as leis de ocorrência e desenvolvimento da toxicidade de GFNs.
Via de administração
As vias de administração comuns em modelos animais incluem a exposição das vias aéreas (insuflação intranasal, instilação intratraqueal e inalação), administração oral, injeção intravenosa, injeção intraperitoneal e injeção subcutânea. A principal via de exposição para GFNs no ambiente de trabalho é a exposição das vias aéreas, portanto, a inalação e a instilação intratraqueal são usadas principalmente em camundongos para simular a exposição humana a GFNs. Embora o método de inalação forneça a simulação mais realista para a exposição na vida real, a instilação é o método mais eficaz e com maior economia de tempo, e foi descoberto que os GFNs causam um período de inflamação mais longo usando a instilação (instilação intratraqueal, instalação intrapleural e aspiração faríngea) do que a inalação [24, 30, 47, 48]. Os GFNs foram investigados para se depositar nos pulmões e se acumular em um nível alto, que foi retido por mais de 3 meses nos pulmões com limpeza lenta após a instilação intratraqueal [49]. A injeção intravenosa também é amplamente usada para avaliar a toxicidade de nanomateriais de grafeno, e o grafeno circula pelo corpo de camundongos em 30 minutos, acumulando-se em uma concentração de trabalho no fígado e na bexiga [32, 50-52]. No entanto, os derivados de GO tiveram adsorção intestinal bastante finita e foram rapidamente excretados em camundongos adultos por via oral [31, 53]. O GO de tamanho nanométrico (350 nm) fez com que menos células mononucleares se infiltrassem no tecido adiposo subcutâneo após injeção subcutânea na região do pescoço em comparação com o GO de tamanho mícron (2 μm) [34]. O GO aglomerou-se próximo ao local da injeção após a injeção intraperitoneal, e numerosos agregados menores se estabeleceram na proximidade do fígado e da serosa do baço [31, 33]. Experimentos em contato com a pele ou permeação de GFNs na pele não foram encontrados nos artigos revisados aqui, e não há evidência suficiente disponível para concluir que o grafeno pode penetrar na pele intacta ou em lesões cutâneas. A rota das gotas nasais, amplamente utilizada para testar a neurotoxicidade ou potencial de lesão cerebral de outros nanomateriais, não foi mencionada nos trabalhos aqui revisados.
Caminhos de entrada de GFNs
Os GFNs atingem vários locais através da circulação sanguínea ou barreiras biológicas após entrar no corpo, o que resulta em vários graus de retenção em diferentes órgãos. Devido ao seu tamanho nanométrico, os GFNs podem atingir órgãos mais profundos, passando pelas barreiras fisiológicas normais, como a barreira sangue-ar, barreira sangue-testículo, barreira sangue-cérebro e barreira sangue-placenta.
Barreira sangue-ar
Os pulmões são uma entrada potencial para nanopartículas de grafeno no corpo humano através das vias aéreas. As nanofolhas inaladas de GO podem destruir a ultraestrutura e as propriedades biofísicas do filme de surfactante pulmonar (PS), que é a primeira linha de defesa do hospedeiro, e emergir sua potencial toxicidade [54]. As partículas aglomeradas ou dispersas se depositam na superfície alveolar interna dentro dos alvéolos e então são engolfadas pelos macrófagos alveolares (AMs) [55]. A depuração nos pulmões é facilitada pela escada rolante mucociliar, AMs ou camada epitelial [56-58]. No entanto, algumas pequenas nanopartículas inaladas infiltram a barreira epitelial pulmonar intacta e podem, então, entrar transitoriamente no epitélio alveolar ou no interstício [59, 60]. O grafeno instilado por via intratraqueal pode ser redistribuído para o fígado e baço, passando pela barreira ar-sangue [61]. O estudo da barreira hemato-ar pode chamar atenção intensiva, uma vez que pesquisadores e trabalhadores se expõem aos GFNs geralmente por via inalatória. Deixar claro como a barreira sangue-ar desempenha um papel na toxicidade dos GFNs pode se tornar um tópico de pesquisa popular.
Barreira hematoencefálica
O intrincado arranjo da barreira hematoencefálica, consistindo de vários receptores de membrana e portadores altamente seletivos, exerce apenas uma influência sutil na circulação sanguínea e no microambiente cerebral em comparação com o endotélio vascular periférico [62]. A pesquisa sobre o mecanismo da barreira hematoencefálica havia feito alguns avanços envolvidos em doenças e nanotoxicidade. A imagem de espectrometria de massa (MSI) de dessorção/ionização a laser assistida por matriz (MALDI) revelou que o rGO, com um diâmetro médio de 342 ± 23,5 nm, permeou através da via paracelular na fenda interendotelial de uma maneira dependente do tempo, diminuindo a tensão paracelular da barreira hematoencefálica [63]. Além disso, pontos quânticos de grafeno (GQDs), com um tamanho pequeno de menos de 100 nm, podem atravessar a barreira hematoencefálica [64]. Estudos sobre como os materiais de grafeno passam pela barreira hematoencefálica e causam neurotoxicidade são muito raros, e mais dados são necessários para se chegar a uma conclusão.
Barreira sangue-testículo
As barreiras sangue-testículo e sangue-epidídimo são bem conhecidas por serem algumas das barreiras sanguíneas mais rígidas no corpo de mamíferos [65]. As partículas GO com diâmetros de 54,9 ± 23,1 nm tiveram dificuldade em penetrar nas barreiras sangue-testículo e sangue-epidídimo após a injeção intra-abdominal, e a qualidade do esperma dos camundongos não foi obviamente afetada mesmo na dosagem de 300 mg/kg [66].
Barreira sangue-placenta
A barreira placentária é indispensável na manutenção da gravidez, pois medeia a troca de nutrientes e produtos residuais metabólicos, exerce funções metabólicas vitais e secreta hormônios [67]. Uma revisão recente sugeriu que a placenta não fornece uma barreira rígida contra a transferência de nanopartículas para os fetos, especificamente contra a distribuição de nanopartículas carbonáceas para e no feto [42]. Foi sugerido que o rGO e partículas de ouro (diâmetro de 13 nm) mal estão presentes ou estão ausentes na placenta e no feto no final da gestação após injeção intravenosa [44, 68]. No entanto, outros relatórios mostraram que a transferência transplacentária ocorre nos estágios finais da gestação [69, 70]. Muita atenção foi dada à toxicidade do desenvolvimento dos nanomateriais, e relatórios mostraram que muitas nanopartículas cruzaram a barreira placentária e influenciaram fortemente o desenvolvimento dos embriões [71-75]. Mas os estudos sobre a exposição a materiais de grafeno através da barreira da placenta são deficientes, e como essas partículas se transferem para os embriões deve ser avaliado em detalhes no futuro.
Essas quatro barreiras foram as mais mencionadas na literatura, e outras barreiras não foram avaliadas em estudos recentes, como as barreiras cutâneas, que não foram mencionadas em nenhuma das centenas de estudos de toxicidade de GFNs pesquisados. Além disso, o mecanismo pelo qual os GFNs passam por essas barreiras não é bem compreendido, e investigações mais sistemáticas são necessárias com urgência.
Distribuição e excreção de GFNs no tecido
A absorção, distribuição e excreção de nanopartículas de grafeno podem ser afetadas por vários fatores, incluindo as vias de administração, propriedades físico-químicas, aglomeração de partículas e revestimento de superfície de GFNs.
As diferentes vias de administração influenciam a distribuição de GFNs, por exemplo, FLG intratraquealmente instilado passando através da barreira sangue-ar, principalmente acumulado e retido nos pulmões, com 47% permanecendo após 4 semanas [61]. O GO administrado por via intravenosa entrou no corpo através da circulação sanguínea e foi altamente retido no pulmão, fígado, baço e medula óssea, e infiltração de células inflamatórias, formação de granuloma e edema pulmonar foram observados nos pulmões de camundongos após injeção intravenosa de 10 mg kg/corpo peso de GO [49]. Da mesma forma, foi observado um alto acúmulo de derivados PEGuilados de GO no sistema reticuloendotelial (RES), incluindo fígado e baço, após injeção intraperitoneal. Em contraste, GO-PEG e FLG não mostraram absorção detectável do trato gastrointestinal ou captação pelo tecido via administração oral [31].
As diferentes propriedades dos GFNs, como tamanho, dose e grupos funcionais, sempre levam a resultados inconsistentes nos perfis de distribuição do grafeno. Por exemplo, Zhang et al. descobriram que o GO foi aprisionado principalmente nos pulmões de camundongos [49]; no entanto, Li et al. observaram que o GO se acumulou no fígado do camundongo [76]. Notavelmente, as folhas de GO pequenas, com diâmetros de 10 a 30 nm, foram distribuídas principalmente no fígado e baço, enquanto as folhas de GO maiores (10 a 800 nm) se acumularam principalmente nos pulmões [49, 52, 77]. Se o tamanho do GO for maior do que o tamanho dos vasos, o GO geralmente fica preso nas artérias e capilares nas proximidades do local da injeção. Foi demonstrado que o acúmulo de GO nos pulmões aumenta com o aumento da dose e do tamanho injetados, mas no fígado diminui significativamente [78]. O revestimento de polímeros biocompatíveis no GO também afeta a biodistribuição, por exemplo, a injeção intravenosa de GO-PEG e GO-dextran (GO-DEX) se acumulam no sistema reticuloendotelial (RES), incluindo o fígado e baço, sem toxicidade de curto prazo [31, 79]. Além disso, a carga das proteínas plasmáticas e a adsorção do GO pelas proteínas plasmáticas também afetam a biodistribuição [34].
A excreção e depuração de GFNs variam em diferentes órgãos. Nos pulmões, as observações indicaram que as NGO são atraídas e eliminadas por AMs, que podem ser eliminadas do escarro por meio da depuração mucociliar ou de outras formas [57], e 46,2% do FLG intratraquealmente instilado foi excretado pelas fezes 28 dias após a exposição [61]. No fígado, as nanopartículas podem ser eliminadas através da via hepato-biliar seguindo o ducto biliar para o duodeno [80] Além disso, o GNS PEGuilado que se acumula principalmente no fígado e no baço pode ser eliminado gradualmente, provavelmente por excreção renal e fecal. Conforme revisado recentemente, as folhas de GO maiores que 200 nm são capturadas por filtração física esplênica, mas tamanhos pequenos (aproximadamente 8 nm) podem penetrar nos túbulos renais na urina e serem removidos rapidamente sem toxicidade óbvia [81]. As vias de excreção dos GFNs ainda não foram claramente explicadas, mas as vias renal e fecal parecem ser as principais vias de eliminação do grafeno.
Recentemente, a estratégia de distribuição e excreção/toxicidade tornou-se uma parte importante dos estudos nano-toxicológicos. Até o momento, vários resultados controversos sobre a distribuição e excreção de grafeno in vivo foram relatados em vários artigos, e uma avaliação sistemática da toxicocinética de GFNs ainda é necessária. O metabolismo e a excreção de nanomateriais são processos de longo período, no entanto, os estudos recentes de GFNs foram limitados a avaliações toxicológicas de curto prazo, e o acúmulo de longo prazo e a toxicidade dos GFNs em diferentes tecidos permanecem desconhecidos. Portanto, estudos de longo prazo sobre a deposição e excreção de GFNs precisam ser realizados usando diferentes células e animais para garantir a biossegurança dos materiais antes de sua utilização em aplicações biomédicas humanas.
Captação e localização de GFNs nas células
A captação e localização de GFNs também foram observadas para exercer diferentes efeitos em diferentes linhas de células. O grafeno é absorvido pelas células por meio de várias rotas [82, 83]. Basicamente, os parâmetros físico-químicos como tamanho, forma, revestimento, carga, diâmetro hidrodinâmico, ponto isoelétrico e gradiente de pH são importantes para permitir que o GO passe através da membrana celular [84]. Como afirmado anteriormente, nanopartículas com diâmetros <100 nm podem entrar nas células, e aquelas com diâmetros <40 nm podem entrar no núcleo [85]. Por exemplo, GQDs possivelmente penetram nas membranas celulares diretamente, ao invés de através de vias dependentes de energia [86, 87] Nanopartículas de óxido de grafeno revestidas de proteína maiores (PCGO) (~ 1 μm) entram nas células principalmente por meio de fagocitose, e nanopartículas de PCGO menores (~ 500 nm) entram nas células principalmente por endocitose mediada por clatrina [88]. As folhas de GO podem aderir e envolver a membrana celular, inserir-se na bicamada lipídica ou ser internalizadas na célula como consequência das interações com as células [89]. Da mesma forma, o óxido de grafeno reduzido PEGuilado (PrGO) e o rGO demonstraram aderir à membrana celular da bicamada lipídica de forma proeminente devido à interação de domínios grafíticos hidrofóbicos não modificados com a membrana celular [90, 91]. Consequentemente, foi sugerido que a exposição prolongada ou uma alta concentração de grafeno induz danos físicos ou biológicos à membrana celular, juntamente com a desestabilização dos filamentos de actina e do citoesqueleto [92].
Os dados atuais demonstram que as folhas GO interagem com a membrana plasmática e são fagocitadas por macrófagos. Três receptores principais nos macrófagos participam da fagocitose do GNS: o receptor Fcg (FcgR), o receptor de manose (MR) e o receptor de complemento (CR). Além disso, o FcgR é um receptor-chave na via fagocítica mediada [90, 93, 94]. A coroa proteica do GO promove o reconhecimento pelos receptores de macrófagos, principalmente o IgG contido na coroa proteica. Os macrófagos foram observados passando por mudanças morfológicas prodigiosas após o contato com o GO [34]. Após a internalização, o grafeno se acumulou no citoplasma da célula, espaço perinuclear e núcleo, o que induziu citotoxicidade em macrófagos murinos, aumentando as ROS intracelulares por meio da depleção do potencial da membrana mitocondrial e desencadeando a apoptose por meio da ativação da via mitocondrial [83]. As possíveis interações e locais de acumulação de GFNs estão resumidos na Fig. 1.
Figura 1
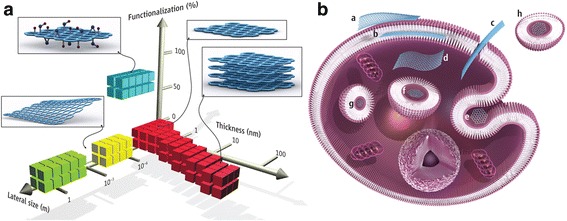
Materiais de grafeno e suas interações biológicas. (A) Um espaço de parâmetro para os materiais de grafeno mais amplamente usados pode ser descrito pelas dimensões e funcionalização da superfície do material, o último definido como a porcentagem dos átomos de carbono na hibridização de sp3. Os quadrados verdes representam grafeno crescido epitaxialmente; amarelo, grafeno esfoliado mecanicamente; vermelho, grafeno quimicamente esfoliado; azul, óxido de grafeno. Observe que uma série de outros materiais relacionados ao grafeno (como pontos quânticos de grafeno e nanofitas de grafeno) também estão sendo usados em experimentos. (B) Possíveis interações entre materiais relacionados ao grafeno com células (os flocos de grafeno não estão em escala). (a) Adesão à superfície externa da membrana celular. (b) Incorporação entre as monocamadas da bicamada lipídica da membrana plasmática. (c) Translocação de membrana. (d) Internalização citoplasmática. (e) Endocitose mediada por clatrina. (f) Internalização endossômica ou fagossômica. (g) Localização lisossomal ou outro compartimento perinuclear. (h) Localização exossômica. Os resultados biológicos de tais interações podem ser considerados adversos ou benéficos, dependendo do contexto da aplicação biomédica específica. Diferentes materiais relacionados ao grafeno terão diferentes mecanismos preferenciais de interação com células e tecidos que aguardam sua descoberta. [90] Copyright (2014), com permissão da American Association for Advancement of Science.
Toxicidade de GFNs em órgãos
A toxicidade e biocompatibilidade dos GFNs foram observadas e avaliadas por meio de estudos teóricos e de modelos animais. No momento, há uma massa de dados que demonstra a toxicidade dos GFNs em diferentes órgãos ou sistemas em animais, de modo que é difícil listar todos os dados nesta revisão. Assim, resumimos um certo número de literatura e escolhemos alguns estudos toxicológicos in vivo de GFNs listados na Tabela 1.
Toxicidade em órgãos internos
O GO pode resultar em resposta inflamatória aguda e lesão crônica por interferir nas funções fisiológicas normais de órgãos importantes [32, 81]. Experimentos de gavagem oral não mostraram absorção detectável de GO através do trato gastrointestinal [95]. Curiosamente, uma dose baixa de GO causou sérios danos ao trato gastrointestinal depois que camundongos maternos beberam uma suspensão de GO em vez de uma dose alta de GO porque uma dose baixa de GO sem aglomeração pode facilmente se fixar na superfície gastrointestinal e causar destruição por meio de suas abundantes arestas vivas [53]. Os GFNs causaram inflamação e permaneceram no pulmão no dia 90 após uma única instilação intratraqueal, e até mesmo translocados para os linfonodos pulmonares por inalação apenas pelo nariz [96, 97]. Uma alta dose de GO que forma agregações pode bloquear os vasos sanguíneos pulmonares e resultar em dispneia [50, 98], e trombos plaquetários foram observados em altas concentrações de 1 e 2 mg/kg de peso corporal por meio de injeção intravenosa [89]. Segundo relatos, o GO rompeu a barreira alveolar-capilar, permitindo que células inflamatórias se infiltrassem nos pulmões e estimulassem a liberação de citocinas pró-inflamatórias [99]. A fibrose e a inflamação puderam ser verificadas pelo aumento dos níveis dos marcadores proteicos colágeno1, Gr1, CD68 e CD11b nos pulmões. O uso de Tween 80 para dispersar FLG ou um surfactante plurônico para dispersar grafeno foi sugerido para reduzir a probabilidade de formação de fibrose pulmonar em células ou camundongos, enquanto a fibrose pulmonar foi observada quando o grafeno foi suspenso com albumina de soro bovino (BSA) [100]. Além disso, os isótopos radioativos podem ser administrados aos pulmões, acompanhados por uma distribuição de profundidade de 125 I-NGO nos pulmões, e os isótopos podem se depositar lá e resultar em mutações e cânceres [30]. No entanto, publicações recentes não reivindicaram alterações patológicas óbvias em camundongos expostos a baixas dosagens de GO e grafeno funcionalizado por injeção intravenosa, incluindo GO aminado (GO-NH2), GO funcionalizado com poli (acrilamida) (GO-PAM), poli (ácido acrílico)-GO (GO-PAA) e GO-PEG funcionalizados; apenas GO-PEG e GO-PAA induziram menos toxicidade do que o GO original in vivo [31, 79, 89]. Portanto, os grupos funcionais de GFNs e a concentração de trabalho ou estado agregado influenciam amplamente a toxicidade dos GFNs. Recentemente, as formas de modificar o grupo funcional dos GFNs, diminuir a concentração de trabalho ou alterar a condição agregada são normalmente utilizadas para diminuir a toxicidade dos GFNs.
Toxicidade no sistema nervoso central
O grafeno tem beneficiado amplamente a neurocirurgia com a aplicação de entrega de drogas/genes para o tratamento de tumores cerebrais, dispositivos biocompatíveis intracranianos e espinhais, técnicas de biossensor e bioimagem. Surgiram estudos sobre as potencialidades ou riscos do grafeno no cérebro. No modelo de embrião de galinha, flocos de grafeno puro diminuíram o nível de ácido ribonucleico e a taxa de síntese de ácido desoxirribonucleico, levando a efeitos prejudiciais no desenvolvimento do tecido cerebral e a ultraestrutura atípica foi observada no cérebro [101]. As pesquisas recentes de GFNs no sistema nervoso central estão mais envolvidas na aplicação do que na toxicidade. Os dados do estudo tóxico sobre GFNs estão em andamento.
Toxicidade no sistema de reprodução e desenvolvimento
O grafeno puro reduziu a vascularização do coração e a densidade dos vasos ramificados após a injeção em ovos de galinha fertilizados, seguida de incubação por 19 dias [101]. O GO e o rGO danificam embriões de peixe-zebra influenciando a taxa de eclosão do embrião e o comprimento do corpo de maneira dependente da concentração. Embora nenhuma malformação ou mortalidade óbvia tenha sido observada em embriões de peixe-zebra expostos [102], o GO aderiu e foi envolvido no córion dos embriões de peixe-zebra, causando hipóxia notável e atraso de incubação. Os agregados de GO foram retidos em muitas organelas, como olhos, coração, saco vitelino e cauda dos embriões, e a geração de apoptose e espécies reativas de oxigênio (ROS) foram observadas nessas regiões [103].
Os GFNs exercem diferentes efeitos toxicológicos no sistema reprodutor masculino e feminino. Os dados mostraram que o GO exerceu efeitos tóxicos muito baixos ou quase nenhum na reprodução masculina, mesmo com uma dose elevada via injeção intra-abdominal [66]. Além disso, o rGO não alterou os níveis de estrogênio sérico de camundongos fêmeas não grávidas. A condição é diferente na fêmea do camundongo: mães de camundongos podem dar à luz crias saudáveis após a injeção de rGO antes do acasalamento ou durante o início da gestação, e apenas alguns fetos anormais estavam presentes entre as ninhadas de mães injetadas com rGO. No entanto, os camundongos fêmea grávidos abortaram em todas as doses, e a maioria dos camundongos fêmea grávidos morreu quando a alta dose de rGO foi injetada durante o final da gestação [44]. Notavelmente, o desenvolvimento da prole no grupo de alta dosagem foi atrasado durante o período de lactação. A alta dose de GO diminuiu o consumo de água das mães por exposição oral, o que reduziu a produção de leite e, portanto, adiou o crescimento da prole [53]. Embora as descobertas indiquem que os GFNs são potencialmente prejudiciais ao desenvolvimento, os dados sobre toxicidade reprodutiva e de desenvolvimento ainda são deficientes. Estudos sobre a influência dos GFNs na reprodução e no desenvolvimento de machos e fêmeas ainda são necessários para elucidar o mecanismo de toxicidade subjacente.
Influência da hemocompatibilidade
A liberação de GO no sangue é inelutável. A hemocompatibilidade do GO foi considerada dependente do revestimento funcional e das condições de exposição. O GO com tamanho submicrômico resultou na maior atividade hemolítica, enquanto o grafeno agregado induziu a menor reação hemolítica. Grafeno puro e GO demonstraram efeito hemolítico de até 75 μg/mL [104]. O GO-polietilenimina (GO-PEI) exibiu toxicidade notável por ligação a HSA, mesmo a 1,6 μg/mL [105]. O óxido de grafeno carboxilado (GO-COOH) mostrou citotoxicidade significativa em relação aos linfócitos T em concentrações acima de 50 μg/mL e teve boa biocompatibilidade abaixo de 25 μg/mL, enquanto o GO-quitosana quase inibiu a atividade hemolítica [106]. Até agora, o risco correspondente de hemocompatibilidade permaneceu amplamente desconhecido.
Em conclusão, a lesão pulmonar induzida por GFNs foi estudada em diversos estudos, cujos resultados demonstraram infiltração de células inflamatórias, edema pulmonar e formação de granuloma nos pulmões. No entanto, apenas alguns estudos específicos avaliaram em outros órgãos, como fígado, baço e rim, e os sintomas de lesão, índice de dano e nível de dano a esses órgãos internos não foram totalmente investigados. Além disso, os estudos sobre a neurotoxicidade dos GFNs são bastante raros; nenhum dado revelou quais nervos ou áreas cerebrais sofrem danos, nem as manifestações comportamentais relacionadas foram estudadas. A toxicidade do desenvolvimento de GFNs pode induzir anormalidades estruturais, retardo de crescimento, anormalidades comportamentais e funcionais e até a morte. Um estudo sobre a toxicidade reprodutiva e de desenvolvimento de GFNs será extremamente significativo e receberá grande atenção no futuro. Quase todos os estudos de toxicidade de GFNs foram experimentos de curto prazo, e nenhum estudo investigou lesões tóxicas crônicas de longo prazo. No entanto, com base em estudos de toxicidade de outros nanomateriais, a exposição a longo prazo aos GFNs pode ser um fator importante de prejuízo à saúde [107-109]. Portanto, o estudo de longo prazo de GFNs é necessário.
Toxicidade de GFNs em modelos celulares
A citotoxicidade dos GFNs in vitro foi verificada em várias células para alterar a viabilidade e morfologia celular, destruir a integridade da membrana e induzir danos ao DNA [110-112]. O GO ou o rGO diminuem a adesão celular; induzem apoptose celular; e entram nos lisossomos, mitocôndrias, núcleos celulares e endoplasma [113]. Os GQDs entraram nas células e induziram a danos no DNA pelo aumento da expressão das proteínas p53, Rad 51 e OGG1 em células NIH-3 T3 [87]. No entanto, os GQDs não apresentam toxicidade significativa para linhas de células de câncer de mama humano (a uma dose de 50 μg/mL) ou células-tronco neurais humanas (a uma dose de 250 μg/mL) [114, 115]. Os derivados de GO diminuíram drasticamente a expressão de genes diferenciais que são responsáveis pela estrutura e função da membrana celular, como a regulação do citoesqueleto de actina, adesão focal e endocitose [89]. Em células de feocromocitoma de rato (células PC12), grafeno e rGO causaram efeitos citotóxicos e lesão mitocondrial, como a liberação de lactato desidrogenase (LDH), um aumento na ativação de caspase-3 e a geração de ROS [82, 116].
O grafeno pode aumentar a viabilidade celular [117] ou causar morte celular [118], dependendo da linhagem celular, tipo de material de grafeno e da dosagem. A citotoxicidade do GO foi observada em fibroblastos humanos e células epiteliais pulmonares em concentrações acima de 20 μg/mL após 24 h, mas a toxicidade mínima foi encontrada em células A549 em concentrações superiores a 50 μg/mL [119]. As respostas biológicas induzidas por GO, como ROS, malondialdeído (MDA) e LDH aumentaram, enquanto a superóxido dismutase (SOD) diminuiu dependente da dose em células HeLa [120]. No entanto, o guia molecular GO (GO-MB) mostrou baixa citotoxicidade, mesmo a 20 μg/mL em células HeLa [121]. O GO diminuiu a viabilidade das células A549, enquanto a mesma concentração e tempo de exposição aumentaram a viabilidade celular das células do carcinoma colorretal CaCo2 [122]. Outro estudo relatou que o GO aumentou dramaticamente a diferenciação de SH-SY5Y, acompanhado pelo aumento do comprimento da neurite e a expressão do marcador neuronal MAP2 em baixas concentrações, mas que o GO suprimiu a viabilidade das células SH-SY5Y em altas doses (≥80 mg/mL) [123]. Revestimentos funcionalizados em GO, como GO-PEG [124] e GO-quitosana [125], podem atenuar profundamente a citotoxicidade das partículas ao inibir as interações entre as células.
A toxicidade de GFNs in vitro está resumida na Tabela 2. Os dados sobre a citotoxicidade dos nanomateriais de grafeno são contrastantes e características variáveis influenciam os resultados. Os mecanismos e fatores que influenciam a toxicidade precisam ser elucidados em detalhes.
ORIGENS DA TOXICIDADE DOS GFNs
Alegadamente, as características do grafeno, incluindo sua concentração, dimensão lateral, estrutura superficial, grupos funcionais, pureza e corona proteica, influenciam fortemente sua toxicidade em sistemas biológicos [2, 7, 104, 126-129].
Concentração
Numerosos resultados demonstraram que os materiais de grafeno causam toxicidade dependente da dose em animais e células, como lesão hepática e renal, formação de granuloma pulmonar, diminuição da viabilidade celular e apoptose celular [130-134]. Em estudos in vivo, o GO não exibiu toxicidade óbvia em camundongos expostos a uma dose baixa (0,1 mg) e dose média (0,25 mg), mas induziu toxicidade crônica em uma dose alta (0,4 mg). O alto teor de GO depositado principalmente nos pulmões, fígado, baço e rins e era difícil de ser limpo pelos rins por meio de uma única injeção na veia da cauda [135]. Curiosamente, o aumento da dose resultou em uma diminuição dramática na captação hepática, mas um aumento na captação pulmonar de s-GO por injeção intravenosa [31], porque a dose alta de GO potencialmente ultrapassou a saturação de captação ou depletou a massa de opsoninas plasmáticas, o que, consequentemente, suprimiu a captação hepática. Além disso, um estudo in vitro relatou que as nanofolhas de GO de 20 μg/mL não exibiram citotoxicidade em A549 em 2 h de incubação, mas uma concentração mais alta (85 μg/mL) diminuiu a viabilidade celular para 50% em 24 h [136, 137]. Lü et al. também demonstraram que o GO não tinha citotoxicidade óbvia em baixas concentrações por 96 h em uma linha de células de neuroblastoma humano SH-SY5Y, mas a viabilidade das células diminuiu drasticamente para 20% após o tratamento com 100 mg/mL de GO por 96 h de incubação [123]. Os resultados em células HeLa, células NIH-3 T3 e células de câncer de mama (SKBR3, MCF7) tratadas com nanofitas de grafeno também mostraram uma diminuição da dose (10 a 400 mg/ml) e dependente do tempo (12 a 48 h) em viabilidade celular [138]. Concentrações crescentes de GO entraram nos lisossomos, mitocôndrias, endoplasma e núcleo celular [119]. Vários dados indicaram que o rGO causou morte celular mediada por apoptose em uma dose mais baixa e ponto de tempo inicial, mas que a necrose foi prevalente com o aumento no tempo/dose [110, 135].
Dimensão lateral
Nanopartículas com tamanhos <100 nm podem entrar na célula, <40 nm podem entrar no núcleo e menores que <35 nm podem cruzar a barreira hematoencefálica [85]. Um estudo mostrou que o GO (588, 556, 148 nm) não entrou nas células A549 e não tinha citotoxicidade óbvia [112]. Quando o diâmetro do grafeno está entre 100 e 500 nm, o menor tamanho pode causar a toxicidade mais severa, e quando o diâmetro está abaixo de 40 nm, os menores tamanhos podem ser os mais seguros. Por exemplo, o rGO com um diâmetro de 11 ± 4 nm pode entrar no núcleo das hMSCs e causar aberrações cromossômicas e fragmentação de DNA em concentrações muito baixas de 0,1 e 1,0 mg/mL em 1 h. No entanto, as folhas de rGO com diâmetros de 3,8 ± 0,4 nm não exibiram genotoxicidade notável em hMSCs, mesmo com uma alta dose de 100 mg/mL após 24 h [118].
Em um estudo in vivo, o s-GO (100 a 500 nm) se acumulou preferencialmente no fígado, enquanto o l-GO (1 a 5 μm) foi localizado principalmente nos pulmões porque o l-GO formou complexos de proteína-GO maiores que foram filtrados pelos vasos capilares pulmonares após injeção intravenosa [31]. Dados os tamanhos laterais relativos (205,8 nm, 146,8 nm e 33,78 nm) das três nanofolhas de GO na mesma concentração, o GO menor experimenta captação muito maior do que GO maior em células HeLa [139]. A alta absorção de s-GO mudou no microambiente das células e, consequentemente, induziu a maior perda de viabilidade e estresse oxidativo mais sério entre três tamanhos de amostras de GO [119]. Como resultado, um estudo delineou que o GO de forma dependente do tamanho induziu a polarização M1 de macrófagos e respostas pró-inflamatórias in vitro e in vivo. O GO maior mostrou adsorção mais forte na membrana plasmática com menos fagocitose, provocando interações robustas com TLRs e ativando as vias de NF-κB, em comparação com folhas de GO menores, que foram mais provavelmente captadas pelas células [94]. Para revelar ainda mais o mecanismo detalhado subjacente a esses efeitos, mais estudos são necessários para ilustrar o mecanismo vital do tamanho lateral dos materiais de grafeno.
Estrutura de superfície
Os GFNs possuem químicas de superfície amplamente variadas. Por exemplo, a superfície de grafeno puro é hidrofóbica, a superfície GO é parcialmente hidrofóbica com grupos carboxilato [140-142] e o rGO tem hidrofilicidade intermediária [143]. Foi observado que os GFNs perturbam a função e a estrutura das membranas celulares e proteínas, provavelmente por interações moleculares excepcionalmente fortes com as células [2, 91]. Por exemplo, o rGO ligado a membranas celulares, receptores estimulados e vias mitocondriais ativadas, induzindo apoptose [110, 111, 144]. Evidências limitadas mostraram que o GO é menor e menos tóxico do que o rGO por causa do alto conteúdo de oxigênio, bordas mais suaves e propriedades hidrofílicas das primeiras espécies [104, 145, 146]. Devido aos diferentes estados de oxidação de superfície do GO e do rGO, o GO possuindo hidrofilicidade distinta pode ser internalizado e absorvido por células HepG2 facilmente. Pelo contrário, o rGO com hidrofobicidade evidente, poderia ser adsorvido e agregado nas superfícies das células sem (ou com menor) captação [110]. Devido às fortes interações de empilhamento π-π, o grafeno tem alta capacidade de quebrar muitos resíduos da proteína, principalmente os aromáticos, como o capacete de vilina (HP), F10, W23 e F35. As estruturas secundária e terciária da proteína estão em grande parte na superfície do grafeno, interrompendo a estrutura e a função da proteína [41] (Fig. 2). Além disso, o GO pode se inserir entre os pares de bases do DNA de fita dupla e perturbar o fluxo de informações genéticas no nível molecular, o que pode ser uma das principais causas do efeito mutagênico do GO [7, 112, 146, 147].
Figura 2

Uma trajetória representativa de adsorção de HP35 no grafeno. (a) Instantâneos representativos em vários momentos. As proteínas são mostradas nos desenhos com hélice vermelha e alça verde, e o grafeno é mostrado em bege. Os resíduos aromáticos que formam as interações de empilhamento π-π são mostrados em azul, outros são mostrados em verde. (b) A área de superfície de contato da HP35 com o grafeno. (c) O RMSD de HP35 de sua estrutura nativa e o número de resíduos na estrutura em hélice α. Aqui, as estruturas secundárias são determinadas pelo programa DSSP. (d) A distância entre o grafeno e os resíduos aromáticos, incluindo F35, W23, F10, F17 e F06. Para mostrar o processo de adsorção mais claro, o eixo χ foi truncado e redimensionado. [41] Copyright (2011), com permissão do Journal of Physical of Chemistry.
Carga
Vários estudos destacaram a importância da carga superficial do GO devido à sua capacidade de afetar o mecanismo de internalização e captação das células [148-150]. A internalização do GO foi desprezível em não fagócitos, o que provavelmente foi devido à forte repulsão eletrostática entre o GO carregado negativamente e a superfície da célula [34]. No entanto, outros sugeriram que nanopartículas carregadas negativamente podem ser internalizadas em células não fagocíticas por ligação a locais catiônicos disponíveis na superfície da célula e ser captadas por receptores eliminadores [110, 146, 150]. Partículas GO/GS alegadamente causam alterações morfológicas e lise significativa, levando a hemólise elevada nos glóbulos vermelhos (RBCs). A ruptura da membrana de RBC é provavelmente atribuída às fortes interações eletrostáticas entre os grupos de oxigênio carregados negativamente na superfície GO/GS e os lipídios de fosfatidilcolina carregados positivamente na membrana externa de RBC [106].
Funcionalização
Estudos confirmaram que a funcionalização com PEG [52], poli-L-lisina PEGuilada (PLL) [151], poli (ε-caprolactona) [152], álcool polivinílico [3], Pluronic [153], amina [98], carboxila e grupos dextrano [79] diminuem amplamente a toxicidade e aumentam a biocompatibilidade do grafeno. Os resultados in vivo revelaram que apenas uma inflamação crônica leve emergiu após a injeção subcutânea de hidrogel GO-Pluronic e nenhuma toxicidade de curto prazo perceptível foi testada após a injeção intravenosa de GO-DEX [79, 154]. O GS PEGuilado não induziu toxicidade apreciável em camundongos expostos a 20 mg/kg por 3 meses, conforme avaliado por bioquímica do sangue e exames histológicos, e mostrou retenção relativamente baixa no RES [52, 155]. O revestimento do GO com quitosana quase eliminou a atividade hemolítica no sangue [39]. Além disso, o revestimento de PEG aliviou efetivamente as lesões agudas de tecido induzidas por GO; diminuição da agregação e retenção de GO no fígado, pulmões e baço; e promoveu a eliminação de GO [81], GO-DEX [79] e óxido de grafeno fluorado (FGO) [156].
In vitro, vários ensaios de função celular mostraram evidências claras de que a funcionalização da superfície do grafeno puro ou GO foi crítica para reduzir os fortes efeitos de toxicidade [91]. PEG-GO, PEI-GO e LA-PEG-GO danificaram células de fibroblastos de pulmão humano menos do que o GO [148]. O PEG-GO não exibiu citotoxicidade para várias culturas de células, como células de glioblastoma (U87MG), células de câncer de mama (MCF-7), células de carcinoma de ovário humano (OVCAR-3), células de câncer de cólon (HCT-116) e células linfoblastoides (RAJI), em concentrações de até 100 μg/mL [119, 157, 158]. O GQDs-PEG exibiu toxicidade muito baixa ou nenhuma toxicidade contra células de câncer de pulmão e cervical, mesmo em concentrações muito altas (200 μg/mL) [159] No entanto, como um material não biodegradável com grande potencial para internalização celular, uma investigação mais aprofundada é necessária para avaliar os possíveis efeitos adversos de longo prazo do grafeno funcionalizado.
Agregações e sedimentação
Alegadamente, os nanomateriais têm uma propensão para formar agregados em vez de unidades individuais, particularmente em condições fisiológicas. As superfícies GS permitiram menos RBCs anexar em comparação com GO, e GS teve a menor atividade hemolítica para mais formação de agregações aquosas. Em contraste, a rápida sedimentação e a formação de agregados de GS inibiram muito a disponibilidade de nutrientes das células de fibroblastos da pele humana que cresceram no fundo dos poços [106]. Portanto, as agregações e sedimentação das partículas de grafeno exercem efeitos variados em diferentes células.
Impurezas
A pureza do nanomaterial é uma consideração importante porque metais contaminantes residuais podem ser responsáveis pela toxicidade observada, ao invés do próprio nanomaterial, o que resultou em dados conflitantes sobre a citotoxicidade dos GFNs [35, 160]. O GO tradicionalmente preparado geralmente contém altos níveis de Mn2+ e Fe2+, que são altamente mutagênicos para as células. A liberação inespecífica desses íons do GO tradicionalmente preparado pode levar a níveis incomumente altos de citotoxicidade e fratura de DNA [39]. Em particular, Peng et al. [161] produziu GO de alta pureza contendo apenas 0,025 ppm de Mn2+ e 0,13 ppm de Fe2+, e Hanene et al. [162] inventou um novo método para preparar folhas de GO de camada única e alta pureza com boa dispersibilidade aquosa e estabilidade coloidal. O GO produzido por esses novos métodos não induziu respostas citotóxicas significativas (em doses de exposição de até 100 μg/mL) in vitro, e nenhuma resposta inflamatória óbvia ou formação de granuloma (doses de exposição de até 50 μg/animal) foram observadas in vivo. Portanto, a pureza dos GFNs merece atenção e é um passo vital para a determinação dos GFNs envolvidos em bioaplicações.
Efeito da coroa proteica
Por causa da alta carga de superfície livre, os nanomateriais podem facilmente formar “coros” com proteínas em sistemas biológicos [163, 164]. Sugere-se que a coroa proteica afeta a circulação, distribuição, depuração e toxicidade das nanopartículas. Vários artigos relataram que o GO forma coros proteicas de GO com proteínas plasmáticas adsorvidas no soro e essas coroas proteicas de GO desempenham um papel importante na decisão do destino do comportamento biocinético do GO in vivo. Essas coroas proteicas de GO podem regular a adesão de GO às células endoteliais e imunes por meio de interações específicas e não específicas [165]. Basicamente, a imunoglobulina G e as proteínas do complemento na coroa proteica ajudam a reorganizar as nanopartículas nas células do sistema imunológico, fazendo com que as partículas sejam engolfadas pelo RES, e o GO revestido com IgG ser absorvido por interações específicas ou não específicas com os receptores da membrana celular [31, 165]. No entanto, outro estudo descobriu que o GO não poderia aderir às células epiteliais da mucosa diretamente no trato intestinal depois que os camundongos filiais beberam uma solução aquosa de GO porque proteínas abundantes no leite foram adsorvidas na superfície do GO e, portanto, inibiram sua interação direta com as células epiteliais da mucosa [53]. A coroa proteica mitigou a citotoxicidade do GO, limitando sua interação física com a membrana celular e reduzindo o dano morfológico celular nas células HeLa, THP-1 e A549 [166-168]. O efeito citotóxico foi amplamente reduzido quando o GO foi pré-revestido com FBS e incubado com células; quase ∼ 90% de sobrevivência foi observada com 100 μg/mL de GO revestido com FBS e 100% de sobrevivência com 20 μg/mL de GO revestido com FBS. Tendências semelhantes foram observadas para o GO coberto pela BSA [166, 169]. De forma consistente, o soro adicional poderia neutralizar a toxicidade do GO puro em células J774.A1 em uma dose de 4 μg/mL, o que levou a uma diminuição no número de células de 52,5% em comparação com as células não tratadas [89].
Depois de revisar muitos estudos, pode-se concluir que a toxicidade do grafeno é influenciada por vários fatores. Esses fatores combinados mudam amplamente a toxicidade dos GFNs em muitos casos. Os estudos científicos muitas vezes precisam da identificação clara de causa e efeito, que deve manter apenas um fator diferente de cada vez, para que o efeito daquele único fator possa ser determinado. Mas em alguns artigos, vários fatores que influenciam a toxicidade dos GFNs foram estudados ao mesmo tempo, o que levou a resultados confusos.
POSSÍVEIS MECANISMOS DE TOXICIDADE DE GFNs
Embora algumas propriedades físico-químicas e a toxicidade dos GFNs tenham sido bem estudadas por muitos estudiosos, os mecanismos exatos subjacentes à toxicidade dos GFNs permanecem obscuros. Um esquema dos principais mecanismos de citotoxicidade de GFNs é ilustrado na Fig. 3.
Figura 3
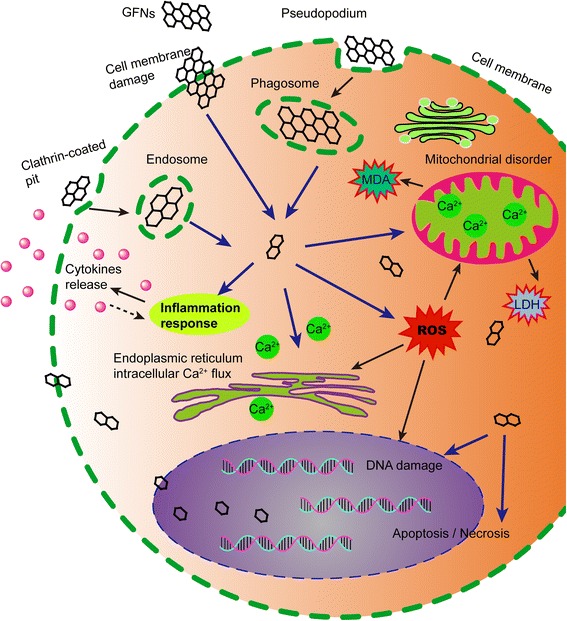
O diagrama esquemático mostra os possíveis mecanismos de citotoxicidade dos GFNs. Os GFNs entram nas células por diferentes maneiras, que induzem na geração de ROS, aumento de LDH e MDA e liberação de Ca2+. Posteriormente, os GFNs causam tipos de lesão celular, por exemplo, dano à membrana celular, inflamação, dano ao DNA, distúrbios mitocondriais, apoptose ou necrose.
Destruição física
O grafeno é um nanomaterial único em comparação com outras nanopartículas esféricas ou unidimensionais devido à sua estrutura bidimensional com carbonos sp2. A interação física das nanopartículas de grafeno com as membranas celulares é uma das principais causas da citotoxicidade do grafeno [7, 170, 171]. O grafeno tem alta capacidade de se ligar às estruturas em hélice α dos peptídeos devido à sua curvatura de superfície favorável [172]. Em concentração acima de 75 μg/mL, o grafeno puro aderiu amplamente às superfícies das células RAW 264,7 e resultou no alongamento anormal da membrana celular [104]. As fortes interações hidrofóbicas de GFNs com a membrana celular levam à extensão morfológica da actina-F filópode e disfunção do citoesqueleto. Além disso, as bordas afiadas do GNS podem atuar como “lâminas”, inserindo e cortando as membranas celulares bacterianas [173]. Além disso, o GO também danificou a membrana externa da bactéria E. coli diretamente, resultando na liberação de componentes intracelulares [173]. No entanto, a imagem TEM revelou que o pré-revestimento do GO com FBS eliminou a destruição das membranas celulares [166].
Produção de ROS levando ao estresse oxidativo
O estresse oxidativo surge quando níveis crescentes de ROS superam a atividade de enzimas antioxidantes, incluindo catalase, SOD ou glutationa peroxidase (GSH-PX) [174]. Os ROS atuam como segundos mensageiros em muitas cascatas de sinalização intracelular e levam a danos macromoleculares celulares, como quebra de lipídios da membrana, fragmentação de DNA, desnaturação de proteínas e disfunção mitocondrial, que influenciam muito o metabolismo celular e a sinalização [175-177]. As interações do GO com as células podem levar à geração excessiva de ROS, que é a primeira etapa nos mecanismos de carcinogênese, envelhecimento e mutagênese [83, 122]. O estresse oxidativo teve um papel significativo na lesão pulmonar aguda induzida por GO [30], e as respostas inflamatórias causadas pelo estresse oxidativo frequentemente surgiram após a exposição a GFNs [133, 177, 178]. A atividade de SOD e GSH-PX diminuiu após a exposição ao GO de uma maneira dependente do tempo e da dosagem [82, 106, 119]. Da mesma forma, o estresse oxidativo foi a principal causa de apoptose e danos ao DNA após as células HLF serem expostas ao GO [148]. Tanto a proteína quinase ativada por mitogênio (MAPK) (JNK, ERK e p38) e as vias de sinalização relacionadas ao TGF-beta foram desencadeadas pela geração de ROS em células tratadas com grafeno puro, acompanhada pela ativação de Bim e Bax, que são dois membros pró-apoptóticos da família de proteínas Bcl-2. Como resultado, a caspase-3 e suas proteínas efetoras a jusante, como PARP, foram ativadas e a apoptose foi iniciada [83, 179]. Informações detalhadas sobre as vias de sinalização relacionadas a MAPK-, TGF-β- e TNF-α, que induzem inflamação, apoptose e necrose, estão resumidas na Fig. 4.
Figura 4
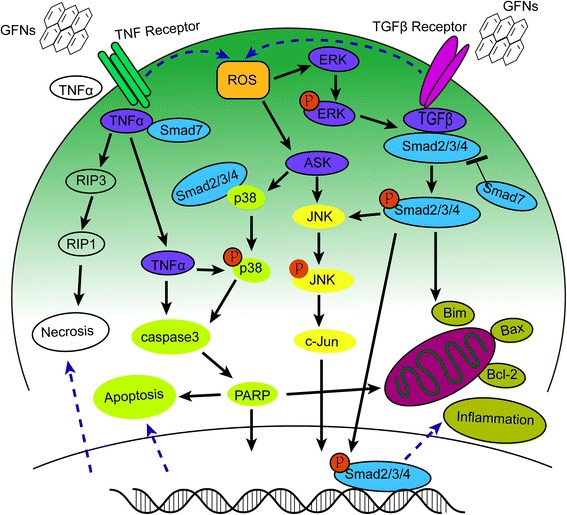
Diagrama esquemático de MAPKs, vias dependentes de TGF-beta e TNF-α envolvidas na toxicidade de GFNs. Os ROS foram os principais fatores que ativaram as vias de sinalização de MAPKs e TGF-beta para levar à ativação de Bim e Bax, desencadeando a cascata de caspases e a via de JNK. A ativação da caspase 3 e RIP1 resultou, finalmente, em apoptose e necrose.
Dano mitocondrial
As mitocôndrias são centros de produção de energia envolvidos em várias vias de sinalização nas células e também são um ponto chave da regulação apoptótica [83]. Após a exposição ao GO e ao ácido carboxílico de grafeno (GXYG), a membrana mitocondrial foi despolarizada e a quantidade de mitocôndrias diminuiu nas células HepG2 [180]. A exposição a GFNs resultou em um aumento significativo do consumo de oxigênio mitocondrial acoplado e desacoplado, dissipação do potencial da membrana mitocondrial e eventual desencadeamento de apoptose pela ativação da via mitocondrial [181]. Por exemplo, o GO aumentou a atividade dos complexos de transporte de elétrons mitocondriais I/III e o fornecimento de elétrons ao local I/II da cadeia de transporte de elétrons, acelerando a geração de ROS durante a respiração mitocondrial em células MHS [99]. A formação de •OH mediada por GO e o sistema de transferência de elétrons do citocromo-c/H2O2 pode aumentar o estresse oxidativo e térmico para prejudicar o sistema de respiração mitocondrial e, eventualmente, resultar em toxicidade dramática [151]. Além disso, as porções de oxigênio no GO podem aceitar elétrons de proteínas redox celulares, apoiando o ciclo redox do citocromo c e proteínas de transporte de elétrons, e os citocromos MtrA, MtrB e MtrC/OmcA podem estar envolvidos na transferência de elétrons para o GO [182]. Portanto, exceto para o dano à membrana plasmática e indução de estresse oxidativo, GFNs podem causar apoptose e/ou necrose celular por influência direta na atividade mitocondrial celular [183, 184].
Dano de DNA
Devido ao seu pequeno tamanho, alta área de superfície e carga superficial, o GO pode possuir propriedades genotóxicas significativas e causar danos graves ao DNA, por exemplo, fragmentação cromossômica, quebras de fita de DNA, mutações pontuais, e adutos oxidativos de DNA e alterações [87, 122, 185, 186]. A mutagênese foi observada em camundongos após injeção intravenosa de GO em uma dose de 20 mg/kg em comparação com a ciclofosfamida (50 mg/kg), um mutagênico clássico [112]. Mesmo que o GO não consiga entrar no núcleo de uma célula, ele ainda pode interagir com o DNA durante a mitose quando a membrana nuclear se quebra, o que aumenta a oportunidade de aberrações de DNA [87, 147, 187, 188]. A interação de empilhamento π entre os anéis de carbono do grafeno e os pares de bases do DNA hidrofóbico pode fazer um segmento de DNA “ficar em pé” ou “assentar” na superfície do grafeno com seu eixo helicoidal perpendicular ou paralelo, respectivamente. As forças intermoleculares deformam gravemente os pares de bases finais do DNA, o que aumenta potencialmente a genotoxicidade [189]. O GO também pode induzir fragmentação cromossômica, adutos de DNA e mutações pontuais, promovendo estresse oxidativo ou desencadeando inflamação por meio da ativação de vias de sinalização intracelular, como MAPK, TGF-β e NF-κB [110, 112, 146]. O Grafeno e o rGO também podem elevar a expressão de p53, Rad51 e MOGG1-1, que refletem dano cromossômico, e diminuir a expressão de CDK2 e CDK4 ao interromper a transição do ciclo celular da fase G1 para a fase S em várias linhas celulares [112]. O dano ao DNA pode não apenas iniciar o desenvolvimento do câncer, mas também possivelmente ameaçar a saúde da próxima geração se o potencial mutagênico do GO surgir nas células reprodutivas, o que afeta a fertilidade e a saúde da prole [112, 190].
Resposta inflamatória
Os GFNs podem causar uma resposta inflamatória significativa, incluindo infiltração de células inflamatórias, edema pulmonar e formação de granuloma em altas doses por meio de instilação intratraqueal ou administração intravenosa [30, 49]. As plaquetas são os componentes importantes na formação do coágulo para atacar patógenos e partículas durante a resposta inflamatória, e o GO poderia ativar diretamente a formação de trombos ricos em plaquetas para obstruir os vasos pulmonares após injeção intravenosa [98, 191]. Uma forte resposta inflamatória foi induzida por injeção subcutânea com GO por 21 dias, juntamente com a secreção de citocinas-chave, incluindo IL-6, IL-12, TNF-α, MCP-1 e IFN-g [34, 192]. Os GFNs podem desencadear uma resposta inflamatória e lesão tecidual ao liberar citocinas e quimiocinas que levam ao recrutamento de monócitos circulantes e estimulam a secreção de citocinas Th1/Th2 e quimiocinas [124, 193]. Além disso, o grafeno puro [193] e o rGO [110] evocam uma resposta inflamatória ao se ligar a receptores toll-like (TLRs) e ativar a via de sinalização NF-κB nas células. A cascata de sinalização do NF-κB é desencadeada por TLRs e citocinas pró-inflamatórias, como IL-1 e TNF-α. Após a ativação, o NF-κB muda do citoplasma para o núcleo, facilitando a ligação do IκB em degradação e agindo como um fator de transcrição para sintetizar numerosas citocinas pró-inflamatórias [194]. Um esquema da via de sinalização de TLR4 e TLR9 ativado por GFNs é mostrado na Fig. 5.
Figura 5
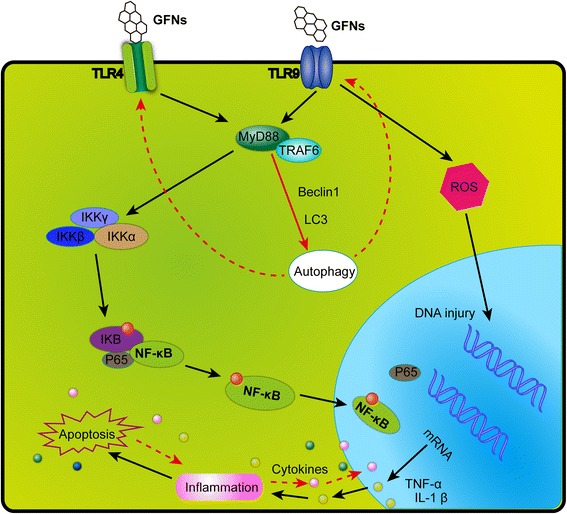
Um diagrama esquemático que elucida a via de sinalização de TLR4 e TLR9 responsável pela citotoxicidade induzida por GFNs. Os GFNs podem ser reconhecidos por TLRs, assim, ativar IKK e IκB por um mecanismo dependente de MyD88, resultando na liberação de subunidades NF-κB e iniciando a translocação para o núcleo. Assim, fatores pró-inflamatórios foram transcritos e secretados fora do núcleo, modulando as respostas imunes iniciando autofagia programada, apoptose e necrose.
Apoptose
A apoptose é definida como a autodestruição de uma célula regulada por genes por meio de programas complicados [83, 195]. O GO e o rGO causaram apoptose e inflamação nos pulmões de camundongos após inalação [99], e GFNs também tiveram efeitos pró-apoptóticos nas células [111, 113, 124, 196]. Além disso, o grafeno e o GO danificaram fisicamente as membranas celulares [166], aumentaram a permeabilização da membrana mitocondrial externa e alteraram o potencial da membrana mitocondrial; o aumento de ROS desencadeou as vias de sinalização de MAPK e TGF-β e ativou a caspase-3 por meio de cascatas apoptóticas mitocondriais dependentes, solicitando a execução de apoptose [83, 99]. Da mesma forma, O rGO causou apoptose em uma dose baixa e em um ponto de tempo precoce, desencadeada pelo receptor de morte e via mitocondrial canônica [110]. Outro estudo mostrou três diferentes vias de apoptose por GFNs: o GO levou à apoptose dependente de ROS por meio da interação direta com receptores de proteína e subsequente ativação da via do linfoma-2 de células B (Bcl-2); o GO-COOH transmitiu um sinal passivo de apoptose ao DNA nuclear ligando-se a receptores de proteínas e ativando uma via independente de ROS; No entanto, o GO-PEI danificou gravemente as membranas dos linfócitos T para desencadear a apoptose [105, 197].
Autofagia
Autofagia é o processo de autodegradação de componentes celulares e recentemente reconhecido como morte celular não apoptótica [198–200]. A ativação da autofagia requer a formação do autofagossoma contendo Beclin 1, várias proteínas relacionadas à autofagia (ATG), cadeia leve de proteína associada a microtúbulos 3 (LC3) e p62 [201]. O acúmulo do autofagossoma está associado à exposição a várias nanopartículas [202–205], e a autofagia pode remover organismos extracelulares e destruir os organismos no citosol [206]. O GO e os GQDs mostraram que induzem o acúmulo do autofagossoma e a conversão de LC3-I em LC3-II; inibir a degradação do substrato autofágico da proteína p62 [207, 208]. Além disso, o GO pode desencadear simultaneamente respostas de TLR4 e TLR9 em macrófagos [34, 192] e células de câncer de cólon CT26 [206]. A via da autofagia está ligada à fagocitose pela sinalização de TLR em macrófagos [206, 209].
Necrose
A necrose é uma forma alternativa de morte celular induzida por respostas inflamatórias ou lesão celular. A exposição das células ao grafeno puro causa apoptose e necrose em altas doses (50 mg/mL) [83]. Alegadamente, o vazamento de LDH e a abertura do poro de transição da permeabilidade mitocondrial, induzidos por nível elevado de Ca2+ citoplasmático, levam à apoptose/necrose [210]. Foi revelado que o tratamento com GO induz a necrose macrofágica ao ativar a sinalização de TLR4 e, subsequentemente, desencadear parcialmente a produção de TNF-α autócrino [93]. O GO combinado com CDDP (GO/CDDP) desencadeou necrose diminuindo o RIP1 e aumentando as proteínas RIP3, acompanhada com a liberação do grupo de alta mobilidade B1 (HMGB1) no citosol do núcleo e fora das células CT26 [205, 211, 212].
Mudanças epigenéticas
A epigenética envolve metilação do DNA, impressão genômica, efeitos maternos, silenciamento de genes e edição de RNA [213-215]. A metilação do DNA, que é uma das modificações epigenéticas mais bem estudadas, inclui fosforilação, ubiquitinação e ribosilação do ADP e pode levar à remodelação da cromatina [197, 216, 217]. Um artigo recente relatou que a exposição ao SL-GO/FL-GO resultou em hipermetilação global do DNA por meio da regulação positiva dos genes DNMT3B e MBD1; O tratamento com GNP causou hipometilação ao diminuir a expressão dos genes DNMT3B e MBD1 [216]. O GO poderia ativar a via de regulação do miRNA-360 para suprimir a cascata de sinalização de dano ao DNA-apoptose, afetando o componente do CEP-1 [218]. Tomados em conjunto, esses dados sugerem que os GFNs podem causar mudanças sutis na programação da expressão gênica por meio da modulação das mudanças epigenéticas. No entanto, os estudos de alterações epigenéticas induzidas por GFNs são poucos, e o mecanismo epigenético causado pela exposição de GFNs não é totalmente compreendido.
Para concluir, muitos estudos discutiram mecanismos representativos da toxicidade de GFNs envolvendo quatro vias de sinalização: TLRs, TGF-β, TNF-α e MAPKs. Essas quatro vias de sinalização são correlativas e modulatórias cruzadas, tornando a resposta inflamatória, autofagia, apoptose e outros mecanismos independentes e ainda conectados entre si. Além disso, o estresse oxidativo parece desempenhar o papel mais importante na ativação dessas vias de sinalização. Foi relatado que há interseções de apoptose, autofagia e necrose nos estudos de toxicidade de outros nanomateriais, que inibem ou se promovem mutuamente em algumas condições. No entanto, as vias de sinalização da toxicidade de GFNs investigadas em documentos até o momento são apenas uma pequena parte de uma rede intrincada, e a rede de vias de sinalização precisa ser explorada em detalhes no futuro.
LACUNAS DE DADOS E ESTUDOS FUTUROS
Atualmente, a literatura é insuficiente para tirar conclusões sobre os perigos potenciais de GFNs. Duas opiniões opostas começaram a emergir: alguns pesquisadores sugeriram que os materiais de grafeno são biocompatíveis em uma série de estudos focados em aplicações biomédicas [119, 154, 162, 219], e outros estudos relataram respostas biológicas adversas e citotoxicidade [32, 118, 135, 138, 192]. Esses resultados inconsistentes podem ter sido causados por vários fatores, incluindo os diferentes grupos de pesquisa, vários modelos celulares ou animais e várias caracterizações físico-químicas de GFNs. Quando os GFNs são explorados para aplicações in vivo no corpo humano ou algumas outras aplicações biomédicas, a biocompatibilidade deve ser considerada e estudos mais detalhados e precisos da toxicidade dos GFNs são necessários.
Em primeiro lugar, a caracterização físico-química detalhada é imperativa em todos os estudos futuros de toxicidade de GFNs. Nos experimentos, as descrições de recursos de GFNs devem incluir seu tamanho, morfologia, área de superfície, carga, modificações de superfície, pureza e aglomeração [88, 141, 148, 162]. Como esses fatores físico-químicos influenciam amplamente a toxicidade e biocompatibilidade dos GFNs, projetos experimentais de fator único e a exclusão de outros fatores de interferência devem ser considerados. Detalhes do processo de fabricação também devem ser fornecidos porque os detritos oxidativos formados podem alterar amplamente a estrutura da superfície do grafeno e do GO durante a funcionalização [151]. É importante ressaltar que um único método universal precisa ser estabelecido na tecnologia do grafeno, o que permitirá uma melhor comparação de dados de diferentes estudos ou diferentes laboratórios.
Em segundo lugar, diferentes critérios de observação, parâmetros e seleção de métodos experimentais podem induzir grandes variações interlaboratoriais [220, 221]. Por exemplo, o ensaio MTT sempre falha em prever com precisão a toxicidade do grafeno porque a redução espontânea resulta em um sinal falso positivo. Portanto, avaliações alternativas apropriadas devem ser utilizadas, como o reagente de sal de tetrazólio solúvel em água (WST-8), ensaio de ROS e teste de exclusão de azul de tripano [106, 222]. Além disso, o ensaio de eletroforese em gel de célula única frequentemente mostra níveis mais elevados de danos ao DNA do que o ensaio do micronúcleo porque o primeiro mede a lesão reparável e o último mede o dano ao gene que permanece após a divisão celular [159,223]. Portanto, é necessário cautela na escolha do ensaio mais apropriado para avaliar a toxicidade dos materiais de grafeno para evitar resultados falso-positivos.
Terceiro, a seleção de linhas de células é de vital importância porque as linhas de células cancerosas tendem a ser sensíveis ou resistentes, dependendo de seu histórico genético. As mesmas nanopartículas de grafeno podem causar reações diferentes dependendo de suas várias origens celulares. Devem ser utilizadas linhas celulares adequadas com boa estabilidade para evitar resultados falsos positivos ou negativos. Células primárias derivadas de humanos ou animais podem simular melhor as condições de saúde dos humanos. Uma grande quantidade de células primárias foi utilizada para testar a toxicidade de outros nanomateriais [224-228], mas a cultura de células primárias é extremamente rara nos experimentos com GFNs até o momento [210, 229]. Vários experimentos com células combinadas com células primárias devem ser realizados para avaliar de forma abrangente as propriedades físico-químicas e a toxicidade dos GFNs.
Em quarto lugar, a via de administração de GFNs desempenha um papel muito importante nos estudos de toxicidade, e diferentes métodos de entrega resultarão em diferentes reações toxicológicas [32, 53]. Assim, a via e o período de exposição devem ser escolhidos criteriosamente de acordo com o objetivo do estudo. A administração nasal de drogas é frequentemente usada para estudar a neurotoxicidade dos nanomateriais [230, 231], mas este método de administração raramente foi aplicado no teste de toxicidade de GFNs. Os estudos toxicológicos de GFNs no sistema nervoso são raros e o mecanismo não é claro e precisa ser mais estudado no futuro. Estudos recentes de toxicocinética envolvendo a absorção, distribuição, metabolismo, acúmulo e excreção de GFNs através de diferentes vias de exposição produziram alguns resultados, mas estão longe de ser suficientes para esclarecer os mecanismos do complexo interno. Por exemplo, mais estudos são necessários para entender os mecanismos moleculares específicos dos GFNs que passam pelas barreiras fisiológicas e a quantidade de acúmulo ou período de excreção dos GFNs nos tecidos. Além disso, dada a maior exposição de humanos aos GFNs, a avaliação da toxicidade sistêmica no corpo humano é indispensável em estudos futuros.
Quinto, outra questão importante que requer atenção é o destino a longo prazo dos GFNs após entrarem no corpo ou serem absorvidos pelas células. Os estudos mais recentes consistiram em avaliações de toxicidade de curto prazo [89, 232], e a lesão tóxica de longo prazo não recebeu muita atenção desde a aplicação generalizada de GFNs em 2008. Além disso, uma superfície de grafeno funcionalizada pode melhorar sua biocompatibilidade, mas a estabilidade a longo prazo dos revestimentos de superfície deve ser considerada [233]. Se os revestimentos de superfície eventualmente se decomporem, sua toxicidade pode ser significativamente diferente dos resultados de exposição de curto prazo. Estudos estendidos são necessários para determinar se tempos de tratamento mais longos influenciam o potencial nanotóxico dos GFNs.
Sexto, vias de sinalização mais específicas no mecanismo de toxicidade de GFNs precisam ser descobertas e elucidadas. Atualmente, vários mecanismos de toxicidade típicos de GFNs foram ilustrados e amplamente aceitos, como estresse oxidativo, apoptose e autofagia. No entanto, esses mecanismos foram descritos apenas em termos gerais, e as vias de sinalização específicas dentro desses mecanismos precisam ser investigadas em detalhes. As vias de sinalização envolvidas na toxicidade de outros nanomateriais também podem ser relevantes para o estudo de GFNs. Portanto, mais vias de sinalização devem ser detectadas em pesquisas futuras. Por exemplo, a nanoepigenética foi considerada em vários estudos de nanomateriais, o que também é útil na avaliação da toxicidade limitada e dos efeitos colaterais dos GFNs. Estudos recentes demonstraram que os GFNs podem causar alterações epigenéticas e genômicas que podem estimular a toxicidade física e a carcinogenicidade [234]. Os GFNs têm áreas de superfície altas, superfícies lisas contínuas e bio-persistência, semelhantes às propriedades dos implantes de estado sólido tumorigênicos. Não se sabe se os GFNs têm potencial para induzir sarcomas de corpo estranho e, portanto, estudos definitivos das potencialidades tumorais ou riscos do grafeno devem ser realizados o mais rápido possível.
CONCLUSÕES
Nos últimos anos, os GFNs têm sido amplamente utilizados em uma ampla variedade de campos tecnológicos e biomédicos. Atualmente, a maioria dos experimentos tem como foco a toxicidade dos GFNs nos pulmões e no fígado. Portanto, estudos de lesão cerebral ou neurotoxicidade merecem mais atenção no futuro. Muitos experimentos mostraram que os GFNs têm efeitos colaterais tóxicos em muitas aplicações biológicas, mas o estudo aprofundado dos mecanismos de toxicidade é urgentemente necessário. Além disso, resultados contrastantes em relação à toxicidade de GFNs precisam ser tratados por métodos experimentais eficazes e estudos sistemáticos. Esta revisão fornece uma visão geral da toxicidade de GFNs, resumindo a toxicocinética, mecanismos de toxicidade e fatores de influência e objetivou fornecer informações para facilitar a pesquisa completa sobre hemo e biocompatibilidade in vitro e in vivo de GFNs no futuro. Esta revisão ajudará a abordar questões de segurança antes das aplicações clínicas e terapêuticas de GFNs, que serão importantes para o desenvolvimento de GFNs em aplicações biológicas.
RECONHECIMENTOS
Não aplicável.
Financiamento
Esta revisão foi apoiada pela Fundação Nacional de Ciência Natural da China (81550011, 51172283, 81400557), Fundação de Ciência Natural da Província de Guangdong (2015A030313299) e Fundação de Pesquisa Médica da Província de Guangdong (A2016360).
Disponibilidade de dados e materiais
Bancos de dados/repositórios e materiais não são aplicáveis nesta revisão.
Contribuições dos autores
Todos os autores contribuíram para a concepção deste artigo. LO redigiu o manuscrito. BS e JL revisaram criticamente o manuscrito. Todos os autores leram e aprovaram o manuscrito final.
Conflitos de interesses
Os autores declaram não ter interesses conflitantes.
Consentimento para publicação
Não aplicável.
Aprovação ética e consentimento para participar
Não aplicável.
ABREVIAÇÕES
Ams – Macrófagos alveolares
BBB – Barreira hematoencefalica
BEB – Barreiras de sangue-epidídimo
BTB – Barreira sangue-testículo
CR – Receptor de complemento
FcgR – Receptor Fcg
FLG – Grafeno de poucas camadas
GFNs – Nanomateriais da família do grafeno
GNS – Nanofolhas de grafeno
VAI – Óxido de grafeno
GO-COOH – Óxido de grafeno carboxilado
GO-DEX – GO-dextran
GO-MB – Guia molecular de GO
GO-NH2 – GO Aminado
GO-PAA – GO funcionalizado com poli (ácido acrílico)
GO-PAM – GO funcionalizado com poli (acrilamida)
GO-PEG – Derivados PEGuilados de GO
GO-PEI – GO-polietilenimina
GQDs – Pontos quânticos de grafeno
GSH-PX – Glutationa peroxidase
GXVG – Ácido Carboxílico de Grafeno
LDH – Lactato e desidrogenase
MALDI – Dessorção/ionização de laser assistida por matriz
MAPKs – Proteína quinase ativada por mitogênio
MDA – Malondialdeído
MØ – Macrófago
SENHOR – Receptor de manose
MSI – Imagens de espectrometria de massa
Células PC12 – Células de feocromocitoma de rato
PCGO – Nanopartículas de óxido de grafeno revestidas de proteína
PrGO – Óxido de grafeno reduzido PEGuilado
RES – Sistema reticuloendotelial
rGO – Óxido de grafeno reduzido
ROS – Espécies que reagem ao oxigênio
SOD – Superoxido dismutação
TLRs – Receptor Toll-like
INFORMAÇÃO DO CONTRIBUIDOR
Lingling Ou, Email: moc.621@321gnilgniluo
Bin Song, e-mail: moc.qq@42255071
Huimin Liang, Email: moc.qq@987576304
Jia Liu, Email: moc.qq@108897244
Xiaoli Feng, e-mail: moc.qq@830077768
Bin Deng, e-mail: moc.qq@502657727
Ting Sun, e-mail: moc.qq@916454243
Longquan Shao, Email: nc.ude.ums@nauqgnoloahs
REFERÊNCIAS
1- Novoselov KS, Geim AK, Morozov SV, Jiang D, Zhang Y, Dubonos SV, et al. Electric field effect in atomically thin carbon films. Science. 2004;306(5696):666–9. doi: 10.1126/science.1102896. [PubMed] [CrossRef] [Google Scholar]
2- Sanchez VC, Jachak A, Hurt RH, Kane AB. Biological interactions of graphene-family nanomaterials: an interdisciplinary review. Chem Res Toxicol. 2012;25(1):15–34. doi: 10.1021/tx200339h. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
3- Yang XY, Wang YS, Huang X, Ma YF, Huang Y, Yang RC, et al. Multi-functionalized graphene oxide based anticancer drug-carrier with dual-targeting function and pH-sensitivity. J Mat Chem. 2011;21(10):3448–54. doi: 10.1039/C0JM02494E. [CrossRef] [Google Scholar]
4- Park S, An J, Jung I, Piner RD, An SJ, Li X, et al. Colloidal suspensions of highly reduced graphene oxide in a wide variety of organic solvents. Nano Lett. 2009;9(4):1593–7. doi: 10.1021/nl803798y. [PubMed] [CrossRef] [Google Scholar]
5- Geim AK. Graphene: status and prospects. Science. 2009;324(5934):1530–4. doi: 10.1126/science.1158877. [PubMed] [CrossRef] [Google Scholar]
6- Guo X, Mei N. Assessment of the toxic potential of graphene family nanomaterials. J Food Drug Anal. 2014;22(1):105–15. doi: 10.1016/j.jfda.2014.01.009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7- Seabra AB, Paula AJ, de Lima R, Alves OL, Duran N. Nanotoxicity of graphene and graphene oxide. Chem Res Toxicol. 2014;27(2):159–68. doi: 10.1021/tx400385x. [PubMed] [CrossRef] [Google Scholar]
8- Shen H, Zhang L, Liu M, Zhang Z. Biomedical applications of graphene. Theranostics. 2012;2(3):283–94. doi: 10.7150/thno.3642. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9- Han U, Seo Y, Hong J. Effect of pH on the structure and drug release profiles of layer-by-layer assembled films containing polyelectrolyte, micelles, and graphene oxide. Sci Rep. 2016;6(2045–2322 (Electronic)):24158. doi: 10.1038/srep24158. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
10- Wang H, Liang Y, Mirfakhrai T, Chen Z, Casalongue HS, Dai H. Advanced asymmetrical supercapacitors based on graphene hybrid materials. Nano Res. 2011;4(8):729–36. doi: 10.1007/s12274-011-0129-6. [CrossRef] [Google Scholar]
11- Loh KP, Bao Q, Eda G, Chhowalla M. Graphene oxide as a chemically tunable platform for optical applications. Nat Chem. 2010;2(12):1015–24. doi: 10.1038/nchem.907. [PubMed] [CrossRef] [Google Scholar]
12- Wang D, Zhu L, Chen JF, Dai L. Mn3O4-graphene hybrid as a high-capacity anode material for lithium ion batteries. J Am Chem Soc. 2015;132(1520–5126 (Electronic)):13978–80. [PubMed] [Google Scholar]
13- Gurunathan S, Han JW, Dayem AA, Eppakayala V, Kim JH. Oxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosa. Int J Nanomed. 2012;7(1178–2013 (Electronic)):e14. [PMC free article] [PubMed] [Google Scholar]
14- Zhan S, Zhu D, Ma S, Yu W, Jia Y, Li Y, et al. Highly efficient removal of pathogenic bacteria with magnetic graphene composite. ACS Appl Mater Interf. 2015;7(1944–8252 (Electronic)):4290–8. doi: 10.1021/am508682s. [PubMed] [CrossRef] [Google Scholar]
15- Yang HW, Hua MY, Chen SL, Tsai RY. Reusable sensor based on high magnetization carboxyl-modified graphene oxide with intrinsic hydrogen peroxide catalytic activity for hydrogen peroxide and glucose detection. Biosens Bioelectron. 2013;41:172–9. doi: 10.1016/j.bios.2012.08.008. [PubMed] [CrossRef] [Google Scholar]
16- Wang Y, Yuan R, Chai Y, Yuan Y, Bai L. In situ enzymatic silver enhancement based on functionalized graphene oxide and layer-by-layer assembled gold nanoparticles for ultrasensitive detection of thrombin. Biosens Bioelectron. 2012;38(1):50–4. doi: 10.1016/j.bios.2012.04.046. [PubMed] [CrossRef] [Google Scholar]
17- Huang J, Zhang L, Liang RP, Qiu JD. “On-off” switchable electrochemical affinity nanobiosensor based on graphene oxide for ultrasensitive glucose sensing. Biosens Bioelectron. 2013;41:430–5. doi: 10.1016/j.bios.2012.09.007. [PubMed] [CrossRef] [Google Scholar]
18- Gao L, Lian C, Zhou Y, Yan L, Li Q, Zhang C, et al. Graphene oxide-DNA based sensors. Biosens Bioelectron. 2014;60(1873–4235 (Electronic)):22–9. doi: 10.1016/j.bios.2014.03.039. [PubMed] [CrossRef] [Google Scholar]
19- Chen ML, Liu JW, Hu B, Chen ML, Wang JH. Conjugation of quantum dots with graphene for fluorescence imaging of live cells. Analyst. 2011;136(20):4277–83. doi: 10.1039/c1an15474e. [PubMed] [CrossRef] [Google Scholar]
20- Wang Y, Wang H, Liu D, Song S, Wang X, Zhang H. Graphene oxide covalently grafted upconversion nanoparticles for combined NIR mediated imaging and photothermal/photodynamic cancer therapy. Biomaterials. 2013;34(1878–5905 (Electronic)):7715–24. doi: 10.1016/j.biomaterials.2013.06.045. [PubMed] [CrossRef] [Google Scholar]
21- Pan Y, Sahoo NG, Li L. The application of graphene oxide in drug delivery. Expert Opin Drug Deliv. 2012;9(11):1365–76. doi: 10.1517/17425247.2012.729575. [PubMed] [CrossRef] [Google Scholar]
22- Huiyun W, Chunyan D, Haiqing D, Aijun S, Wenjuan X, Xiaojun C, et al. Engineered redox-responsive PEG detachment mechanism in PEGylated nano-graphene oxide for intracellular drug delivery. Small. 2012;8(5):760–9. doi: 10.1002/smll.201101613. [PubMed] [CrossRef] [Google Scholar]
23- Yang X, Qiu L, Cheng C, Wu Y, Ma ZF, Li D. Ordered gelation of chemically converted graphene for next-generation electroconductive hydrogel films. Angewandte Chem Int Ed Engl. 2011;50(32):7325–8. doi: 10.1002/anie.201100723. [PubMed] [CrossRef] [Google Scholar]
24- Schinwald A, Murphy FA, Jones A, Macnee W, Donaldson K. Graphene-based nanoplatelets: a new risk to the respiratory system as a consequence of their unusual aerodynamic properties. ACS Nano. 2012;6(1):736–46. doi: 10.1021/nn204229f. [PubMed] [CrossRef] [Google Scholar]
25- Chaenyung C, Ryon SS, Xiguang G, Nasim A, Dokmeci MR, Xiaowu Shirley T, et al. Controlling mechanical properties of cell-laden hydrogels by covalent incorporation of graphene oxide. Small. 2014;10(3):514–23. doi: 10.1002/smll.201302182. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26- Arvidsson R, Molander S, Sandén BA. Review of potential environmental and health risks of the nanomaterial graphene. Hum Ecol Risk Assess. 2013;19(4):873–87. [Google Scholar]
27- Lee JH, Han JH, Kim JH, Kim B, Bello D, Kim JK, et al. Exposure monitoring of graphene nanoplatelets manufacturing workplaces. Inhal Toxicol. 2016;28(6):281–91. doi: 10.3109/08958378.2016.1163442. [PubMed] [CrossRef] [Google Scholar]
28- Maynard RL. Nano-technology and nano-toxicology. Emerg Health Threats J. 2012;5. [PMC free article] [PubMed]
29- Su WC, Ku BK, Kulkarni P, Cheng YS. Deposition of graphene nanomaterial aerosols in human upper airways. J Occup Environ Hyg. 2015;13(1):1–34. [PMC free article] [PubMed] [Google Scholar]
30- Li B, Yang J, Huang Q, Zhang Y, Peng C, Zhang Y, et al. Biodistribution and pulmonary toxicity of intratracheally instilled graphene oxide in mice. NPG Asia Mater. 2013;5:E44. doi: 10.1038/am.2013.7. [CrossRef] [Google Scholar]
31- Yang K, Gong H, Shi X, Wan J, Zhang Y, Liu Z. In vivo biodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administration. Biomaterials. 2013;34(11):2787–95. doi: 10.1016/j.biomaterials.2013.01.001. [PubMed] [CrossRef] [Google Scholar]
32- Wen KP, Chen YC, Chuang CH, Chang HY, Lee CY, Tai NH. Accumulation and toxicity of intravenously-injected functionalized graphene oxide in mice. J Appl Toxicol. 2015;35(10):1211–8. doi: 10.1002/jat.3187. [PubMed] [CrossRef] [Google Scholar]
33- Kurantowicz N, Strojny B, Sawosz E, Jaworski S, Kutwin M, Grodzik M, et al. Biodistribution of a high dose of diamond, graphite, and graphene oxide nanoparticles after multiple intraperitoneal injections in rats. Nanoscale Res Lett. 2015;10(1):398. doi: 10.1186/s11671-015-1107-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34- Yue H, Wei W, Yue Z, Wang B, Luo N, Gao Y, et al. The role of the lateral dimension of graphene oxide in the regulation of cellular responses. Biomaterials. 2012;33(16):4013–21. doi: 10.1016/j.biomaterials.2012.02.021. [PubMed] [CrossRef] [Google Scholar]
35- Nezakati T, Cousins BG, Seifalian AM. Toxicology of chemically modified graphene-based materials for medical application. Arch Toxicol. 2014;88(11):1987–2012. doi: 10.1007/s00204-014-1361-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
36- Chng ELK, Pumera M. Toxicity of graphene related materials and transition metal dichalcogenides. Rsc Advances. 2015;5(4):3074–80. doi: 10.1039/C4RA12624F. [CrossRef] [Google Scholar]
37- Zheng XT, Ananthanarayanan A, Luo KQ, Chen P. Glowing graphene quantum dots and carbon dots: properties, syntheses, and biological applications. Small. 2015;11(1613–6829 (Electronic)):1620–36. doi: 10.1002/smll.201402648. [PubMed] [CrossRef] [Google Scholar]
38- Caffo M, Merlo L, Marino D, Caruso G. Graphene in neurosurgery: the beginning of a new era. Nanomed. 2015;10:615–25. doi: 10.2217/nnm.14.195. [PubMed] [CrossRef] [Google Scholar]
39- Wu SY, An SS, Hulme J. Current applications of graphene oxide in nanomedicine. Int J Nanomed. 2015;10(Spec Iss):9–24. [PMC free article] [PubMed] [Google Scholar]
40- Tonelli FMP, Goulart VAM, Gomes KN, Ladeira MS, Santos AK, Lorencon E, et al. Graphene-based nanomaterials: biological and medical applications and toxicity. Nanomedicine. 2015;10(15):2423–50. doi: 10.2217/nnm.15.65. [PubMed] [CrossRef] [Google Scholar]
41- Zhou R, Gao H. Cytotoxicity of graphene: recent advances and future perspective. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 2014;6(5):452–74. doi: 10.1002/wnan.1277. [PubMed] [CrossRef] [Google Scholar]
42- Ema M, Hougaard KS, Kishimoto A, Honda K. Reproductive and developmental toxicity of carbon-based nanomaterials: A literature review. Nanotoxicology. 2015;10:391–412. doi: 10.3109/17435390.2015.1073811. [PubMed] [CrossRef] [Google Scholar]
43- Jastrzebska AM, Olszyna AR. The ecotoxicity of graphene family materials: current status, knowledge gaps and future needs. J Nanopart Res. 2015;17(1):1–21. doi: 10.1007/s11051-014-2817-0. [CrossRef] [Google Scholar]
44- Xu S, Zhang Z, Chu M. Long-term toxicity of reduced graphene oxide nanosheets: Effects on female mouse reproductive ability and offspring development. Biomaterials. 2015;54:188–200. doi: 10.1016/j.biomaterials.2015.03.015. [PubMed] [CrossRef] [Google Scholar]
45- Jennifer M, Maciej W. Nanoparticle technology as a double-edged sword: cytotoxic, genotoxic and epigenetic effects on living cells. J Biomater Nanobiotechnol. 2013;4:53–63. doi: 10.4236/jbnb.2013.41008. [CrossRef] [Google Scholar]
46- Wu W, Yan L, Wu Q, Li Y, Li Q, Chen S, et al. Evaluation of the toxicity of graphene oxide exposure to the eye. Nanotoxicology. 2016;10(9):1329–40. doi: 10.1080/17435390.2016.1210692. [PubMed] [CrossRef] [Google Scholar]
47- Lee K, Jeong Y, Bae J, Seok H, Yang Y, Roh S, et al. The role of surface functionalization on the pulmonary inflammogenicity and translocation into mediastinal lymph nodes of graphene nanoplatelets in rats. Arch Toxicol.2016:1–10. [PubMed]
48- Schinwald A, Murphy F, Askounis A, Koutsos V, Sefiane K, Donaldson K, et al. Minimal oxidation and inflammogenicity of pristine graphene with residence in the lung. Nanotoxicology. 2013;8(8):824–32. doi: 10.3109/17435390.2013.831502. [PubMed] [CrossRef] [Google Scholar]
49- Zhang X, Yin J, Peng C, Hu W, Zhu Z, Li W, et al. Distribution and biocompatibility studies of graphene oxide in mice after intravenous administration. Carbon. 2011;49(3):986–95. doi: 10.1016/j.carbon.2010.11.005. [CrossRef] [Google Scholar]
50- Singh SK, Singh MK, Nayak MK, Kumari S, Shrivastava S, Gracio JJ, et al. Thrombus inducing property of atomically thin graphene oxide sheets. ACS Nano. 2011;5(6):4987–96. doi: 10.1021/nn201092p. [PubMed] [CrossRef] [Google Scholar]
51- Gurunathan S, Han JW, Eppakayala V, Kim JH. Biocompatibility of microbially reduced graphene oxide in primary mouse embryonic fibroblast cells. Colloids Surf B Biointerf. 2013;105:58–66. doi: 10.1016/j.colsurfb.2012.12.036. [PubMed] [CrossRef] [Google Scholar]
52- Yang K, Wan J, Zhang S, Zhang Y, Lee ST, Liu Z. In vivo pharmacokinetics, long-term biodistribution, and toxicology of PEGylated graphene in mice. ACS Nano. 2011;5(1):516–22. doi: 10.1021/nn1024303. [PubMed] [CrossRef] [Google Scholar]
53- Fu C, Liu T, Li L, Liu H, Liang Q, Meng X. Effects of graphene oxide on the development of offspring mice in lactation period. Biomaterials. 2015;40:23–31. doi: 10.1016/j.biomaterials.2014.11.014. [PubMed] [CrossRef] [Google Scholar]
54- Hu Q, Jiao B, Shi X, Valle RP, Zuo YY, Hu G. Effects of graphene oxide nanosheets on the ultrastructure and biophysical properties of the pulmonary surfactant film. Nanoscale. 2015;7(43):18025–9. doi: 10.1039/C5NR05401J. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
55- Gosens I, Post JA, de la Fonteyne LJ, Jansen EH, Geus JW, Cassee FR, et al. Impact of agglomeration state of nano- and submicron sized gold particles on pulmonary inflammation. Part Fibre Toxicol. 2010;7(1743–8977 (Electronic)):1. [PMC free article] [PubMed] [Google Scholar]
56- Geiser M, Kreyling WG. Deposition and biokinetics of inhaled nanoparticles. Part Fibre Toxicol. 2010;7:2. doi: 10.1186/1743-8977-7-2. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
57- Ruge CA, Schaefer UF, Herrmann J, Kirch J, Canadas O, Echaide M, et al. The interplay of lung surfactant proteins and lipids assimilates the macrophage clearance of nanoparticles. PLoS One. 2012;7(7):e40775. doi: 10.1371/journal.pone.0040775. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
58- Morfeld P, Treumann S, Ma-Hock L, Bruch J, Landsiedel R. Deposition behavior of inhaled nanostructured TiO2 in rats: fractions of particle diameter below 100 nm (nanoscale) and the slicing bias of transmission electron microscopy. Inhal Toxicol. 2012;24(1091–7691 (Electronic)):939–51. doi: 10.3109/08958378.2012.738256. [PubMed] [CrossRef] [Google Scholar]
59- Wiemann M, Vennemann A, Sauer UG, Wiench K, Ma-Hock L, Landsiedel R. An in vitro alveolar macrophage assay for predicting the short-term inhalation toxicity of nanomaterials. J Nanobiotechnol. 2016;14(1477–3155 (Electronic)):1. [Google Scholar]
60- Kreyling WG, Semmler-Behnke M, Takenaka S, Möller W. Differences in the biokinetics of inhaled nano- versus micrometer-sized particles. Accounts Chem Res. 2012;46(1520–4898 (Electronic)):714–22. [PMC free article] [PubMed] [Google Scholar]
61- Liang M, Hu M, Pan B, Xie Y, Petersen EJ. Biodistribution and toxicity of radio-labeled few layer graphene in mice after intratracheal instillation. Part Fibre Toxicol. 2016;13(1):1–12. [PMC free article] [PubMed] [Google Scholar]
62- Abbott NJ, Patabendige AA, Dolman DE, Yusof SR, Begley DJ. Structure and function of the blood–brain barrier. Neurobiol Dis. 2010;37(1):13–25. doi: 10.1016/j.nbd.2009.07.030. [PubMed] [CrossRef] [Google Scholar]
63- Mendonca MC, Soares ES, de Jesus MB, Ceragioli HJ, Ferreira MS, Catharino RR, et al. Reduced graphene oxide induces transient blood–brain barrier opening: an in vivo study. J Nanobiotechnol. 2015;13:78. doi: 10.1186/s12951-015-0143-z. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
64- Liu Y, Xu LP, Dai W, Dong H, Wen Y, Zhang X. Graphene quantum dots for the inhibition of beta amyloid aggregation. Nanoscale. 2015;7(45):19060–5. doi: 10.1039/C5NR06282A. [PubMed] [CrossRef] [Google Scholar]
65- Mital P, Hinton BT, Dufour JM. The blood-testis and blood-epididymis barriers are more than just their tight junctions. Biol Reprod. 2011;84(5):851–8. doi: 10.1095/biolreprod.110.087452. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66- Liang S, Xu S, Zhang D, He J, Chu M. Reproductive toxicity of nanoscale graphene oxide in male mice. Nanotoxicology. 2015;9(1):92–105. doi: 10.3109/17435390.2014.893380. [PubMed] [CrossRef] [Google Scholar]
67- Buerkithurnherr T, Von MU, Wick P. Knocking at the door of the unborn child: engineered nanoparticles at the human placental barrier. Swiss Med Wkly. 2012;142:w13559. [PubMed] [Google Scholar]
68- Yang H, Sun C, Fan Z, Tian X, Yan L, Du L, et al. Effects of gestational age and surface modification on materno-fetal transfer of nanoparticles in murine pregnancy. Sci Rep. 2012;2(46):847. [PMC free article] [PubMed] [Google Scholar]
69- Huang X, Zhang F, Sun X, Choi KY, Niu G, Zhang G, et al. The genotype-dependent influence of functionalized multiwalled carbon nanotubes on fetal development. Biomaterials. 2014;35(2):856–65. doi: 10.1016/j.biomaterials.2013.10.027. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
70- Qi W, Bi J, Zhang X, Wang J, Wang J, Liu P, et al. Damaging effects of multi-walled carbon nanotubes on pregnant mice with different pregnancy times. Sci Rep. 2014;4(3):doi: 10.1038/srep04352. [PMC free article] [PubMed]
71- Du J, Wang S, You H, Jiang R, Zhuang C, Zhang X. Developmental toxicity and DNA damage to zebrafish induced by perfluorooctane sulfonate in the presence of ZnO nanoparticles. Environ Toxicol. 2014;31(1522–7278 (Electronic)):360–71. [PubMed] [Google Scholar]
72- Zhou Z, Son J, Harper B, Zhou Z, Harper S. Influence of surface chemical properties on the toxicity of engineered zinc oxide nanoparticles to embryonic zebrafish. Beilstein J Nanotechnol. 2015;6(2190–4286 (Electronic)):1568–79. doi: 10.3762/bjnano.6.160. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
73- Rollerova E, Tulinska J, Liskova A, Kuricova M, Kovriznych J, Mlynarcikova A, et al. Titanium dioxide nanoparticles: some aspects of toxicity/focus on the development. Endocr Reg. 2014;49(1210–0668 (Print)):97–112. [PubMed] [Google Scholar]
74- Warheit DB, Boatman R, Brown SC. Developmental toxicity studies with 6 forms of titanium dioxide test materials (3 pigment-different grade & 3 nanoscale) demonstrate an absence of effects in orally-exposed rats. Reg Toxicol Pharmacol. 2015;73(1096–0295 (Electronic)):887–96. doi: 10.1016/j.yrtph.2015.09.032. [PubMed] [CrossRef] [Google Scholar]
75- Ema M, Gamo M, Honda K. Developmental toxicity of engineered nanomaterials in rodents. Toxicol Appl Pharmacol. 2015;299(1096–0333 (Electronic)):47–52. [PubMed] [Google Scholar]
76- Li Z, Geng Y, Zhang X, Qi W, Fan Q, Li Y, et al. Biodistribution of co-exposure to multi-walled carbon nanotubes and graphene oxide nanoplatelets radiotracers. J Nanopart Res. 2011;13(7):2939–47. doi: 10.1007/s11051-010-0175-0. [CrossRef] [Google Scholar]
77- Wang Y, Li Z, Hu D, Lin CT, Li J, Lin Y. Aptamer/graphene oxide nanocomplex for in situ molecular probing in living cells. J Am Chem Soc. 2010;132(27):9274–6. doi: 10.1021/ja103169v. [PubMed] [CrossRef] [Google Scholar]
78- Liu JH, Yang ST, Wang H, Chang Y, Cao A, Liu Y. Effect of size and dose on the biodistribution of graphene oxide in mice. Nanomedicine. 2012;7(12):1801–12. doi: 10.2217/nnm.12.60. [PubMed] [CrossRef] [Google Scholar]
79- Zhang S, Yang K, Feng L, Liu Z. In vitro and in vivo behaviors of dextran functionalized graphene. Carbon. 2011;49(12):4040–9. doi: 10.1016/j.carbon.2011.05.056. [CrossRef] [Google Scholar]
80- Hirn S, Semmler-Behnke M, Schleh C, Wenk A, Lipka J, Schaffler M, et al. Particle size-dependent and surface charge-dependent biodistribution of gold nanoparticles after intravenous administration. Eur J Pharm Biopharm. 2011;77(3):407–16. doi: 10.1016/j.ejpb.2010.12.029. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
81- Li B, Zhang XY, Yang JZ, Zhang YJ, Li WX, Fan CH, et al. Influence of polyethylene glycol coating on biodistribution and toxicity of nanoscale graphene oxide in mice after intravenous injection. Int J Nanomedicine. 2014;9:4697–707. doi: 10.2147/IJN.S66591. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
82- Zhang Y, Ali SF, Dervishi E, Xu Y, Li Z, Casciano D, et al. Cytotoxicity effects of graphene and single-wall carbon nanotubes in neural phaeochromocytoma-derived PC12 cells. ACS Nano. 2010;4(6):3181–6. doi: 10.1021/nn1007176. [PubMed] [CrossRef] [Google Scholar]
83- Li Y, Liu Y, Fu Y, Wei T, Le Guyader L, Gao G, et al. The triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathways. Biomaterials. 2012;33(2):402–11. doi: 10.1016/j.biomaterials.2011.09.091. [PubMed] [CrossRef] [Google Scholar]
84- Sydlik SA, Jhunjhunwala S, Webber MJ, Anderson DG, Langer R. In vivo compatibility of graphene oxide with differing oxidation states. ACS Nano. 2015;9(4):3866–74. doi: 10.1021/acsnano.5b01290. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
85- Mytych J, Wnuk M. Nanoparticle technology as a double-edged sword: cytotoxic, genotoxic and epigenetic effects on living cells. J Biomater Nanobiotechnol. 2013;4:53–63. doi: 10.4236/jbnb.2013.41008. [CrossRef] [Google Scholar]
86- Peng C, Hu W, Zhou Y, Fan C, Huang Q. Intracellular imaging with a graphene-based fluorescent probe. Small. 2010;6(15):1686–92. doi: 10.1002/smll.201000560. [PubMed] [CrossRef] [Google Scholar]
87- Wang D, Zhu L, Chen JF, Dai L. Can graphene quantum dots cause DNA damage in cells? Nanoscale. 2015;7(21):9894–901. doi: 10.1039/C5NR01734C. [PubMed] [CrossRef] [Google Scholar]
88- Mu Q, Su G, Li L, Gilbertson BO, Yu LH, Zhang Q, et al. Size-dependent cell uptake of protein-coated graphene oxide nanosheets. ACS Appl Mater Interf. 2012;4(4):2259–66. doi: 10.1021/am300253c. [PubMed] [CrossRef] [Google Scholar]
89- Xu M, Zhu J, Wang F, Xiong Y, Wu Y, Wang Q, et al. Improved in vitro and in vivo biocompatibility of graphene oxide through surface modification: poly(acrylic acid)-functionalization is superior to PEGylation. ACS Nano. 2016;10:3267–81. doi: 10.1021/acsnano.6b00539. [PubMed] [CrossRef] [Google Scholar]
90- Kostarelos K, Novoselov KS. Materials science. Exploring the interface of graphene and biology. Science. 2014;344(6181):261–3. doi: 10.1126/science.1246736. [PubMed] [CrossRef] [Google Scholar]
91- Sasidharan A, Panchakarla LS, Chandran P, Menon D, Nair S, Rao CN, et al. Differential nano-bio interactions and toxicity effects of pristine versus functionalized graphene. Nanoscale. 2011;3(6):2461–4. doi: 10.1039/c1nr10172b. [PubMed] [CrossRef] [Google Scholar]
92- Li Y, Yuan H, von dem Bussche A, Creighton M, Hurt RH, Kane AB, et al. Graphene microsheets enter cells through spontaneous membrane penetration at edge asperities and corner site. Proc Natl Acad Sci U S A. 2013;110(1091–6490 (Electronic)):12295–300. doi: 10.1073/pnas.1222276110. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
93- Qu G, Liu S, Zhang S, Wang L, Wang X, Sun B, et al. Graphene oxide induces toll-like receptor 4 (TLR4)-dependent necrosis in macrophages. ACS Nano. 2013;7(7):5732–45. doi: 10.1021/nn402330b. [PubMed] [CrossRef] [Google Scholar]
94- Ma J, Liu R, Wang X, Liu Q, Chen Y, Valle RP, et al. Crucial role of lateral size for graphene oxide in activating macrophages and stimulating Pro-inflammatory responses in cells and animals. ACS Nano. 2015;9(10):10498–515. doi: 10.1021/acsnano.5b04751. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
95- Mao L, Hu M, Pan B, Xie Y, Petersen EJ. Biodistribution and toxicity of radio-labeled few layer graphene in mice after intratracheal instillation. Part Fibre Toxicol. 2016;13(1743–8977 (Electronic)):1. [PMC free article] [PubMed] [Google Scholar]
96- Park EJ, Lee SJ, Lee K, Choi YC, Lee BS, Lee GH, et al. Pulmonary persistence of graphene nanoplatelets may disturb physiological and immunological homeostasis. J Appl Toxicol. 2016. [PubMed]
97- Kim JK, Shin JH, Lee JS, Hwang JH, Lee JH, Baek JE, et al. 28-Day inhalation toxicity of graphene nanoplatelets in Sprague–Dawley rats. Nanotoxicology. 2016;10(7):891–901. doi: 10.3109/17435390.2015.1133865. [PubMed] [CrossRef] [Google Scholar]
98- Singh SK, Singh MK, Kulkarni PP, Sonkar VK, Gracio JJ, Dash D. Amine-modified graphene: thrombo-protective safer alternative to graphene oxide for biomedical applications. ACS Nano. 2012;6(3):2731–40. doi: 10.1021/nn300172t. [PubMed] [CrossRef] [Google Scholar]
99- Duch MC, Budinger GR, Liang YT, Soberanes S, Urich D, Chiarella SE, et al. Minimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lung. Nano Lett. 2011;11(12):5201–7. doi: 10.1021/nl202515a. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
100- Wang X, Duch MC, Mansukhani N, Ji Z, Liao YP, Wang M, et al. Use of a pro-fibrogenic mechanism-based predictive toxicological approach for tiered testing and decision analysis of carbonaceous nanomaterials. ACS Nano. 2015;9(1936-086X (Electronic)):3032–43. doi: 10.1021/nn507243w. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
101- Sawosz E, Jaworski S, Kutwin M, Hotowy A, Wierzbicki M, Grodzik M, et al. Toxicity of pristine graphene in experiments in a chicken embryo model. Int J Nanomed. 2014;9:3913–22. [PMC free article] [PubMed] [Google Scholar]
102- Liu XT, Mu XY, Wu XL, Meng LX, Guan WB, Ma YQ, et al. Toxicity of multi-walled carbon nanotubes, graphene oxide, and reduced graphene oxide to zebrafish embryos. Biomed Environ Sci. 2014;27(9):676–83. [PubMed] [Google Scholar]
103- Chen Y, Hu X, Sun J, Zhou Q. Specific nanotoxicity of graphene oxide during zebrafish embryogenesis. Nanotoxicology. 2016;10(1):42–52. [PubMed] [Google Scholar]
104- Sasidharan A, Panchakarla LS, Sadanandan AR, Ashokan A, Chandran P, Girish CM, et al. Hemocompatibility and macrophage response of pristine and functionalized graphene. Smal. 2012;8(8):1251–63. doi: 10.1002/smll.201102393. [PubMed] [CrossRef] [Google Scholar]
105- Ding Z, Zhang Z, Ma H, Chen Y. In vitro hemocompatibility and toxic mechanism of graphene oxide on human peripheral blood T lymphocytes and serum albumin. ACS Appl Mater Interf. 2014;6(22):19797–807. doi: 10.1021/am505084s. [PubMed] [CrossRef] [Google Scholar]
106- Liao KH, Lin YS, Macosko CW, Haynes CL. Cytotoxicity of graphene oxide and graphene in human erythrocytes and skin fibroblasts. ACS Appl Mater Interfaces. 2011;3(7):2607–15. doi: 10.1021/am200428v. [PubMed] [CrossRef] [Google Scholar]
107- Kouhi SMM, Lahouti M, Ganjeali A, Entezari MH. Long-term exposure of rapeseed (Brassica napus L.) to ZnO nanoparticles: anatomical and ultrastructural responses. Environ Sci Pollut Res. 2015;22(1614–7499 (Electronic)):10733–43. doi: 10.1007/s11356-015-4306-0. [PubMed] [CrossRef] [Google Scholar]
108- Vales G, Rubio L, Marcos R. Long-term exposures to low doses of titanium dioxide nanoparticles induce cell transformation, but not genotoxic damage in BEAS-2B cells. Nanotoxicology. 2015;9(1743–5404 (Electronic)):568–78. doi: 10.3109/17435390.2014.957252. [PubMed] [CrossRef] [Google Scholar]
109- Sancey L, Kotb S, Truillet C, Appaix F, Marais A, Thomas E, et al. Long-term in vivo clearance of gadolinium-based AGuIX nanoparticles and their biocompatibility after systemic injection. ACS Nano. 2015;9(1936-086X (Electronic)):2477–88. doi: 10.1021/acsnano.5b00552. [PubMed] [CrossRef] [Google Scholar]
110- Chatterjee N, Eom HJ, Choi J. A systems toxicology approach to the surface functionality control of graphene-cell interactions. Biomaterials. 2014;35:1109–27. doi: 10.1016/j.biomaterials.2013.09.108. [PubMed] [CrossRef] [Google Scholar]
111- Jaworski S, Sawosz E, Grodzik M, Winnicka A, Prasek M, Wierzbicki M, et al. In vitro evaluation of the effects of graphene platelets on glioblastoma multiforme cells. Int J Nanomed. 2013;8:413–20. [PMC free article] [PubMed] [Google Scholar]
112- Liu Y, Luo Y, Wu J, Wang Y, Yang X, Yang R, et al. Graphene oxide can induce in vitro and in vivo mutagenesis. Sci Rep. 2013;3:3469. [PMC free article] [PubMed] [Google Scholar]
113- Vallabani NV, Mittal S, Shukla RK, Pandey AK, Dhakate SR, Pasricha R, et al. Toxicity of graphene in normal human lung cells (BEAS-2B) J Biomed Nanotechnol. 2011;7(1):106–7. doi: 10.1166/jbn.2011.1224. [PubMed] [CrossRef] [Google Scholar]
114- Peng J, Gao W, Gupta BK, Liu Z, Romero-Aburto R, Ge L, et al. Graphene quantum dots derived from carbon fibers. Nano Lett. 2012;12(1530–6992 (Electronic)):844–9. doi: 10.1021/nl2038979. [PubMed] [CrossRef] [Google Scholar]
115- Shang W, Zhang X, Zhang M, Fan Z, Sun Y, Han M, et al. The uptake mechanism and biocompatibility of graphene quantum dots with human neural stem cells. Nanoscale. 2014;6(2040–3372 (Electronic)):5799–806. doi: 10.1039/c3nr06433f. [PubMed] [CrossRef] [Google Scholar]
116- Zhang L, Xia J, Zhao Q, Liu L, Zhang Z. Functional graphene oxide as a nanocarrier for controlled loading and targeted delivery of mixed anticancer drugs. Small. 2010;6(4):537–44. doi: 10.1002/smll.200901680. [PubMed] [CrossRef] [Google Scholar]
117- Ruiz ON, Fernando KA, Wang B, Brown NA, Luo PG, McNamara ND, et al. Graphene oxide: a nonspecific enhancer of cellular growth. ACS Nano. 2011;5(10):8100–7. doi: 10.1021/nn202699t. [PubMed] [CrossRef] [Google Scholar]
118- Akhavan O, Ghaderi E, Akhavan A. Size-dependent genotoxicity of graphene nanoplatelets in human stem cells. Biomaterials. 2012;33(32):8017–25. doi: 10.1016/j.biomaterials.2012.07.040. [PubMed] [CrossRef] [Google Scholar]
119- Chang Y, Yang ST, Liu JH, Dong E, Wang Y, Cao A, et al. In vitro toxicity evaluation of graphene oxide on A549 cells. Toxicol Lett. 2011;200(3):201–10. doi: 10.1016/j.toxlet.2010.11.016. [PubMed] [CrossRef] [Google Scholar]
120- Zhang X, Hu W, Li J, Tao L, Wei Y. A comparative study of cellular uptake and cytotoxicity of multi-walled carbon nanotubes, graphene oxide, and nanodiamond. Toxicol Res. 2012;1(1):62–8. doi: 10.1039/c2tx20006f. [CrossRef] [Google Scholar]
121- Lu CH, Zhu CL, Li J, Liu JJ, Chen X, Yang HH. Using graphene to protect DNA from cleavage during cellular delivery. Chem Commun. 2010;46(1364-548X (Electronic)):3116–8. doi: 10.1039/b926893f. [PubMed] [CrossRef] [Google Scholar]
122- De Marzi L, Ottaviano L, Perrozzi F, Nardone M, Santucci S, De Lapuente J, et al. Flake size-dependent cyto and genotoxic evaluation of graphene oxide on in vitro A549, CaCo2 and vero cell lines. J Biol Regul Homeost Agents. 2014;28(2):281–9. [PubMed] [Google Scholar]
123- Lv M, Zhang Y, Liang L, Wei M, Hu W, Li X, et al. Effect of graphene oxide on undifferentiated and retinoic acid-differentiated SH-SY5Y cells line. Nanoscale. 2012;4(13):3861–6. doi: 10.1039/c2nr30407d. [PubMed] [CrossRef] [Google Scholar]
124- Reshma SC, Syama S, Mohanan PV. Nano-biointeractions of PEGylated and bare reduced graphene oxide on lung alveolar epithelial cells: A comparative in vitro study. Colloids Surf B Biointerf. 2016;140(1873–4367 (Electronic)):104–16. doi: 10.1016/j.colsurfb.2015.12.030. [PubMed] [CrossRef] [Google Scholar]
125- Rana VK, Choi MC, Kong JY, Kim GY, Mi JK, Kim SH, et al. Synthesis and drug‐delivery behavior of chitosan‐functionalized graphene oxide hybrid nanosheets. Macromol Mater Eng. 2011;296(2):131–40. doi: 10.1002/mame.201000307. [CrossRef] [Google Scholar]
126- Yang K, Li Y, Tan X, Peng R, Liu Z. Behavior and toxicity of graphene and its functionalized derivatives in biological systems. Small. 2013;9(9–10):1492–503. doi: 10.1002/smll.201201417. [PubMed] [CrossRef] [Google Scholar]
127- Yoon OJ, Kim I, Sohn IY, Kieu TT, Lee NE. Toxicity of graphene nanoflakes evaluated by cell-based electrochemical impedance biosensing. J Biomed Mater Res A. 2014;102(7):2288–94. doi: 10.1002/jbm.a.34886. [PubMed] [CrossRef] [Google Scholar]
128- Jastrzebska AM, Kurtycz P, Olszyna AR. Recent advances in graphene family materials toxicity investigations. J Nanopart Res. 2012;14(12):1320. doi: 10.1007/s11051-012-1320-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
129- Misra SK, Kondaiah P, Bhattacharya S, Rao CN. Graphene as a nanocarrier for tamoxifen induces apoptosis in transformed cancer cell lines of different origins. Small. 2012;8(1):131–43. doi: 10.1002/smll.201101640. [PubMed] [CrossRef] [Google Scholar]
130- Singh Z. Applications and toxicity of graphene family nanomaterials and their composites. Nanotechnol Sci Appl. 2016;9(1177–8903 (Electronic)):15. doi: 10.2147/NSA.S101818. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
131- Combarros RG, Collado S, Diaz M. Toxicity of graphene oxide on growth and metabolism of Pseudomonas putida. J Hazard Mater. 2016;310(1873–3336 (Electronic)):246–52. doi: 10.1016/j.jhazmat.2016.02.038. [PubMed] [CrossRef] [Google Scholar]
132- Lee JK, Jeong AY, Bae J, Seok JH, Yang JY, Roh HS, et al. The role of surface functionalization on the pulmonary inflammogenicity and translocation into mediastinal lymph nodes of graphene nanoplatelets in rats. Arch Toxicol. 2016(1432–0738 (Electronic)):1–10. DOI: .1007/s00204-016-1706-y [PubMed]
133- Patlolla AK, Randolph J, Kumari SA, Tchounwou PB. Toxicity evaluation of graphene oxidein kidneys of Sprague–Dawley rats. Int J Environ Res Public Health. 2016;13(1660–4601 (Electronic)):380. doi: 10.3390/ijerph13040380. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
134- Wang ZG, Zhou R, Jiang D, Song JE, Xu Q, Si J, et al. Toxicity of graphene quantum dots in zebrafish embryo. Biomed Environ Sci. 2015;28(0895–3988 (Print)):341–51. [PubMed] [Google Scholar]
135- Wang K, Jing R, Song H, Zhang J, Yan W, Guo S, et al. Biocompatibility of graphene oxide. Nanoscale Res Lett. 2010;6(1):1–8. [Google Scholar]
136- Hu W, Peng C, Luo W, Lv M, Li X, Li D, et al. Graphene-based antibacterial paper. ACS Nano. 2010;4(7):4317–23. doi: 10.1021/nn101097v. [PubMed] [CrossRef] [Google Scholar]
137- Dreyer DR, Park S, Bielawski CW, Ruoff RS. The chemistry of graphene oxide. Chem Soc Rev. 2010;39(1):228–40. doi: 10.1039/B917103G. [PubMed] [CrossRef] [Google Scholar]
138- Mullick Chowdhury S, Lalwani G, Zhang K, Yang JY, Neville K, Sitharaman B. Cell specific cytotoxicity and uptake of graphene nanoribbons. Biomaterials. 2013;34(1):283–93. doi: 10.1016/j.biomaterials.2012.09.057. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
139- Zhang H, Peng C, Yang J, Lv M, Liu R, He D, et al. Uniform ultrasmall graphene oxide nanosheets with low cytotoxicity and high cellular uptake. ACS Appl Mater Interf. 2013;5(5):1761–7. doi: 10.1021/am303005j. [PubMed] [CrossRef] [Google Scholar]
140- Hasan SA, Rigueur JL, Harl RR, Krejci AJ, Isabel GJ, Rogers BR, et al. Transferable graphene oxide films with tunable microstructures. ACS Nano. 2010;4(12):7367–72. doi: 10.1021/nn102152x. [PubMed] [CrossRef] [Google Scholar]
141- Hsieh CT, Chen WY. Water/oil repellency and work of adhesion of liquid droplets on graphene oxide and graphene surfaces. Surf Coat Technol. 2011;205(19):4554–61. doi: 10.1016/j.surfcoat.2011.03.128. [CrossRef] [Google Scholar]
142- Yang ST, Chang Y, Wang H, Liu G, Sheng C, Wang Y, et al. Folding/aggregation of graphene oxide and its application in Cu 2+ removal. J Colloid Interf Sci. 2010;351(1):122–7. doi: 10.1016/j.jcis.2010.07.042. [PubMed] [CrossRef] [Google Scholar]
143- Bagri A, Mattevi C, Acik M, Chabal YJ, Chhowalla M, Shenoy VB. Structural evolution during the reduction of chemically derived graphene oxide. Nat Chem. 2010;2(7):581–7. doi: 10.1038/nchem.686. [PubMed] [CrossRef] [Google Scholar]
144- Hinzmann M, Jaworski S, Kutwin M, Jagiello J, Kozinski R, Wierzbicki M, et al. Nanoparticles containing allotropes of carbon have genotoxic effects on glioblastoma multiforme cells. Int J Nanomed. 2014;9:2409–17. [PMC free article] [PubMed] [Google Scholar]
145- Jin C, Wang F, Tang Y, Zhang X, Wang J, Yang Y. Distribution of graphene oxide and TiO2-graphene oxide composite in A549 cells. Biol Trace Elem Res. 2014;159(1–3):393–8. doi: 10.1007/s12011-014-0027-3. [PubMed] [CrossRef] [Google Scholar]
146- Jarosz A, Skoda M, Dudek I, Szukiewicz D. Oxidative stress and mitochondrial activation as the main mechanisms underlying graphene toxicity against human cancer cells. Oxid Med Cell Longev. 2016;2016:5851035. doi: 10.1155/2016/5851035. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
147- Ren H, Wang C, Zhang J, Zhou X, Xu D, Zheng J, et al. DNA cleavage system of nanosized graphene oxide sheets and copper ions. ACS Nano. 2010;4(12):7169–74. doi: 10.1021/nn101696r. [PubMed] [CrossRef] [Google Scholar]
148- Wang A, Pu K, Dong B, Liu Y, Zhang L, Zhang Z, et al. Role of surface charge and oxidative stress in cytotoxicity and genotoxicity of graphene oxide towards human lung fibroblast cells. J Appl Toxicol. 2013;33(10):1156–64. doi: 10.1002/jat.2877. [PubMed] [CrossRef] [Google Scholar]
149- Jiang X, Dausend J, Hafner M, Musyanovych A, Rocker C, Landfester K, et al. Specific effects of surface amines on polystyrene nanoparticles in their interactions with mesenchymal stem cells. Biomacromolecules. 2010;11(3):748–53. doi: 10.1021/bm901348z. [PubMed] [CrossRef] [Google Scholar]
150- Yue ZG, Wei W, Lv PP, Yue H, Wang LY, Su ZG, et al. Surface charge affects cellular uptake and intracellular trafficking of chitosan-based nanoparticles. Biomacromolecules. 2011;12(7):2440–6. doi: 10.1021/bm101482r. [PubMed] [CrossRef] [Google Scholar]
151- Zhang W, Wang C, Li Z, Lu Z, Li Y, Yin JJ, et al. Unraveling stress-induced toxicity properties of graphene oxide and the underlying mechanism. Adv Mater. 2012;24(39):5391–7. doi: 10.1002/adma.201202678. [PubMed] [CrossRef] [Google Scholar]
152- Wojtoniszak M, Chen X, Kalenczuk RJ, Wajda A, Łapczuk J, Kurzewski M, et al. Synthesis, dispersion, and cytocompatibility of graphene oxide and reduced graphene oxide. Colloids Surf B Biointerf. 2011;89(1):79–85. [PubMed] [Google Scholar]
153- Hu H, Yu J, Li Y, Zhao J, Dong H. Engineering of a novel pluronic F127/graphene nanohybrid for pH responsive drug delivery. J Biomed Mater Res A. 2012;100(1):141–8. doi: 10.1002/jbm.a.33252. [PubMed] [CrossRef] [Google Scholar]
154- Sahu A, Choi WI, Tae G. A stimuli-sensitive injectable graphene oxide composite hydrogel. Chem Commun (Camb) 2012;48(47):5820–2. doi: 10.1039/c2cc31862h. [PubMed] [CrossRef] [Google Scholar]
155- Yang K, Zhang S, Zhang G, Sun X, Lee ST, Liu Z. Graphene in mice: ultrahigh in vivo tumor uptake and efficient photothermal therapy. Nano Lett. 2010;10(9):3318–23. doi: 10.1021/nl100996u. [PubMed] [CrossRef] [Google Scholar]
156- Romero-Aburto R, Narayanan TN, Nagaoka Y, Hasumura T, Mitcham TM, Fukuda T, et al. Fluorinated graphene oxide; a new multimodal material for biological applications. Adv Mater. 2013;25(39):5632–7. doi: 10.1002/adma201301804. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
157- Feng L, Liu Z. Graphene in biomedicine: opportunities and challenges. Nanomed (Lond) 2011;6(2):317–24. doi: 10.2217/nnm.10.158. [PubMed] [CrossRef] [Google Scholar]
158- Robinson JT, Tabakman SM, Liang Y, Wang H, Casalongue HS, Vinh D, et al. Ultrasmall reduced graphene oxide with high near-infrared absorbance for photothermal therapy. J Am Chem Soc. 2011;133(17):6825–31. doi: 10.1021/ja2010175. [PubMed] [CrossRef] [Google Scholar]
159- Singh N, Manshian B, Jenkins GJS, Griffiths SM, Williams PM, Maffeis TGG, et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials. 2009;30(s 23–24):3891–914. doi: 10.1016/j.biomaterials.2009.04.009. [PubMed] [CrossRef] [Google Scholar]
160- Yin PT, Shah S, Chhowalla M, Lee KB. Design, synthesis, and characterization of graphene-nanoparticle hybrid materials for bioapplications. Chem Rev. 2015;115(7):2483–531. doi: 10.1021/cr500537t. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
161- Peng L, Xu Z, Liu Z, Wei Y, Sun H, Li Z, et al. An iron-based green approach to 1-h production of single-layer graphene oxide. Nat Commun. 2015;6:5716. doi: 10.1038/ncomms6716. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
162- Ali-Boucetta H, Bitounis D, Raveendran-Nair R, Servant A, Van den Bossche J, Kostarelos K. Purified graphene oxide dispersions lack in vitro cytotoxicity and in vivo pathogenicity. Adv Healthc Mater. 2013;2(3):433–41. doi: 10.1002/adhm.201200248. [PubMed] [CrossRef] [Google Scholar]
163- Dell’Orco D, Lundqvist M, Oslakovic C, Cedervall T, Linse S. Modeling the time evolution of the nanoparticle-protein corona in a body fluid. PLoS One. 2010;5(6):e10949-e. doi: 10.1371/journal.pone.0010949. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
164- Eudald C, Tobias P, Albert D, Gertie Janneke O, Victor P. Time evolution of the nanoparticle protein corona. ACS Nano. 2010;4(7):3623–32. doi: 10.1021/nn901372t. [PubMed] [CrossRef] [Google Scholar]
165- Aggarwal P, Hall JB, McLeland CB, Dobrovolskaia MA, McNeil SE. Nanoparticle interaction with plasma proteins as it relates to particle biodistribution, biocompatibility and therapeutic efficacy. Adv Drug Deliv Rev. 2009;61(6):428–37. doi: 10.1016/j.addr.2009.03.009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
166- Hu W, Peng C, Lv M, Li X, Zhang Y, Chen N, et al. Protein corona-mediated mitigation of cytotoxicity of graphene oxide. ACS Nano. 2011;5(5):3693–700. doi: 10.1021/nn200021j. [PubMed] [CrossRef] [Google Scholar]
167- Duan G, Kang SG, Tian X, Garate JA, Zhao L, Ge C, et al. Protein corona mitigates the cytotoxicity of graphene oxide by reducing its physical interaction with cell membrane. Nanoscale. 2015;7:15214–24. doi: 10.1039/C5NR01839K. [PubMed] [CrossRef] [Google Scholar]
168- Cuicui G, Jiangfeng D, Lina Z, Liming W, Ying L, Denghua L, et al. Binding of blood proteins to carbon nanotubes reduces cytotoxicity. Proc Natl Acad Sci U S A. 2011;108(41):16968–73. doi: 10.1073/pnas.1105270108. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
169- Li Y, Feng L, Shi X, Wang X, Yang Y, Yang K, et al. Surface coating-dependent cytotoxicity and degradation of graphene derivatives: towards the design of non-toxic, degradable nano-graphene. Small. 2014;10(8):1544–54. doi: 10.1002/smll.201303234. [PubMed] [CrossRef] [Google Scholar]
170- Gurunathan S, Han J, Park JH, Kim JH. An in vitro evaluation of graphene oxide reduced by Ganoderma spp. in human breast cancer cells (MDA-MB-231) Int J Nanomed. 2014;9:1783–97. doi: 10.2147/IJN.S57735. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
171- Yuan J, Gao H, Ching CB. Comparative protein profile of human hepatoma HepG2 cells treated with graphene and single-walled carbon nanotubes: an iTRAQ-coupled 2D LC-MS/MS proteome analysis. Toxicol Lett. 2011;207(3):213–21. doi: 10.1016/j.toxlet.2011.09.014. [PubMed] [CrossRef] [Google Scholar]
172- Tomasio SM, Walsh TR. Modeling the binding affinity of peptides for graphitic surfaces. Influences of aromatic content and interfacial shape. J Phys Chem C. 2009;113(20):8778–85. doi: 10.1021/jp8087594. [CrossRef] [Google Scholar]
173- Akhavan O, Ghaderi E. Toxicity of graphene and graphene oxide nanowalls against bacteria. ACS Nano. 2010;4(10):5731–6. doi: 10.1021/nn101390x. [PubMed] [CrossRef] [Google Scholar]
174- Burton GJ, Jauniaux E. Oxidative stress. Best Pract Res Clin Obstet Gynaecol. 2011;25:287–99. doi: 10.1016/j.bpobgyn.2010.10.016. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
175- Waiwijit U, Kandhavivorn W, Oonkhanond B, Lomas T, Phokaratkul D, Wisitsoraat A, et al. Cytotoxicity assessment of MDA-MB-231 breast cancer cells on screen-printed graphene-carbon paste substrate. Colloids Surf B Biointerf. 2014;113:190–7. doi: 10.1016/j.colsurfb.2013.09.008. [PubMed] [CrossRef] [Google Scholar]
176- Chong Y, Ma Y, Shen H, Tu X, Zhou X, Xu J, et al. The in vitro and in vivo toxicity of graphene quantum dots. Biomaterials. 2014;35(19):5041–8. doi: 10.1016/j.biomaterials.2014.03.021. [PubMed] [CrossRef] [Google Scholar]
177- Chen M, Yin J, Liang Y, Yuan S, Wang F, Song M, et al. Oxidative stress and immunotoxicity induced by graphene oxide in zebrafish. Aqua Toxicol. 2016;174(1879–1514 (Electronic)):54–60. doi: 10.1016/j.aquatox.2016.02.015. [PubMed] [CrossRef] [Google Scholar]
178- Meng C, Zhi X, Li C, Li C, Chen Z, Qiu X, et al. Graphene oxides decorated with carnosine as an adjuvant to modulate innate immune and improve adaptive immunity in vivo. ACS Nano. 2016;10(1936-086X (Electronic)):2203–13. doi: 10.1021/acsnano.5b06750. [PubMed] [CrossRef] [Google Scholar]
179- Ravichandran P, Baluchamy S, Sadanandan B, Gopikrishnan R, Biradar S, Ramesh V, et al. Multiwalled carbon nanotubes activate NF-κB and AP-1 signaling pathways to induce apoptosis in rat lung epithelial cells. Apoptosis. 2010;15(12):1507–16. doi: 10.1007/s10495-010-0532-6. [PubMed] [CrossRef] [Google Scholar]
180- Lammel T, Boisseaux P, Fernandez-Cruz ML, Navas JM. Internalization and cytotoxicity of graphene oxide and carboxyl graphene nanoplatelets in the human hepatocellular carcinoma cell line Hep G2. Part Fibre Toxicol. 2013;10:27. doi: 10.1186/1743-8977-10-27. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
181- Gurunathan S, Han JW, Eppakayala V, Kim JH. Green synthesis of graphene and its cytotoxic effects in human breast cancer cells. Int J Nanomedicine. 2013;8:1015–27. doi: 10.2147/IJN.S42047. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
182- Salas EC, Sun Z, Luttge A, Tour JM. Reduction of graphene oxide via bacterial respiration. ACS Nano. 2010;4(8):4852–6. doi: 10.1021/nn101081t. [PubMed] [CrossRef] [Google Scholar]
183- Shekaramiz E. Immobilization of mitochondria on graphene. Dissert Theses Gradworks. 2012;217(1):120–31. [Google Scholar]
184- Park EJ, Lee GH, Han BS, Lee BS, Lee S, Cho MH, et al. Toxic response of graphene nanoplatelets in vivo and in vitro. Arch Toxicol. 2015;89(9):1557–68. doi: 10.1007/s00204-014-1303-x. [PubMed] [CrossRef] [Google Scholar]
185- Chatterjee N, Yang J, Choi J. Differential genotoxic and epigenotoxic effects of graphene family nanomaterials (GFNs) in human bronchial epithelial cells. Mutat Res Gen Tox En. 2016;798(1879–3592 (Electronic)):1–10. doi: 10.1016/j.mrgentox.2016.01.006. [PubMed] [CrossRef] [Google Scholar]
186- Ivask A, Voelcker NH, Seabrook SA, Hor M, Kirby JK, Fenech M, et al. DNA melting and genotoxicity induced by silver nanoparticles and graphene. Chem Res Toxicol. 2015;28(1520–5010 (Electronic)):1023–35. doi: 10.1021/acs.chemrestox.5b00052. [PubMed] [CrossRef] [Google Scholar]
187- Magdolenova Z, Collins A, Kumar A, Dhawan A, Stone V, Dusinska M. Mechanisms of genotoxicity. A review of in vitro and in vivo studies with engineered nanoparticles. Nanotoxicology. 2014;8(3):233–78. doi: 10.3109/17435390.2013.773464. [PubMed] [CrossRef] [Google Scholar]
188- Golbamaki N, Rasulev B, Cassano A, Marchese Robinson RL, Benfenati E, Leszczynski J, et al. Genotoxicity of metal oxide nanomaterials: review of recent data and discussion of possible mechanisms. Nanoscale. 2015;7(6):2154–98. doi: 10.1039/C4NR06670G. [PubMed] [CrossRef] [Google Scholar]
189- Zhao X. Self-assembly of DNA segments on graphene and carbon nanotube arrays in aqueous solution: A molecular simulation study. J Phys Chem C. 2011;115(14):6181–9. doi: 10.1021/jp110013r. [CrossRef] [Google Scholar]
190- Ciccia A, Elledge SJ. The DNA damage response: making it safe to play with knives. Mol Cell. 2010;40(2):179–204. doi: 10.1016/j.molcel.2010.09.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
191- Satoshi F, Macconmara MP, Maung AA, Yan Z, Mannick JA, Lederer JA, et al. Platelet depletion in mice increases mortality after thermal injury. Blood. 2006;107(11):4399–406. doi: 10.1182/blood-2005-09-3776. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
192- Chen GY, Yang HJ, Lu CH, Chao YC, Hwang SM, Chen CL, et al. Simultaneous induction of autophagy and toll-like receptor signaling pathways by graphene oxide. Biomaterials. 2012;33(27):6559–69. doi: 10.1016/j.biomaterials.2012.05.064. [PubMed] [CrossRef] [Google Scholar]
193- Zhou H, Zhao K, Li W, Yang N, Liu Y, Chen C, et al. The interactions between pristine graphene and macrophages and the production of cytokines/chemokines via TLR- and NF-kappaB-related signaling pathways. Biomaterials. 2012;33(29):6933–42. doi: 10.1016/j.biomaterials.2012.06.064. [PubMed] [CrossRef] [Google Scholar]
194- Lawrence T. The nuclear factor NF-kappaB pathway in inflammation. Cold Spring Harb Perspect Biol. 2009;1(1943–0264 (Electronic)):a001651. [PMC free article] [PubMed] [Google Scholar]
195- Hengartner MO. The biochemistry of apoptosis. Nature. 2000;407(6805):770–6. doi: 10.1038/35037710. [PubMed] [CrossRef] [Google Scholar]
196- Matesanz MC, Vila M, Feito MJ, Linares J, Goncalves G, Vallet-Regi M, et al. The effects of graphene oxide nanosheets localized on F-actin filaments on cell-cycle alterations. Biomaterials. 2013;34(5):1562–9. doi: 10.1016/j.biomaterials.2012.11.001. [PubMed] [CrossRef] [Google Scholar]
197- Yao Y, Costa M. Genetic and epigenetic effects of nanoparticles. J Mol Genet Med. 2013;7:86. [Google Scholar]
198- Stern ST, Adiseshaiah PP, Crist RM. Autophagy and lysosomal dysfunction as emerging mechanisms of nanomaterial toxicity. Part Fibre Toxicol. 2012;9(1743–8977 (Electronic)):1. [PMC free article] [PubMed] [Google Scholar]
199- Mizushima N, Yoshimori T, Levine B. Methods in mammalian autophagy research. Cel. 2010;140(1097–4172 (Electronic)):313–26. doi: 10.1016/j.cell.2010.01.028. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
200- Patel AS, Lin L, Geyer A, Haspel JA, An CH, Cao J, et al. Autophagy in idiopathic pulmonary fibrosis. PLoS One. 2012;7(1932–6203 (Electronic)):e41394. doi: 10.1371/journal.pone.0041394. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
201- Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation. Nature. 2011;469(7330):323–35. doi: 10.1038/nature09782. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
202- Kenzaoui BH, Bernasconi CC, Guney-Ayra S, Juillerat-Jeanneret L. Induction of oxidative stress, lysosome activation and autophagy by nanoparticles in human brain-derived endothelial cells. Biochem J. 2012;441(1470–8728 (Electronic)):813–21. [PubMed] [Google Scholar]
203- Hussain S, Garantziotis S. Interplay between apoptotic and autophagy pathways after exposure to cerium dioxide nanoparticles in human monocytes. Autophagy. 2013;9(1554–8635 (Electronic)):101–3. doi: 10.4161/auto.22266. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
204- Sun T, Yan Y, Zhao Y, Guo F, Jiang C. Copper oxide nanoparticles induce autophagic cell death in A549 cells. PLoS One. 2012;7(1932–6203 (Electronic)):e43442. doi: 10.1371/journal.pone.0043442. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
205- Chen GY, Meng CL, Lin KC, Tuan HY, Yang HJ, Chen CL, et al. Graphene oxide as a chemosensitizer: Diverted autophagic flux, enhanced nuclear import, elevated necrosis and improved antitumor effects. Biomaterials. 2015;40:12–22. doi: 10.1016/j.biomaterials.2014.11.034. [PubMed] [CrossRef] [Google Scholar]
206- Chen GY, Chen CL, Tuan HY, Yuan PX, Li KC, Yang HJ, et al. Graphene oxide triggers toll-like receptors/autophagy responses in vitro and inhibits tumor growth in vivo. Adv Healthc Mater. 2014;3(9):1486–95. doi: 10.1002/adhm.201300591. [PubMed] [CrossRef] [Google Scholar]
207- Wan B, Wang ZX, Lv QY, Dong PX, Zhao LX, Yang Y, et al. Single-walled carbon nanotubes and graphene oxides induce autophagosome accumulation and lysosome impairment in primarily cultured murine peritoneal macrophages. Toxicol Lett. 2013;221(1879–3169 (Electronic)):118–27. doi: 10.1016/j.toxlet.2013.06.208. [PubMed] [CrossRef] [Google Scholar]
208- Markovic ZM, Ristic BZ, Arsikin KM, Klisic DG, Harhaji-Trajkovic LM, Todorovic-Markovic BM, et al. Graphene quantum dots as autophagy-inducing photodynamic agents. Biomaterials. 2012;33(29):7084–92. doi: 10.1016/j.biomaterials.2012.06.060. [PubMed] [CrossRef] [Google Scholar]
209- Sanjuan MA, Dillon CP, Tait SW, Moshiach S, Dorsey F, Connell S, et al. Toll-like receptor signalling in macrophages links the autophagy pathway to phagocytosis. Nature. 2007;450(7173):1253–7. doi: 10.1038/nature06421. [PubMed] [CrossRef] [Google Scholar]
210- Sasidharan A, Swaroop S, Chandran P, Nair S, Koyakutty M. Cellular and molecular mechanistic insight into the DNA-damaging potential of few-layer graphene in human primary endothelial cells. Nanomed. 2016;12(1549–9642 (Electronic)):1347–55. [PubMed] [Google Scholar]
211- Yang H, Rivera Z, Jube S, Nasu M, Bertino P, Goparaju C, et al. Programmed necrosis induced by asbestos in human mesothelial cells causes high-mobility group box 1 protein release and resultant inflammation. Proc Natl Acad Sci U S A. 2010;107(1091–6490 (Electronic)):12611–6. doi: 10.1073/pnas.1006542107. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
212- Raucci A, Palumbo R, Bianchi ME. HMGB1: a signal of necrosis. Autoimmunity. 2007;40(4):285–9. doi: 10.1080/08916930701356978. [PubMed] [CrossRef] [Google Scholar]
213- Smith ZD, Meissner A. DNA methylation: roles in mammalian development. Nat Rev Genet. 2013;14(3):204–20. doi: 10.1038/nrg3354. [PubMed] [CrossRef] [Google Scholar]
214- Fabian MR, Sonenberg N. The mechanics of miRNA-mediated gene silencing: a look under the hood of miRISC. Nat Struct Mol Biol. 2012;19(6):586–93. doi: 10.1038/nsmb.2296. [PubMed] [CrossRef] [Google Scholar]
215- Nishikura K. Functions and regulation of RNA editing by ADAR deaminases. Annu Rev Biochem. 2010;79(79):321–49. doi: 10.1146/annurev-biochem-060208-105251. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
216- Dubey P, Matai I, Kumar SU, Sachdev A, Bhushan B, Gopinath P. Perturbation of cellular mechanistic system by silver nanoparticle toxicity: Cytotoxic, genotoxic and epigenetic potentials. Adv Colloid Interf Sci. 2015;221:4–21. doi: 10.1016/j.cis.2015.02.007. [PubMed] [CrossRef] [Google Scholar]
217- Collins AR, Ferguson LR. DNA repair as a biomarker. Mutat Res. 2012;736(1–2):2–4. doi: 10.1016/j.mrfmmm.2012.03.008. [PubMed] [CrossRef] [Google Scholar]
218- Zhao Y, Wu Q, Wang D. An epigenetic signal encoded protection mechanism is activated by graphene oxide to inhibit its induced reproductive toxicity in Caenorhabditis elegans. Biomaterials. 2016;79(1878–5905 (Electronic)):15–24. doi: 10.1016/j.biomaterials.2015.11.052. [PubMed] [CrossRef] [Google Scholar]
219- Liu C, Yu W, Chen Z, Zhang J, Zhang N. Enhanced gene transfection efficiency in CD13-positive vascular endothelial cells with targeted poly(lactic acid)-poly(ethylene glycol) nanoparticles through caveolae-mediated endocytosis. J Contr Rel. 2011;151(1873–4995 (Electronic)):162–75. doi: 10.1016/j.jconrel.2011.02.027. [PubMed] [CrossRef] [Google Scholar]
220- Ema M, Aoyama H, Arima A, Asano Y, Chihara K, Endoh K, et al. Historical control data on prenatal developmental toxicity studies in rabbits. Congenit Anom. 2012;52(3):155–61. doi: 10.1111/j.1741-4520.2012.00365.x. [PubMed] [CrossRef] [Google Scholar]
221- Ema M, Endoh K, Fukushima R, Fujii S, Hara H, Hirata-Koizumi M, et al. Historical control data on developmental toxicity studies in rodents. Congenit Anom. 2014;54(3):150–61. doi: 10.1111/cga.12050. [PubMed] [CrossRef] [Google Scholar]
222- Bitounis D, Ali-Boucetta H, Hong BH, Min DH, Kostarelos K. Prospects and challenges of graphene in biomedical applications. Adv Mater. 2013;25(16):2258–68. doi: 10.1002/adma.201203700. [PubMed] [CrossRef] [Google Scholar]
223- Van Goethem F, Lison D, Kirsch-Volders M. Comparative evaluation of the in vitro micronucleus test and the alkaline single cell gel electrophoresis assay for the detection of DNA damaging agents: genotoxic effects of cobalt powder, tungsten carbide and cobalt-tungsten carbide. Mutat Res. 1997;392(1–2):31–43. doi: 10.1016/S0165-1218(97)00043-8. [PubMed] [CrossRef] [Google Scholar]
224- Natarajan V, Wilson CL, Hayward SL, Kidambi S. Titanium dioxide nanoparticles trigger loss of function and perturbation of mitochondrial dynamics in primary hepatocytes. PLoS One. 2015;10(1932–6203 (Electronic)):e0134541. doi: 10.1371/journal.pone.0134541. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
225- Hong F, Zhao X, Chen M, Zhou Y, Ze Y, Wang L, et al. TiO2 nanoparticles-induced apoptosis of primary cultured Sertoli cells of mice. J Biochem Mater Res A. 2016;104(1552–4965 (Electronic)):124–35. doi: 10.1002/jbm.a.35548. [PubMed] [CrossRef] [Google Scholar]
226- Yang WE, Lan MY, Lee SW, Chang JK, Huang HH. Primary human nasal epithelial cell response to titanium surface with a nanonetwork structure in nasal implant applications. Nanoscale Res Lett. 2015;10(1931–7573 (Print)):1–10. [PMC free article] [PubMed] [Google Scholar]
227- Wang J, Deng X, Zhang F, Chen D, Ding W. ZnO nanoparticle-induced oxidative stress triggers apoptosis by activating JNK signaling pathway in cultured primary astrocytes. Nanoscale Res Lett. 2014;9(1931–7573 (Print)):1–12. [PMC free article] [PubMed] [Google Scholar]
228- Osmond-McLeod MJ, Osmond RI, Oytam Y, McCall MJ, Feltis B, Mackay-Sim A, et al. Surface coatings of ZnO nanoparticles mitigate differentially a host of transcriptional, protein and signalling responses in primary human olfactory cells. Part Fibre Toxicol. 2013;10(1743–8977 (Electronic)):1. [PMC free article] [PubMed] [Google Scholar]
229- Meng S, Peng R. Growth and follow-up of primary cortical neuron cells on nonfunctionalized graphene nanosheet film. J Appl Biomater Funct Mater. 2016;14(2280–8000 (Electronic)):e26–34. [PubMed] [Google Scholar]
230- Kwon JT, Seo GB, Jo, Lee M, Kim HM, Shim I, et al. Aluminum nanoparticles induce ERK and p38MAPK activation in rat brain. Toxicol Res. 2013;29(1976–8257 (Print)):181–5. doi: 10.5487/TR.2013.29.3.181. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
231- Radcliffe PM, Olabisi AO, Wagner DJ, Leavens T, Wong BA, Struve MF, et al. Acute sodium tungstate inhalation is associated with minimal olfactory transport of tungsten (188W) to the rat brain. Neurotoxicology. 2009;30(1872–9711 (Electronic)):445–50. doi: 10.1016/j.neuro.2009.02.004. [PubMed] [CrossRef] [Google Scholar]
232- Zhang H, Li ZF, Snyder A, Xie J, Stanciu LA. Functionalized graphene oxide for the fabrication of paraoxon biosensors. Anal Chim Acta. 2014;827:86–94. doi: 10.1016/j.aca.2014.04.014. [PubMed] [CrossRef] [Google Scholar]
233- Schriver M, Regan W, Gannett WJ, Zaniewski AM, Crommie MF, Zettl A. Graphene as a long-term metal oxidation barrier: worse than nothing. ACS Nano. 2013;7(1936-086X (Electronic)):5763–8. doi: 10.1021/nn4014356. [PubMed] [CrossRef] [Google Scholar]
234- Soldano C, Mahmood A, Dujardin E. Production, properties and potential of graphene. Carbon. 2010;48(8):2127–50. doi: 10.1016/j.carbon.2010.01.058. [CrossRef] [Google Scholar]
235- Han SG, Kim JK, Shin JH, Hwang JH, Lee JS, Kim TG, et al. Pulmonary Responses of Sprague–Dawley Rats in Single Inhalation Exposure to Graphene Oxide Nanomaterials. Biomed Res Int. 2015;2015:376756. [PMC free article] [PubMed] [Google Scholar]
236- Pan WY, Huang CC, Lin TT, Hu HY, Lin WC, Li MJ, et al. Synergistic antibacterial effects of localized heat and oxidative stress caused by hydroxyl radicals mediated by graphene/iron oxide-based nanocomposites. Nanomedicine. 2016;12(2):431–8. [PubMed] [Google Scholar]
237- Yang K, Gong H, Shi X, Wan J, Zhang Y, Liu Z. Invivo biodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administration. Biomaterials. 2013;34(11):2787–95. doi: 10.1016/j.biomaterials.2013.01.001. [PubMed] [CrossRef] [Google Scholar]
238- Jaworski S, Sawosz E, Kutwin M, Wierzbicki M, Hinzmann M, Grodzik M, et al. In vitro and in vivo effects of graphene oxide and reduced graphene oxide on glioblastoma. Int J Nanomedicine. 2015;10:1585–96. doi: 10.2217/nnm.15.20. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
239- Akhavan O, Ghaderi E, Emamy H, Akhavan F. Genotoxicity of graphene nanoribbons in human mesenchymal stem cells. Carbon. 2013;54(2):419–31. doi: 10.1016/j.carbon.2012.11.058. [CrossRef] [Google Scholar]
240- Chatterjee N, Yang J, Choi J. Differential genotoxic and epigenotoxic effects of graphene family nanomaterials (GFNs) in human bronchial epithelial cells. Mut Res Gen Tox Environ Mutagenesis. 2016;798–799:1–10. doi: 10.1016/j.mrgentox.2016.01.006. [PubMed] [CrossRef] [Google Scholar]