Resumo
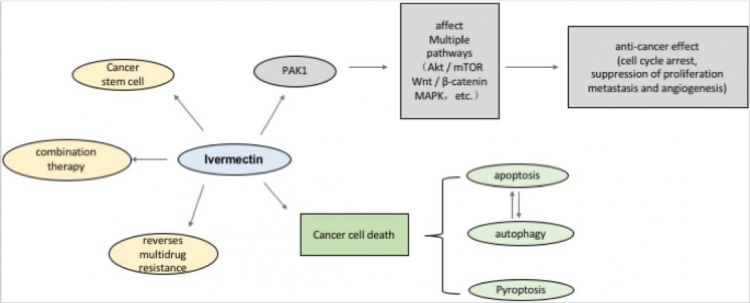
A ivermectina tem poderosos efeitos antitumorais, incluindo a inibição da proliferação, metástase e atividade angiogênica, em uma variedade de células cancerosas. Isso pode estar relacionado à regulação de múltiplas vias de sinalização pela ivermectina através da PAK1 quinase. Por outro lado, a ivermectina promove a morte programada de células cancerígenas, incluindo apoptose, autofagia e piroptose. A ivermectina induz apoptose e a autofagia é mutuamente regulada. Curiosamente, a ivermectina também pode inibir as células-tronco tumorais e reverter a resistência a múltiplas drogas e exerce o efeito ideal quando usada em combinação com outras drogas quimioterápicas.
Abreviaturas: ASC, proteína do tipo mancha associada à apoptose contendo um CARD; ALCAR, acetil-L-carnitina; CSCs, células estaminais cancerosas; DAMP, padrão molecular associado a danos; EGFR, receptor do fator de crescimento epidérmico; EBV, vírus Epstein-Barr; EMT, transição mesenquimal epitelial; GABA, ácido gama-aminobutírico; GSDMD, Gasdermina D; HBV, vírus da hepatite B; HCV, vírus da hepatite C; HER2, receptor 2 do fator de crescimento epidérmico humano; HMGB1, proteína box-1 do grupo de alta mobilidade; HSP27, proteína de choque térmico 27; LD50, dose letal mediana; LDH, Lactato desidrogenase; IVM, Ivermectina; MDR, multirresistência; NAC, N-acetil-L-cisteína; OCT-4, proteína 4 de ligação ao octâmero; PAK1, quinases 1 ativadas por P-21; PAMP, padrão molecular associado a patógenos; PARP, poli (ADP-ribose) polimerase; P-gp, P-glicoproteína; PRR, receptor de reconhecimento de padrões; ROS, Espécies reativas de oxigênio; STAT3, Transdutor de sinal e ativador de transcrição 3; SID, domínio de interação SIN3; siRNA, RNA interferente pequeno; SOX-2, caixa SRY 2; TNBC, câncer de mama triplo negativo; YAP1, proteína 1 associada a sim.
Compostos químicos revisados neste artigo:
ivermectina(PubChem CID:6321424),
avermectina(PubChem CID:6434889),
selamectina(PubChem CID:9578507),
doramectina(PubChem CID:9832750),
moxidectina(PubChem CID:9832912)
Palavras-chave: ivermectina, câncer, reposicionamento de drogas
Abstrato
A ivermectina é um fármaco antiparasitário macrolídeo com um anel de 16 membros que é amplamente utilizado para o tratamento de muitas doenças parasitárias, como oncocercose, elefantíase e sarna. Satoshi Omura e William C. Campbell ganharam o Prêmio Nobel de Fisiologia ou Medicina de 2015 pela descoberta da excelente eficácia da ivermectina contra doenças parasitárias. Recentemente, foi relatado que a ivermectina inibe a proliferação de várias células tumorais por meio da regulação de múltiplas vias de sinalização. Isso sugere que a ivermectina pode ser uma droga anticancerígena com grande potencial. Aqui, revisamos os mecanismos relacionados pelos quais a ivermectina inibe o desenvolvimento de diferentes cânceres e promove a morte celular programada e discutimos as perspectivas para a aplicação clínica da ivermectina como droga anticancerígena para terapia de neoplasias.
1. Introdução
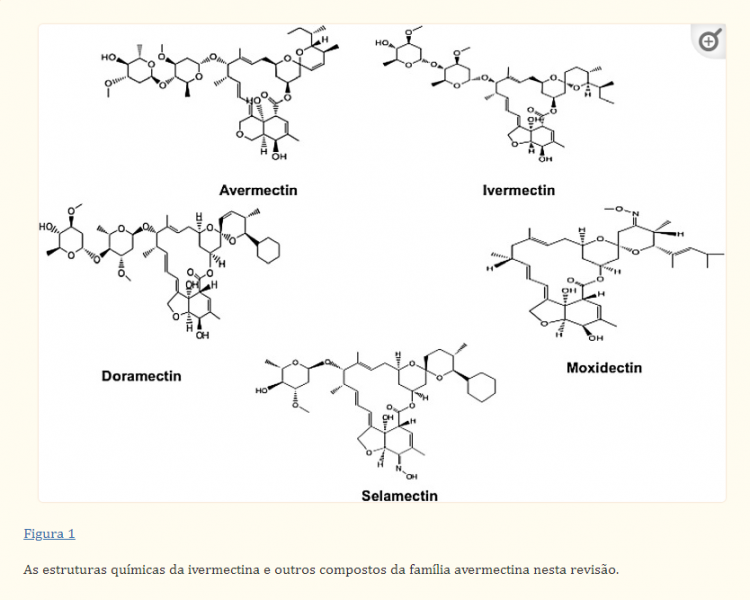
A ivermectina (IVM) é um fármaco antiparasitário macrolídeo com um anel de 16 membros derivado da avermectina que é composto por 80% de 22,23-diidroavermectina-B1a e 20% de 22,23-diidroavermectina-B1b. Além da IVM, os atuais membros da família de avermectina incluem selamectina, doramectina e moxidectina (Figura 1). A IVM é atualmente a droga da família avermectina de maior sucesso e foi aprovada pelo FDA para uso em humanos em 1978. Tem um bom efeito no tratamento de doenças parasitárias, como oncocercose, elefantíase e sarna. Os descobridores do IVM, o cientista japonês Satoshi Omura e o cientista irlandês William C. Campbell, ganharam o Prêmio Nobel de Fisiologia ou Medicina em 2015. A IVM ativa os canais de cloreto controlados por glutamato no parasita, causando uma grande quantidade de influxo de íons cloreto e hiperpolarização neuronal, levando à liberação de ácido gama-aminobutírico (GABA) para destruir os nervos, e a transmissão nervosa das células musculares induz a paralisia de músculos somáticos para matar parasitas. A IVM também tem demonstrado efeitos benéficos contra outras doenças parasitárias, como malária, tripanossomíase, esquistossomose, triquinose e leishmaniose.
IVM não só tem fortes efeitos sobre os parasitas, mas também tem potenciais efeitos antivirais. IVM pode inibir a replicação de flavivírus, visando a NS3 helicase; também bloqueia o transporte nuclear de proteínas virais, agindo no transporte nuclear mediado por α/β e exerce atividade antiviral contra os vírus HIV-1 e dengue. Estudos recentes também apontaram que tem um efeito inibitório promissor sobre o vírus SARS-CoV-2, que causou um surto global em 2020. Além disso, a IVM apresenta potencial para aplicação clínica na asma e doenças neurológicas. Recentemente, os cientistas descobriram que o IVM tem um forte efeito anticancerígeno.
Desde o primeiro relato de que a IVM poderia reverter a resistência a múltiplas drogas do tumor (MDR) em 1996, alguns estudos relevantes enfatizaram o uso potencial da IVM como um novo tratamento de câncer. Apesar do grande número de estudos relacionados, ainda existem algumas questões importantes que não foram resolvidas. Em primeiro lugar, o mecanismo específico da citotoxicidade mediada por IVM em células tumorais não é claro; pode estar relacionado ao efeito da IVM em várias vias de sinalização, mas não é muito claro em geral. Em segundo lugar, a IVM parece induzir a morte celular mista em células tumorais, o que também é uma questão controversa. Portanto, esta revisão resumiu as últimas descobertas sobre o efeito anticancerígeno do IVM e discutiu o mecanismo de inibição da proliferação tumoral e a maneira como o IVM induz a morte celular programada do tumor para fornecer uma base teórica para o uso do IVM como um potencial fármaco anticancerígeno. À medida que o custo da pesquisa e desenvolvimento de novas drogas anticancerígenas continua a aumentar, o reposicionamento de drogas tornou-se cada vez mais importante. Para alguns medicamentos mais antigos que são amplamente utilizados por suas indicações originais e possuem dados clínicos e informações de segurança, o reposicionamento de medicamentos permite que eles sejam desenvolvidos por meio de um ciclo mais barato e mais rápido e sejam usados de forma mais eficaz no uso clínico clinicamente. Aqui, resumimos sistematicamente o efeito anticancerígeno e o mecanismo da IVM, que é de grande importância para o reposicionamento da IVM para o tratamento do câncer.
2. O papel da IVM em diferentes tipos de câncer
2.1. Câncer de mama
O câncer de mama é um tumor maligno produzido por mutação genética nas células epiteliais da mama causada por múltiplos carcinógenos. A incidência do câncer de mama tem aumentado a cada ano, tornando-se um dos tumores malignos femininos com maior incidência no mundo. Em média, um novo caso é diagnosticado a cada 18 segundos em todo o mundo. Após o tratamento com IVM, a proliferação de várias linhas celulares de câncer de mama, incluindo MCF-7, MDA-MB-231 e MCF-10, foi significativamente reduzida. O mecanismo envolveu a inibição pela IVM da via Akt/mTOR para induzir a autofagia e a quinase 1 (PAK1) ativada por p-21 foi o alvo da IVM para o câncer de mama. Além disso, o estudo de Diao mostrou que a IVM pode inibir a proliferação das linhagens de células tumorais de mama canina CMT7364 e CIPp, bloqueando o ciclo celular sem aumentar a apoptose, e o mecanismo da IVM pode estar relacionado à inibição da via Wnt.
O câncer de mama triplo negativo (TNBC) refere-se ao câncer que é negativo para o receptor de estrogênio, receptor de progesterona e receptor do fator de crescimento epidérmico humano 2 (HER2) e é o subtipo mais agressivo de câncer de mama com o pior prognóstico. Além disso, também não há droga terapêutica clinicamente aplicável atualmente. Um estudo de triagem de drogas de TNBC mostrou que IVM pode ser usado como um domínio de interação SIN3 (SID) para bloquear seletivamente a interação entre SID e a-hélice pareada2. Além disso, o IVM regulou a expressão do gene E-caderina relacionado à transição mesenquimal epitelial (EMT) para restaurar a sensibilidade das células TNBC ao tamoxifeno, o que implica a possibilidade de que o IVM funcione como um regulador epigenético no tratamento do câncer.
Estudos recentes também descobriram que a IVM pode promover a morte de células tumorais ao regular o microambiente tumoral no câncer de mama. Sob a estimulação de um microambiente tumoral com um alto nível de trifosfato de adenosina (ATP) fora das células tumorais, a IVM poderia aumentar a liberação mediada por P2 × 4/ P2 × 7/Pannexina-1 da proteína box-1 do grupo de alta mobilidade (HMGB1). No entanto, a liberação de uma grande quantidade de HMGB1 no ambiente extracelular promoverá morte imunogênica mediada por células imunes e reações inflamatórias, que terão um efeito inibitório sobre o crescimento de células tumorais. Portanto, acreditamos que o efeito anticancerígeno do IVM não se limita à citotoxicidade, mas envolve também a regulação do microambiente tumoral. A IVM regula o microambiente tumoral e medeia a morte celular imunogênica, o que pode ser uma nova direção para pesquisas que explorem mecanismos anticancerígenos no futuro.
2.2. Câncer do sistema digestivo
O câncer gástrico é um dos tumores malignos mais comuns em todo o mundo. No ano passado, mais de um milhão de pacientes com câncer gástrico foram diagnosticados em todo o mundo. O estudo de Nambara mostrou que a IVM pode inibir significativamente a proliferação de células cancerígenas gástricas in vivo e in vitro e que o efeito inibitório da IVM depende da expressão da proteína 1 associada ao Yes (YAP1). As linhagens celulares de câncer gástrico MKN1 e SH-10-TC apresentam maior expressão de YAP1 do que as células MKN7 e MKN28, portanto, as células MKN1 e SH-10-TC são sensíveis à IVM, enquanto MKN7 e MKN28 não são sensíveis à IVM. papel na tumorigênese, indicando a possibilidade do uso de IVM como um inibidor de YAP1 para o tratamento do câncer.
Em um estudo que rastreou inibidores da via Wnt, o IVM inibiu a proliferação de vários cânceres, incluindo as linhas celulares de câncer colorretal CC14, CC36, DLD1 e Ls174 T, e promoveu apoptose bloqueando a via Wnt. Após intervenção com IVM, a expressão de caspase-3 em células T DLD1 e Ls174 aumentou, indicando que IVM tem efeito indutor de apoptose e inibe a expressão dos genes downstream AXIN2, LGR5 e ASCL2 na via Wnt/β-catenina. No entanto, o alvo molecular exato da IVM que afeta a via Wnt/β-catenina ainda precisa ser explorado.
O carcinoma hepatocelular é a quarta principal causa de morte por câncer em todo o mundo. Aproximadamente 80% dos casos de câncer de fígado são causados pela infecção pelo vírus da hepatite B (HBV) e pelo vírus da hepatite C (HCV). IVM poderia inibir o desenvolvimento de carcinoma hepatocelular bloqueando a atividade YAP1 em camundongos espontâneos de câncer de fígado Mob1b -/-. O colangiocarcinoma é um tumor maligno que se origina no ducto biliar dentro e fora do fígado. O experimento da Intuyod descobriu que a IVM inibiu a proliferação de células de colangiocarcinoma KKU214 de uma maneira dependente da dose e do tempo. A IVM interrompeu o ciclo celular na fase S e promoveu a apoptose. Surpreendentemente, as células KKU214 resistentes à gencitabina mostraram alta sensibilidade à IVM, o que sugere que a IVM mostra potencial para o tratamento de tumores resistentes aos medicamentos quimioterápicos convencionais.
2.3. Câncer do sistema urinário
O carcinoma de células renais é um tumor maligno fatal do sistema urinário derivado de células epiteliais tubulares renais. Sua morbidade aumentou em média 2% ao ano em todo o mundo e o efeito do tratamento clínico não é satisfatório. Experimentos confirmaram que a IVM pode inibir significativamente a proliferação de cinco linhagens celulares de carcinoma de células renais sem afetar a proliferação de células renais normais, e seu mecanismo pode estar relacionado à indução de disfunção mitocondrial. A IVM pode reduzir significativamente o potencial de membrana mitocondrial e inibir a respiração mitocondrial e a produção de ATP. A presença do combustível mitocondrial acetil-L-carnitina (ALCAR) e do antioxidante N-acetil-L-cisteína (NAC), poderia reverter a inibição induzida pela IVM. Em experimentos com animais, os resultados imuno-histoquímicos para tecidos tumorais tratados com IVM mostraram que a expressão do marcador de estresse mitocondrial HEL foi significativamente aumentada e os resultados foram consistentes com os dos experimentos com células.
O câncer de próstata é um tumor maligno derivado das células epiteliais da próstata, e sua morbidade perde apenas para o câncer de pulmão entre homens nos países ocidentais. No experimento de Nappi, descobriu-se que a IVM poderia aumentar a atividade da droga antiandrogênica enzalutamida na linhagem de células de câncer de próstata LNCaP e reverter a resistência da linhagem de células de câncer de próstata PC3 ao docetaxel. Curiosamente, a IVM também restaurou a sensibilidade do câncer de mama triplo-negativo ao medicamento antiestrogênio tamoxifeno, o que também implica o potencial da IVM para ser usada na terapia endócrina. Além disso, a IVM também foi encontrada para ter um bom efeito inibitório na linha de células de câncer de próstata DU145.
2.4. Câncer hematológico
A leucemia é um tipo de doença clonal maligna causada por células-tronco hematopoiéticas anormais. Em um experimento projetado para rastrear drogas em potencial para o tratamento da leucemia, a IVM matou preferencialmente as células leucêmicas em baixas concentrações sem afetar as células hematopoiéticas normais. O mecanismo foi relacionado ao aumento do influxo de íons cloreto na célula por IVM, resultando em hiperpolarização da membrana plasmática e indução da produção de espécies reativas de oxigênio (EROs). Também foi comprovado que a IVM tem um efeito sinérgico com citarabina e daunorrubicina no tratamento da leucemia. O experimento de Wang descobriu que a IVM pode induzir seletivamente a disfunção mitocondrial e o estresse oxidativo, fazendo com que as células K562 da leucemia mielóide crônica sofram um aumento da apoptose dependente de caspase em comparação com as células normais da medula óssea. Também foi confirmado que a IVM inibiu o crescimento tumoral de maneira dose-dependente e o dasatinibe melhorou a eficácia.
2.5. Câncer do sistema reprodutor
O câncer do colo do útero é uma das neoplasias ginecológicas mais comuns, resultando em aproximadamente 530.000 novos casos e 270.000 mortes em todo o mundo a cada ano. A maioria dos cânceres cervicais são causados pela infecção pelo papilomavírus humano (HPV). A IVM provou inibir significativamente a proliferação e migração de células HeLa e promover a apoptose. Após intervenção com IVM, o ciclo celular das células HeLa foi bloqueado na fase G1/S, e as células apresentaram alterações morfológicas típicas relacionadas à apoptose.
O câncer de ovário é um câncer maligno que não apresenta sintomas clínicos iniciais e tem uma resposta terapêutica pobre. A sobrevida em 5 anos após o diagnóstico é de aproximadamente 47%. Em um estudo de Hashimoto, descobriu-se que a IVM inibiu a proliferação de várias linhagens de células de câncer de ovário, e o mecanismo estava relacionado à inibição da PAK1 quinase. Em pesquisas para rastrear potenciais alvos para o tratamento do câncer de ovário através do uso de uma biblioteca de shRNA e uma biblioteca CRISPR/Cas9, o oncogene KPNB1 foi detectado. A IVM pode bloquear o ciclo celular e induzir a apoptose celular através de um mecanismo dependente de KPNB1 no câncer de ovário. Curiosamente, IVM e paclitaxel têm um efeito sinérgico no câncer de ovário, e o tratamento combinado em experimentos in vivo inibiu quase completamente o crescimento do tumor. Além disso, de acordo com um relatório de Zhang, IVM pode aumentar a eficácia da cisplatina para melhorar o tratamento do câncer de ovário epitelial, e o mecanismo está relacionado à inibição da via Akt/mTOR.
2.6. Glioma cerebral
O glioma é o tumor cerebral mais comum e aproximadamente 100.000 pessoas em todo o mundo são diagnosticadas com glioma todos os anos. O glioblastoma é o glioma mais letal, com um tempo médio de sobrevivência de apenas 14 a 17 meses. Experimentos mostraram que IVM inibiu a proliferação de células G de glioblastoma humano U87 e T98 de maneira dose-dependente e induziu apoptose de maneira dependente de caspase. Isso foi relacionado à indução de disfunção mitocondrial e estresse oxidativo. Além disso, IVM poderia induzir a apoptose de células endoteliais microvasculares do cérebro humano e inibir significativamente a angiogênese. Esses resultados mostraram que a IVM tinha o potencial de resistir à angiogênese tumoral e à metástase tumoral. Em outro estudo, IVM inibiu a proliferação de células de glioma U251 e C6 inibindo a via Akt/mTOR.
Nos gliomas, o miR-21 pode regular a via de sinalização Ras/MAPK e aumentar seus efeitos na proliferação e invasão. A atividade da DDX23 helicase afeta a expressão de miR-12. A IVM pode inibir a via de sinalização DDX23/miR-12, afetando a atividade da DDX23 helicase, inibindo assim comportamentos biológicos malignos. Isso indicou que a IVM pode ser um potencial inibidor de RNA helicase e um novo agente para o tratamento de tumores. No entanto, aqui, devemos enfatizar que, como a IVM não pode passar efetivamente pela barreira hematoencefálica, a perspectiva do uso da IVM no tratamento de gliomas não é otimista.
2.7. Câncer do sistema respiratório
O carcinoma nasofaríngeo é um tumor maligno derivado de células epiteliais da mucosa nasofaríngea. A incidência é obviamente regional e familiar, e a infecção pelo vírus Epstein-Barr (EBV) está intimamente relacionada. Em um estudo que rastreou drogas para o tratamento de câncer de nasofaringe, IVM inibiu significativamente o desenvolvimento de carcinoma de nasofaringe em camundongos nude em doses que não eram tóxicas para timócitos normais. Além disso, a IVM também teve um efeito citotóxico em uma variedade de células cancerígenas da nasofaringe in vitro, e o mecanismo está relacionado à redução da atividade da PAK1 quinase para inibir a via MAPK.
O câncer de pulmão tem a maior morbidade e mortalidade entre os cânceres. Nishio descobriu que a IVM poderia inibir significativamente a proliferação de células de câncer de pulmão H1299 inibindo a atividade YAP1. O experimento de Nappi também provou que a IVM combinada com erlotinib para alcançar um efeito de morte sinérgico regulando a atividade de EGFR e em células de câncer de pulmão HCC827. Além disso, a IVM poderia reduzir a metástase de células de câncer de pulmão inibindo EMT.
2.8. Melanoma
O melanoma é o tumor maligno de pele mais comum, com alta taxa de mortalidade. Medicamentos direcionados a mutações BRAF, como vemurafenibe, dabrafenibe e anticorpos monoclonais PD-1, incluindo pembrolizumabe e nivolumabe, melhoraram muito o prognóstico do melanoma. Gallardo tratou células de melanoma com IVM e descobriu que poderia efetivamente inibir a atividade do melanoma. Curiosamente, a IVM também pode mostrar atividade contra células de melanoma BRAF de tipo selvagem, e sua combinação com dapafinib pode aumentar significativamente a atividade antitumoral. Além disso, foi confirmado que PAK1 é o principal alvo da IVM que medeia sua atividade anti-melanoma, e a IVM também pode reduzir significativamente a metástase pulmonar do melanoma em experimentos com animais. Deng descobriu que a IVM poderia ativar a translocação nuclear de TFE3 e induzir a morte celular autofagia-dependente por desfosforilação de TFE3 (Ser321) em células de melanoma SK-MEL-28. No entanto, o NAC reverteu o efeito da IVM, o que indicou que a IVM aumentou a autofagia dependente de TFE3 através da via de sinalização de ROS.
3. Morte celular programada induzida por IVM em células tumorais e mecanismos relacionados
3.1. Apoptose
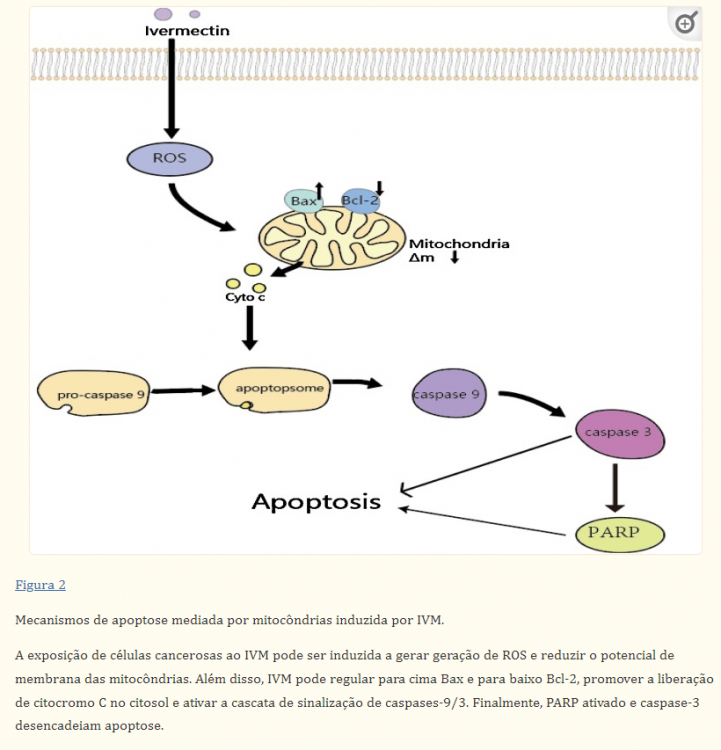
A IVM induz diferentes padrões de morte celular programada em diferentes células tumorais (tabela 1). Como mostrado na tabela 1, a principal forma de morte celular programada induzida por IVM é a apoptose. A apoptose é uma morte celular programada que é regulada por genes para manter a estabilidade celular. Ela pode ser desencadeada por duas vias de ativação: a via endógena de estresse do retículo endoplasmático/mitocondrial e a via exógena do receptor de morte. A diminuição do potencial de membrana mitocondrial e a liberação do citocromo C das mitocôndrias para o citoplasma foi detectada após a intervenção da IVM nas células Hela. Portanto, inferimos que IVM induz apoptose principalmente pela via mitocondrial. Além disso, foram observadas alterações morfológicas causadas pela apoptose, incluindo condensação da cromatina, fragmentação nuclear, fragmentação do DNA e formação de corpos apoptóticos. Finalmente, a IVM alterou o equilíbrio entre as proteínas relacionadas à apoptose, regulando positivamente a proteína Bax e a proteína antiapoptótica Bcl-2, ativando assim a caspase-9/3 para induzir a apoptose (Figura 2 ).

3.2. Autofagia
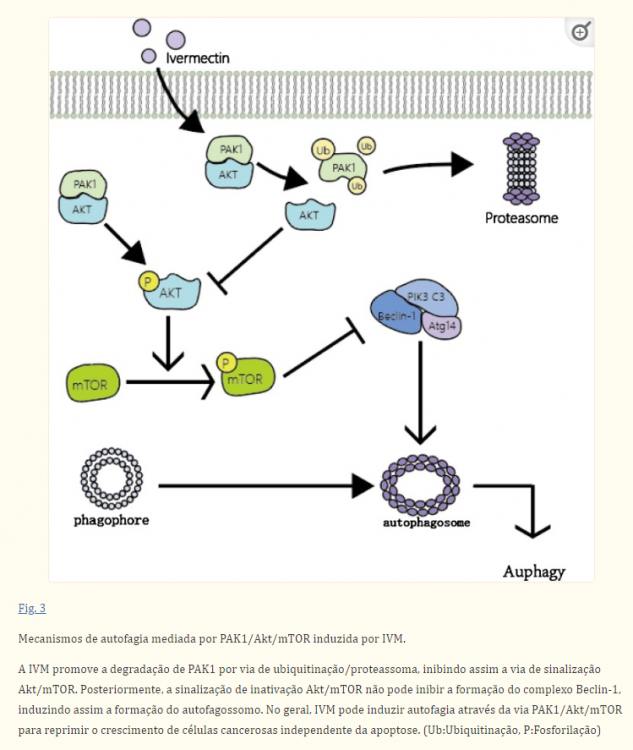
A autofagia é uma forma de morte celular programada dependente de lisossomas. Ele utiliza lisossomos para eliminar organelas supérfluas ou danificadas no citoplasma para manter a homeostase. É caracterizada por estruturas vacuolares de dupla camada ou multicamadas contendo componentes citoplasmáticos, que são conhecidos como autofagossomos. Nos últimos anos, muitos estudos mostraram que a autofagia é uma faca de dois gumes no desenvolvimento de tumores. Por um lado, a autofagia pode ajudar os tumores a se adaptarem à deficiência nutricional do microambiente tumoral e, até certo ponto, proteger as células tumorais de lesões induzidas por quimioterapia ou radioterapia. Por outro lado, alguns ativadores de autofagia podem aumentar a sensibilidade dos tumores à radioterapia e quimioterapia induzindo a autofagia, e a ativação excessiva da autofagia também pode levar à morte das células tumorais. No geral, o ambiente específico das células tumorais determinará se a autofagia aumenta ou inibe o desenvolvimento do tumor e melhorar a atividade da autofagia também se tornou uma nova abordagem na terapia do câncer. A morte celular programada mediada pela autofagia após a intervenção da IVM e o aumento da eficácia anticancerígena da IVM pela regulação da autofagia são tópicos interessantes. A intervenção com IVM nas linhas celulares de câncer de mama MCF-7 e MDA-MB-231 aumentou significativamente o fluxo autofágico intracelular e a expressão de proteínas-chave da autofagia, como LC3, Bclin1, Atg5, e a formação de autofagossomos podem ser observadas. No entanto, depois de usar os inibidores de autofagia cloroquina e wortmannin ou derrubar Bclin1 e Atg5 por siRNA para inibir a autofagia, a atividade anticancerígena de IVM diminuiu significativamente. Isso prova que a IVM exerce principalmente um efeito antitumoral através da via de autofagia. Além disso, os pesquisadores também usaram o ativador de Akt CA-Akt para provar que IVM induz principalmente autofagia por inibir a fosforilação de Akt e mTOR (Fig. 3). O fenômeno da autofagia induzida por IVM também foi relatado em glioma e melanoma. Todos os achados acima indicam o potencial de IVM como um ativador de autofagia para induzir a morte dependente de autofagia em células tumorais.
3.3. Conversa cruzada entre apoptose induzida por IVM e autofagia
A relação entre apoptose e autofagia é muito complicada, e a conversa cruzada entre os dois desempenha um papel vital no desenvolvimento do câncer. Obviamente, os resultados existentes sugerem que a apoptose e a autofagia induzidas por IVM também exibem conversa cruzada. Por exemplo, foi encontrado em células de melanoma SK-MEL-28 que IVM pode promover apoptose, bem como autofagia. Depois de usar o inibidor de autofagia bafilomicina A1 ou siRNA para regular negativamente Beclin1, a apoptose induzida por IVM foi significativamente aumentada, o que sugeriu que a autofagia aprimorada reduzirá a apoptose induzida por IVM e que a autofagia induzida por IVM pode proteger as células tumorais da apoptose. No entanto, em experimentos com células de câncer de mama, também foi descoberto que IVM poderia induzir autofagia, e autofagia aumentada poderia aumentar a atividade anticancerígena de IVM. A pesquisa mais recente mostra que, em circunstâncias normais, a autofagia impedirá a indução de apoptose e a ativação da enzima caspase relacionada à apoptose inibirá a autofagia. No entanto, em circunstâncias especiais, a autofagia também pode ajudar a induzir apoptose ou necrose. Em suma, a relação entre apoptose induzida por IVM e autofagia envolve um mecanismo regulatório complexo, e o mecanismo molecular específico precisa de mais estudos. Acreditamos que a exploração mais profunda do mecanismo pode orientar ainda mais o uso da IVM no tratamento do câncer.
3.4. Piroptose
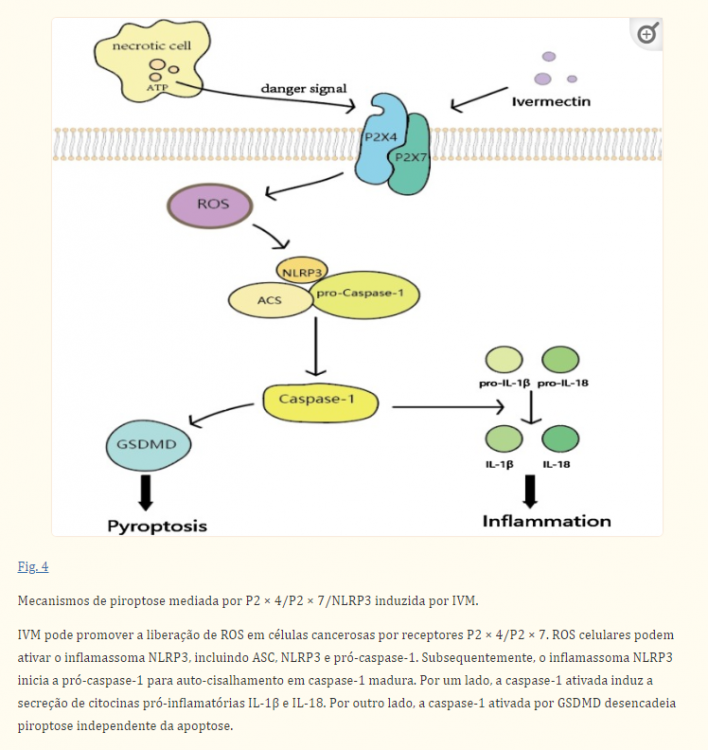
A piroptose é um tipo de morte celular inflamatória induzida por inflamassomas. O inflamassoma é um complexo multimolecular contendo receptor de reconhecimento de padrões (PRR), proteína do tipo speck associada à apoptose contendo um CARD (ASC) e pró-caspase-1. O PRR pode identificar padrões moleculares associados a patógenos (PAMPs) que são estruturalmente estáveis e evolutivamente conservados na superfície de microrganismos patogênicos e padrões moleculares associados a danos (DAMPs) produzidos por células danificadas. Os inflamassomas iniciam a conversão de pró-caspase-1 via auto-cisalhamento em caspase-1 ativada. A caspase-1 ativada pode fazer com que a pró-IL-1β e a pró-IL-18 amadureçam e sejam secretadas. A Gasdermina D (GSDMD) é um substrato para a caspase-1 ativada e é considerada uma proteína chave na execução da piroptose. Em um experimento de Draganov, descobriu-se que a liberação de lactato desidrogenase (LDH) e caspase-1 ativada foi significativamente aumentada em células de câncer de mama após a intervenção com IVM. Além disso, fenômenos característicos de piroptose, como inchaço e ruptura das células, foram observados. Os autores especularam que a IVM pode mediar a ocorrência de piroptose através da via P2 × 4/P2 × 7/NLRP3 (Fig. 4), mas não há evidências específicas para provar essa especulação. Curiosamente, em experimentos de isquemia-reperfusão, a IVM agravou a isquemia renal através da via P2 × 7/NLRP3 e aumentou a liberação de citocinas pró-inflamatórias em células tubulares proximais humanas. Embora existam atualmente poucas evidências mostrando que a IVM induz piroptose, é importante investigar o papel da IVM na indução de piroptose em outros cânceres em estudos futuros e perceber que a IVM pode induzir diferentes tipos de morte celular programada em diferentes tipos de câncer.
4. Efeito anticancerígeno do IVM através de outras vias
4.1. Células-tronco do câncer
As células-tronco cancerígenas (CSCs) são uma população celular semelhante às células-tronco com características de autorrenovação e potencial de diferenciação no tecido tumoral. Embora as CSCs sejam semelhantes às células-tronco em termos de função, devido à falta de um mecanismo de regulação de feedback negativo para a autorrenovação das células-tronco, suas poderosas habilidades de proliferação e diferenciação multidirecional são irrestritas, o que permite que as CSCs mantenham certas atividades durante a quimioterapia e radioterapia. Quando o ambiente externo é adequado, as CSCs proliferam rapidamente para reativar a formação e o crescimento de tumores. Portanto, as CSCs têm sido amplamente reconhecidas como a principal causa de recorrência após o tratamento. Guadalupe avaliou o efeito da IVM em CSCs na linhagem de células de câncer de mama MDA-MB-231. Os resultados experimentais mostraram que a IVM teria como alvo e inibir populações de células ricas em CSCs preferencialmente em comparação com outras populações de células em células MDA-MB-231. Além disso, a expressão da proteína homeobox NANOG, proteína de ligação ao octamer 4 (OCT-4) e SRY-box 2 (SOX-2), que estão intimamente relacionadas com a capacidade de autorrenovação e diferenciação das células-tronco em CSCs, foram também significativamente inibidos pela IVM. Isso sugere que a IVM pode ser usada como um potencial inibidor de CSCs para a terapia do câncer. Outros estudos mostraram que a IVM pode inibir CSCs regulando o eixo PAK1-STAT3.
4.2. Reversão da resistência a múltiplas drogas do tumor
A MDR de células tumorais é a principal causa de recaídas e mortes após quimioterapia. O efluxo de drogas mediado pela família do transporte de ligação de ATP e a super expressão da P-glicoproteína (P-gp) são amplamente considerados as principais causas de MDR tumoral. Vários estudos confirmaram que a IVM pode reverter a resistência aos medicamentos inibindo a P-gp e as proteínas associadas ao MDR. Nos experimentos de Didier testando o efeito da IVM na leucemia linfocítica, a IVM pode ser usada como um inibidor da P-gp para afetar a MDR. No experimento de Jiang, IVM reverteu a resistência à droga da linha celular de câncer colorretal resistente à vincristina HCT-8, da linha celular de câncer de mama resistente à doxorrubicina MCF-7 e da linha celular de leucemia mielóide crônica K562. A IVM inibiu a ativação de EGFR e a via de sinalização ERK/Akt/NF-kappa B a jusante para regular negativamente a expressão de P-gp. Anteriormente, mencionamos o papel da IVM no câncer de próstata resistente ao docetaxel e no colangiocarcinoma resistente à gencitabina. Esses resultados indicaram a importância da aplicação da IVM para o tratamento de pacientes quimioterápicos com MDR.
4.3. Terapia direcionada aprimorada e tratamento combinado
O tratamento direcionado de genes mutados chave no câncer, como EGFR no câncer de pulmão e HER2 no câncer de mama, pode alcançar efeitos clínicos poderosos. A HSP27 é uma proteína chaperona molecular altamente expressa em muitos cânceres e associada à resistência a drogas e prognóstico ruim. É considerado como um novo alvo para a terapia do câncer. Estudos recentes descobriram que a IVM pode ser usada como um inibidor da fosforilação de HSP27 para aumentar a atividade de drogas anti-EGFR em tumores dirigidos por EGFR/HER2. Um experimento descobriu que a IVM poderia aumentar significativamente os efeitos inibitórios de erlotinibe e cetuximabe no câncer de pulmão e câncer colorretal. Anteriormente, mencionamos que a IVM combinada com drogas quimioterápicas convencionais como cisplatina, paclitaxel, daunorrubicina e citarabina, ou com drogas direcionadas como dasatinib e dapafenib apresenta grande potencial para o tratamento do câncer. A combinação de medicamentos pode efetivamente aumentar a eficácia, reduzir a toxicidade ou retardar a resistência aos medicamentos. Portanto, a terapia combinada é o método mais comum de quimioterapia. A IVM tem uma variedade de diferentes mecanismos de ação em diferentes tipos de câncer, e seu potencial para efeitos sinérgicos e maior eficácia na terapia combinada foi de particular interesse para nós. Não só a IVM não se sobrepõe a outras terapias em termos do seu mecanismo de ação, mas o fato da IVM ter múltiplos alvos sugere que não é fácil produzir resistência à IVM. Portanto, estudos e testes contínuos de terapias medicamentosas combinadas seguras e eficazes são essenciais para maximizar os efeitos anticancerígenos da IVM.
5. Alvos moleculares e vias de sinalização envolvidas no potencial anticancerígeno de IVM
Como mencionado acima, o mecanismo anticancerígeno da IVM envolve uma ampla gama de vias de sinalização, como Wnt/β-catenina, Akt/mTOR, MAPK e outros possíveis alvos, como PAK1 e HSP27, além de outros mecanismos de ação. Descobrimos que a IVM inibe o desenvolvimento de células tumorais de maneira dependente de PAK1 na maioria dos cânceres. Consequentemente, nos concentramos em discutir o papel da PAK1 quinase e a comunicação cruzada entre várias vias e PAK1 para fornecer novas perspectivas sobre o mecanismo da função IVM.
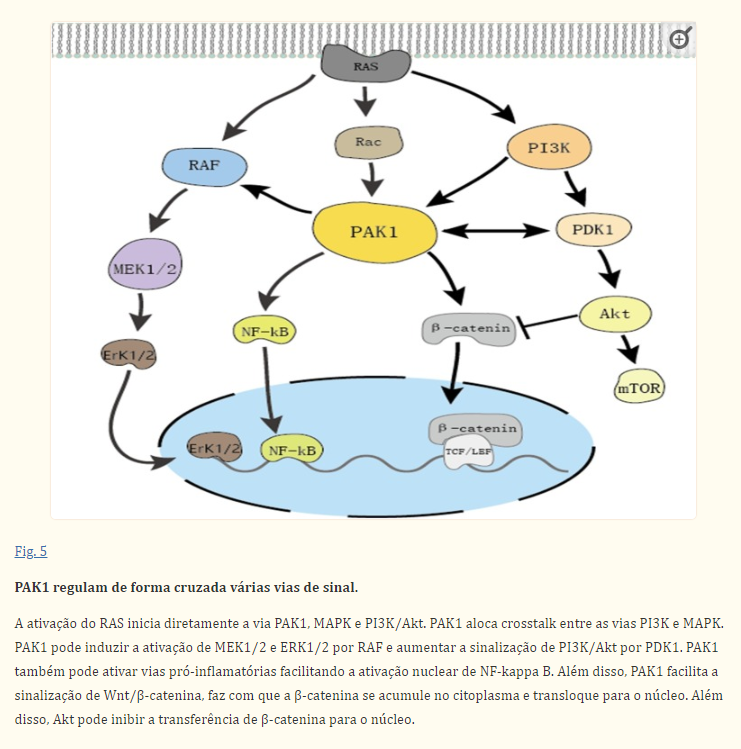
Como membro da família PAK de serina/treonina quinases, PAK1 tem uma infinidade de funções biológicas, como regulação da proliferação e apoptose celular, movimento celular, dinâmica e transformação do citoesqueleto. Estudos anteriores indicaram que a PAK1 está localizada na interseção de múltiplas vias de sinalização relacionadas à tumorigênese e é um regulador chave das redes de sinalização do câncer. (Fig. 5) A ativação excessiva de PAK1 está envolvida na formação, desenvolvimento e invasão de vários tipos de câncer. O direcionamento de PAK1 é um método novo e promissor para o tratamento do câncer, e o desenvolvimento de inibidores de PAK1 atraiu atenção generalizada. A IVM é um inibidor de PAK1 em uma variedade de tumores e tem boa segurança em comparação com outros inibidores de PAK1, como IPA-3. Em melanoma e carcinoma de nasofaringe, IVM inibiu a atividade de proliferação celular inibindo PAK1 para regular negativamente a expressão de MEK 1/2 e ERK1/2. Após a intervenção de IVM no câncer de mama, a expressão de PAK1 também foi inibida significativamente, e o uso de siRNA para regular negativamente a expressão de PAK1 em células tumorais reduziu significativamente a atividade anticancerígena de IVM. Curiosamente, IVM pode inibir a expressão da proteína PAK1, mas não afetou a expressão do mRNA PAK1. O inibidor de proteassoma MG132 reverteu o efeito supressor da IVM, o que indicou que a IVM degradou principalmente PAK1 através da via de ubiquitinação do proteassoma. Já mencionamos que a IVM desempenha um papel anticancerígeno em vários tumores, regulando vias intimamente relacionadas ao desenvolvimento do câncer. PAK1 está na junção dessas vias. No geral, especulamos que IVM pode regular o Akt/mTOR, MAPK e outras vias que são essenciais para a proliferação de células tumorais inibindo a expressão de PAK1, que desempenha um papel anticancerígeno na maioria dos cânceres.
6. Resumo e perspectivas
Os tumores malignos são uma das doenças mais graves que ameaçam a saúde humana e o desenvolvimento social na atualidade, e a quimioterapia é um dos métodos mais importantes para o tratamento de tumores malignos. Nos últimos anos, muitos novos medicamentos quimioterápicos entraram na clínica, mas as células tumorais são propensas à resistência aos medicamentos e reações adversas óbvias a esses medicamentos. Portanto, o desenvolvimento de novas drogas que possam vencer a resistência, melhorar a atividade anticancerígena e reduzir os efeitos colaterais é um problema urgente a ser resolvido na quimioterapia. O reposicionamento de drogas é um atalho para acelerar o desenvolvimento de drogas anticancerígenas.
Como mencionado acima, a droga antiparasitária de amplo espectro IVM, que é amplamente utilizada no campo do controle parasitário, tem muitas vantagens que sugerem que vale a pena desenvolver como uma potencial nova droga anticâncer. A IVM inibe seletivamente a proliferação de tumores em uma dose que não é tóxica para as células normais e pode reverter a MDR dos tumores. É importante ressaltar que a IVM é um medicamento estabelecido usado para o tratamento de doenças parasitárias, como oncocercose e elefantíase. Tem sido amplamente utilizada em humanos há muitos anos, e suas várias propriedades farmacológicas, incluindo efeitos toxicológicos de longo e curto prazo e características do metabolismo de drogas são muito claras. Em voluntários saudáveis, a dose foi aumentada para 2 mg/Kg e não foram encontradas reações adversas graves, enquanto testes em animais como camundongos, ratos. Além disso, IVM também provou mostrar boa permeabilidade em tecidos tumorais. Infelizmente, não houve relatos de ensaios clínicos de IVM como uma droga anticancerígena. Ainda existem alguns problemas que precisam ser estudados e resolvidos antes que a IVM seja usado na clínica.
Embora muitos resultados de pesquisas indiquem que a IVM afeta múltiplas vias de sinalização em células tumorais e inibe a proliferação, a IVM pode causar atividade antitumoral em células tumorais através de alvos específicos. No entanto, até o momento, nenhum alvo exato para ação de IVM foi encontrado. A IVM regula o microambiente tumoral, inibe a atividade das células-tronco tumorais e reduz a angiogênese tumoral e a metástase tumoral. No entanto, não há uma conclusão sistemática e clara sobre o mecanismo molecular relacionado. Portanto, em pesquisas futuras, é necessário continuar a explorar o mecanismo específico de IVM envolvido na regulação do microambiente tumoral, angiogênese e EMT. Tornou-se cada vez mais claro que a IVM pode induzir um modo misto de morte celular envolvendo apoptose, autofagia e piroptose, dependendo das condições celulares e do tipo de câncer. Identificar o contribuinte predominante ou mais importante para a morte celular em cada tipo de câncer e ambiente será crucial para determinar a eficácia dos tratamentos baseados em IVM. A IVM pode aumentar a sensibilidade dos quimioterápicos e reduzir a produção de resistência. Portanto, a MIV deve ser usada em combinação com outras drogas para obter o melhor efeito, enquanto o plano de medicação específico usado para combinar a IVM com outras drogas ainda precisa ser explorado.
A maioria das pesquisas anticancerígenas realizadas na família das avermectinas se concentrou na avermectina e na IVM até agora. Drogas da família avermectina, como selamectina e doramectin também têm efeitos anticancerígenos, conforme relatado anteriormente. Com o desenvolvimento de derivados da família das avermectinas que são mais eficientes e menos tóxicos, pesquisas relevantes sobre o mecanismo anticancerígeno dos derivados ainda têm grande valor. A pesquisa existente é suficiente para demonstrar o grande potencial da IVM e suas perspectivas como uma nova droga anticâncer promissora após pesquisas adicionais. Acreditamos que a IVM pode ser desenvolvida e introduzida clinicamente como parte de novos tratamentos contra o câncer em um futuro próximo.
Declaração de Interesse Concorrente
Os autores não relatam declarações de interesse.
Agradecimentos
Este trabalho foi apoiado pelo Projeto da Equipe de Inovação em Pesquisa Científica de Faculdades e Universidades de Anhui (2016-40), Fundação de Ciências Naturais da Cidade de Bengbu (2019-12), Projetos-Chave de Pesquisa Científica da Faculdade de Medicina de Bengbu (BYKY2019009ZD) e Universidade Nacional Programa de Formação de Estudantes em Inovação e Empreendedorismo (201910367001).
Referências
Campbell WC, Fisher MH, Stapley EO, Albers-Schonberg G., Jacob TA Ivermectina: um novo agente antiparasitário potente. Ciência. 1983; 221 (4613):823-828. doi: 10.1126/science.6308762.
Prichard RK, Geary TG Perspectivas sobre a utilidade da moxidectina para o controle de nematóides parasitas em face do desenvolvimento de resistência anti-helmíntica. Int J Parasitol Drugs Resist. 2019; 10 :69-83. doi: 10.1016/j.ijpddr.2019.06.002.
Ashour DS Ivermectina: Da teoria à aplicação clínica. Agentes Antimicrobianos Int J. 2019; 54 (2):134–142. doi: 10.1016/j.ijantimicag.2019.05.003.
Goudie AC, Evans NA, Gration KA, Bishop BF, Gibson SP, Holdom KS, Kaye B., Wicks SR, Lewis D., Weatherley AJ Doramectin – um endectocida romance potente. Veterinário Parasitol. 1993; 49 (1): 5–15. doi: 10.1016/0304-4017(93)90218-c.
Bishop BF, Bruce CI, Evans NA, Goudie AC, Gration KA, Gibson SP, Pacey MS, Perry DA Walshe ND, Witty MJ Selamectin: um novo endectocida de amplo espectro para cães e gatos. Veterinário Parasitol. 2000; 91 (3-4): 163-176. doi: 10.1016/s0304-4017(00)00289-2.
Laing R., Gillan V., Devaney E. Ivermectina – Velha Droga, Novos Truques? Tendências Parasitol. 2017; 33 (6):463–472. doi: 10.1016/j.pt.2017.02.004.
Crump A. Ivermectina: enigmática e multifacetada “maravilha” continua a surpreender e superar as expectativas. J Antibiot (Tóquio) 2017; 70 (5):495–505. doi: 10.1038/ja.2017.11.
McKerrow JH Reconhecimento do papel dos Produtos Naturais como medicamentos para o tratamento de doenças tropicais negligenciadas pelo Prêmio Nobel de Fisiologia ou Medicina de 2015. Nat Prod Rep. 2015; 32 (12):1610-1611. doi: 10.1039/c5np90043c.
Kane NS, Hirschberg B., Qian S., Hunt D., Thomas B., Brochu R., Ludmerer SW, Zheng Y., Smith M., Arena JP, Cohen CJ, Schmatz D., Warmke J., Cully DF Drosophila resistente a drogas indicam que os canais de cloreto controlados por glutamato são alvos para os antiparasitários ácido nodulispórico e ivermectina. Proc Natl Acad Sci US A. 2000; 97 (25): 13949-13954. doi: 10.1073/pnas.240464697.
Fritz LC, Wang CC, Gorio A. Avermectina B1a bloqueia irreversivelmente os potenciais pós-sinápticos na junção neuromuscular da lagosta, reduzindo a resistência da membrana muscular. Proc Natl Acad Sci US A. 1979; 76 (4):2062–2066. doi: 10.1073/pnas.76.4.2062.
Smit MR, Ochomo EO, Aljayyoussi G., Kwambai TK, Abong’o BO, Chen T., Bousema T., Slater HC, Waterhouse D., Bayoh NM, Gimnig JE, Samuels AM, Desai MR, Phillips-Howard PA, Kariuki SK, Wang D., Ward SA, Ter Kuile FO Segurança e eficácia mosquitocida de altas doses de ivermectina quando coadministrada com diidroartemisinina-piperaquina em adultos quenianos com malária não complicada (IVERMAL): um placebo randomizado, duplo-cego -ensaio controlado. Lancet Infect Dis. 2018; 18 (6):615–626. doi: 10.1016/s1473-3099(18)30163-4.
Foy BD, Alout H., Seaman JA, Rao S., Magalhães T., Wade M., Parikh S., Soma DD, Sagna AB, Fournet F., Slater HC, Bougma R., Drabo F., Diabate A., Coulidiaty AGV, Rouamba N., Dabire RK Eficácia e risco de danos de repetidas administrações em massa de ivermectina para controle da malária (RIMDAMAL): um estudo randomizado em cluster. Lanceta. 2019; 393 (10180): 1517-1526. doi: 10.1016/s0140-6736(18)32321-3.
Udensi UK, Fagbenro-Beyioku AF Efeito da ivermectina em Trypanosoma brucei brucei em camundongos infectados experimentalmente. J Vector Borne Dis. 2012; 49 (3):143–150.
Katz N., Araujo N., Coelho PMZ, Morel CM, Linde-Arias AR, Yamada T., Horimatsu Y., Suzuki K., Sunazuka T., Omura S. Eficácia de ivermectina contra Biomphalaria, vetores de caracol hospedeiro intermediário de Esquistossomose. J Antibiot (Tóquio) 2017; 70 (5):680–684. doi: 10.1038/ja.2017.31.
B.MM, E.-S. AA Potencial terapêutico da mirra e da ivermectina contra a infecção experimental por Trichinella spiralis em camundongos. O jornal coreano de parasitologia. 2013; 51 (3):297–304. doi: 10.3347/kjp.2013.51.3.297.
Hanafi HA, Szumlas DE, Fryauff DJ, El-Hossary SS, Singer GA, Osman SG, Watany N., Furman BD, Hoel DF Efeitos da ivermectina na alimentação sanguínea de Phlebotomus papatasi e no estágio promastigota de Leishmania major. Doença zoonótica transmitida por vetores. 2011; 11 (1):43–52. doi: 10.1089/vbz.2009.0030.
Mastrangelo E., Pezzullo M., De Burghgraeve T., Kaptein S., Pastorino B., Dallmeier K., de Lamballerie X., Neyts J., Hanson AM, Frick DN, Bolognesi M., Milani M. Ivermectin é um potente inibidor da replicação de flavivírus visando especificamente a atividade da NS3 helicase: novas perspectivas para uma droga antiga. J Antimicrob Chemother. 2012; 67 (8):1884-1894. doi: 10.1093/jac/dks147.
Wagstaff KM, Sivakumaran H., Heaton SM, Harrich D., Jans DA Ivermectina é um inibidor específico da importação nuclear mediada por importina alfa/beta capaz de inibir a replicação do vírus HIV-1 e dengue. Biochem J. 2012; 443 (3):851-856. doi: 10.1042/bj20120150.
Caly L., Druce JD, Catton MG, Jans DA, Wagstaff KM O medicamento aprovado pela FDA Ivermectina inibe a replicação do SARS-CoV-2 in vitro. Res. antiviral. 2020:104787. doi: 10.1016/j.antiviral.2020.104787.
Yan S., Ci X., Chen N., Chen C., Li X., Chu X., Li J., Deng X. Efeitos anti-inflamatórios da ivermectina no modelo de rato de asma alérgica. Res. Inflam. 2011; 60 (6): 589–596. doi: 10.1007/s00011-011-0307-8.
Franklin KM, Asatryan L., Jakowec MW, Trudell JR, Bell RL, Davies DL Os receptores P2X4 (P2X4Rs) representam um novo alvo para o desenvolvimento de drogas para prevenir e/ou tratar transtornos por uso de álcool. Neurociência Frontal. 2014; 8 :176. doi: 10.3389/fnins.2014.00176.
Didier A., Loor F. O derivado abamectina ivermectina é um potente inibidor da p-glicoproteína. Drogas Anticancerígenas. 1996; 7 (7):745-751. doi: 10.1097/00001813-199609000-00005.
Markowska A., Kaysiewicz J., Markowska J., Huczynski A. Doxiciclina, salinomicina, monensina e ivermectina reposicionadas como drogas contra o câncer. Bioorg Med Chem Lett. 2019; 29 (13):1549–1554. doi: 10.1016/j.bmcl.2019.04.045.
Juarez M., Schcolnik-Cabrera A., Duenas-Gonzalez A. A droga multidirecionada ivermectina: de um agente antiparasitário a uma droga reposicionada contra o câncer. Am J Câncer Res. 2018; 8 (2):317–331.
Liu J., Zhang K., Cheng L., Zhu H., Xu T. Progresso na compreensão dos mecanismos moleculares subjacentes aos efeitos antitumorais da ivermectina. Drug Des Devel Ther. 2020; 14 :285-296. doi: 10.2147/dddt. S237393.
Antoszczak M., Markowska A., Markowska J., Huczynski A. Vinho velho em garrafas novas: Reaproveitamento de drogas em oncologia. Eur J Pharmacol. 2020; 866 :172784. doi: 10.1016/j.ejphar.2019.172784.
Kobayashi Y., Banno K., Kunitomi H., Tominaga E., Aoki D. Estado atual e perspectivas para o reposicionamento de drogas antecipado no campo do câncer de ovário. J Gynecol Oncol. 2019; 30 (1):e10. doi: 10.3802/jgo.2019.30. e10.
Yoshida GJ Estratégias terapêuticas de reposicionamento de drogas visando autofagia para induzir a morte de células cancerígenas: da fisiopatologia ao tratamento. J Hematol Oncol. 2017; 10 (1):67. doi: 10.1186/s13045-017-0436-9.
Wurth R., Thellung S., Bajetto A., Mazzanti M., Florio T., Barbieri F. Oportunidades de reposicionamento de drogas para a terapia do câncer: novos alvos moleculares para compostos conhecidos. Droga descoberta hoje. 2016; 21 (1):190–199. doi: 10.1016/j.drudis.2015.09.017.
Harbeck N., Penault-Llorca F., Cortes J., Gnant M., Houssami N., Poortmans P., Ruddy K., Tsang J., Cardoso F. Breast cancer. Nat Rev Dis Primers. 2019; 5 (1):66. doi: 10.1038/s41572-019-0111-2.
Ginsburg O., Bray F., Coleman MP, Vanderpuye V., Eniu A., Kotha SR, Sarker M., Huong TT, Allemani C., Dvaladze A., Gralow J., Yeates K., Taylor C., Oomman N., Krishnan S., Sullivan R., Kombe D., Blas MM, Parham G., Kassami N., Conteh L. A carga global dos cânceres das mulheres: um grande desafio na saúde global. Lancet. 2017; 389 (10071):847-860. doi: 10.1016/s0140-6736(16)31392-7.
Dou Q., Chen HN, Wang K., Yuan K., Lei Y., Li K., Lan J., Chen Y., Huang Z., Xie N., Zhang L., Xiang R., Nice EC, Wei Y., Huang C. A ivermectina induz a autofagia citostática ao bloquear o eixo PAK1/Akt no câncer de mama. Câncer Res. 2016; 76 (15):4457–4469. doi: 10.1158/0008-5472.CAN-15-2887.
Diao H., Cheng N., Zhao Y., Xu H., Dong H., Thamm DH, Zhang D., Lin D. A ivermectina inibe o crescimento do tumor mamário canino regulando a progressão do ciclo celular e a sinalização WNT. BMC Vet Res. 2019; 15 (1):276. doi: 10.1186/s12917-019-2026-2.
Diana A., Carlino F., Franzese E., Oikonomidou O., Criscitiello C., De Vita F., Ciardiello F., Orditura M. Câncer de mama triplo negativo precoce: tratamento convencional e paisagens terapêuticas emergentes. Câncer (Basileia) 2020; 12 (4) doi: 10.3390/cancers12040819.
Deepak KGK, Vempati R., Nagaraju GP, Dasari VR, N. S, Rao DN, Malla RR Tumor microambiente: Desafios e oportunidades no direcionamento de metástases de câncer de mama triplo negativo. Farmaco Res. 2020; 153 :104683. doi: 10.1016/j.phrs.2020.104683.
Kwon YJ, Petrie K., Leibovitch BA, Zeng L., Mezei M., Howell L., Gil V., Christova R., Bansal N., Yang S., Sharma R., Ariztia EV, Frankum J., Brough R., Sbirkov Y., Ashworth A., Lord CJ, Zelent A., Farias E., Zhou MM, Waxman S. Inibição seletiva de SIN3 Corepressor com Avermectins como uma nova estratégia terapêutica no câncer de mama triplo-negativo. Mol Câncer Ther. 2015; 14 (8):1824–1836. doi: 10.1158/1535-7163.MCT-14-0980-T.
Draganov D., Gopalakrishna-Pillai S., Chen YR, Zuckerman N., Moeller S., Wang C., Ann D., Lee PP Modulation of P2X4/P2X7/Pannexin-1 sensibilidade ao ATP extracelular via Ivermectina induz uma forma não apoptótica e inflamatória de morte de células cancerígenas. Rep. Científico 2015; 5 :16222. doi: 10.1038/srep16222.
Thanh Huong P., Gurshaney S., Thanh Binh N., Gia Pham A., Hoang Nguyen H., Thanh Nguyen X., Pham-The H., Tran PT, Truong Vu K., Xuan Duong N., Pelucchi C., La Vecchia C., Boffetta P., Nguyen HD, Luu HN Emerging Role of Circulating Tumor Cells in Gastric Cancer. Câncer (Basileia) 2020; 12 (3) doi: 10.3390/cancers12030695.
Nambara S., Masuda T., Nishio M., Kuramitsu S., Tobo T., Ogawa Y., Hu Q., Iguchi T., Kuroda Y., Ito S., Eguchi H., Sugimachi K., Saeki H., Oki E., Maehara Y., Suzuki A., Mimori K. Efeitos antitumorais do agente antiparasitário ivermectina via inibição da expressão da proteína 1 associada a Yes no câncer gástrico. Oncotarget. 2017; 8 (64):107666-107677. doi: 10.18632/oncotarget.22587.
Zanconato F., Cordenonsi M., Piccolo S. YAP e TAZ: um hub de sinalização do microambiente tumoral. Nat Rev Câncer. 2019; 19 (8):454–464. doi: 10.1038/s41568-019-0168-y.
Melotti A., Mas C., Kuciak M., Lorente-Trigos A., Borges I., Ruiz i Altaba A. A droga da cegueira do rio Ivermectina e lactonas macrocíclicas relacionadas inibem as respostas da via WNT-TCF no câncer humano. EMBO Mol Med. 2014; 6 (10):1263-1278. doi: 10.15252/emmm.201404084.
Yang JD, Hainaut P., Gores GJ, Amadou A., Plymoth A., Roberts LR Uma visão global do carcinoma hepatocelular: tendências, risco, prevenção e gestão. Nat Rev Gastroenterol Hepatol. 2019; 16 (10):589–604. doi: 10.1038/s41575-019-0186-y.
Nishio M., Sugimachi K., Goto H., Wang J., Morikawa T., Miyachi Y., Takano Y., Hikasa H., Itoh T., Suzuki SO, Kurihara H., Aishima S., Leask A., Sasaki T., Nakano T., Nishina H., Nishikawa Y., Sekido Y., Nakao K., Shin-Ya K., Mimori K., Suzuki A. YAP1/TAZ e TGF-beta desregulados mediam a sinalização hepatocarcinogênese em camundongos deficientes em Mob1a/1b. Proc Natl Acad Sci US A. 2016; 113 (1):71–80. doi: 10.1073/pnas.1517188113.
Intuyod K., Hahnvajanawong C., Pinlaor P., Pinlaor S. Anti-parasitic Drug Ivermectin Exhibits Potent Anticancer Activity Against Gemcitabine-resistant Cholangiocarcinoma In Vitro. Res. anticâncer. 2019; 39 (9):4837–4843. doi: 10.21873/anticanres.13669.
Wang Y., Su J., Wang Y., Fu D., Ideozu JE, Geng H., Cui Q., Wang C., Chen R., Yu Y., Niu Y., Yue D. A interação de YBX1 com G3BP1 promove metástase de células de carcinoma de células renais via eixo de sinalização YBX1/G3BP1-SPP1-NF-kappaB. J Exp Clin Cancer Res. 2019; 38 (1): 386. doi: 10.1186/s13046-019-1347-0.
Xu WH, Shi SN, Xu Y., Wang J., Wang HK, Cao DL, Shi GH, Qu YY, Zhang HL, Ye DW Implicações prognósticas da expressão de Aquaporina 9 em carcinoma de células renais de células claras. J Transl Med. 2019; 17 (1):363. doi: 10.1186/s12967-019-2113-y.
Siegel RL, Miller KD, Jemal A. Estatísticas do câncer, 2019. CA Cancer J Clin. 2019; 69 (1):7–34. doi: 10.3322/caac.21551.
Zhu M., Li Y., Zhou Z. Antibiótico ivermectina tem como alvo preferencial o câncer renal através da indução de disfunção mitocondrial e dano oxidativo. Comunicações de pesquisa bioquímicos e biofísicos. 2017; 492 (3):373-378. doi: 10.1016/j.bbrc.2017.08.097.
Arcangeli S., Pinzi V., Arcangeli G. Epidemiologia do câncer de próstata e observações de tratamento. Mundial J Radiol. 2012; 4 (6):241–246. doi: 10.4329/wjr. v4.i6.241.
Nappi L., Aguda AH, Nakouzi NA, Lelj-Garolla B., Beraldi E., Lallous N., Thi M., Moore S., Fazli L., Battsogt D., Stief S., Ban F., Nguyen NT, Saxena N., Dueva E., Zhang F., Yamazaki T., Zoubeidi A., Cherkasov A., Brayer GD, Gleave M. A ivermectina inibe HSP27 e potencializa a eficácia do direcionamento de oncogenes em modelos tumorais. J Clin Invest. 2020; 130 (2):699-714. doi: 10.1172/jci130819.
Sharmeen S., Skrtic M., Sukhai MA, Hurren R., Gronda M., Wang X., Fonseca SB, Sun H., Wood TE, Ward R., Minden MD, Batey RA, Datti A., Wrana J., Kelley SO, Schimmer AD O agente antiparasitário ivermectina induz hiperpolarização da membrana dependente de cloreto e morte celular em células de leucemia. Sangue. 2010; 116 (18):3593–3603. doi: 10.1182/sangue-2010-01-262675.
Apperley JF Leucemia mielóide crônica. Lanceta. 2015; 385 (9976): 1447-1459. doi: 10.1016/s0140-6736(13)62120-0.
Wang J., Xu Y., Wan H., Hu J. A ivermectina antibiótica induz seletivamente a apoptose na leucemia mielóide crônica através da indução de disfunção mitocondrial e estresse oxidativo. Biochem Biophys Res Commun. 2018; 497 (1): 241–247. doi: 10.1016/j.bbrc.2018.02.063.
Dong Z., Yu C., Rezhiya K., Gulijiahan A., Wang X. Downregulation de miR-146a promove tumorigênese de células-tronco de câncer cervical via via de sinalização VEGF/CDC42/PAK1. Artif Cells Nanomed Biotechnol. 2019; 47 (1):3711–3719. doi: 10.1080/21691401.2019.1664560.
Carneiro SR, da Silva Lima AA, de Fátima Silva Santos G., de Oliveira CSB, Almeida MCV, da Conceição Nascimento Pinheiro M. Relação entre Estresse Oxidativo e Atividade Física em Mulheres com Lesões Intraepiteliais Escamosas em um Programa de Controle do Câncer Cervical na amazônia brasileira. Oxid Med Cell Longev. 2019; 2019 doi: 10.1155/2019/8909852.
Zhang P., Zhang Y., Liu K., Liu B., Xu W., Gao J., Ding L., Tao L. A ivermectina induz a parada do ciclo celular e apoptose de células HeLa via via mitocondrial. Prolif Celular. 2019; 52 (2):e12543. doi: 10.1111/cpr.12543.
Moufarrij S., Dandapani M., Arthofer E., Gomez S., Srivastava A., Lopez-Acevedo M., Villagra A., Chiappinelli KB Terapia epigenética para câncer de ovário: promessa e progresso. Clin Epigenética. 2019; 11 (1):7. doi: 10.1186/s13148-018-0602-0.
Hashimoto H., Messerli SM, Sudo T., Maruta H. A ivermectina inativa a quinase PAK1 e bloqueia o crescimento dependente de PAK1 do câncer de ovário humano e das linhas de células tumorais NF2. Drug Descobrir Ther. 2009; 3 (6):243–246.
Kodama M., Kodama T., Newberg JY, Katayama H., Kobayashi M., Hanash SM, Yoshihara K., Wei Z., Tien JC, Rangel R., Hashimoto K., Mabuchi S., Sawada K. , Kimura T., Copeland NG, Jenkins NA As telas de perda de função in vivo identificam KPNB1 como um novo oncogene drogável no câncer de ovário epitelial. Proc Natl Acad Sci US A. 2017; 114 (35):E7301–E7310. doi: 10.1073/pnas.1705441114.
Zhang X., Qin T., Zhu Z., Hong F., Xu Y., Zhang X., Xu X., Ma A. A ivermectina aumenta a eficácia in vitro e in vivo da cisplatina no câncer epitelial de ovário ao suprimir Sinalização Akt/mTOR. Am J Med Sci. 2020; 359 (2): 123-129. doi: 10.1016/j.amjms.2019.11.001.
Molinaro AM, Taylor JW, Wiencke JK, Wrensch MR Epidemiologia genética e molecular do glioma difuso adulto. Nat Rev Neurol. 2019; 15 (7):405–417. doi: 10.1038/s41582-019-0220-2.
Wen PY, Kesari S. Gliomas malignos em adultos. N Engl J Med. 2008; 359 (5): 492-507. doi: 10.1056/NEJMra0708126.
Liu Y., Fang S., Sun Q., Liu B. A droga anti-helmíntica ivermectina inibe a angiogênese, o crescimento e a sobrevivência do glioblastoma através da indução de disfunção mitocondrial e estresse oxidativo. Biochem Biophys Res Commun. 2016; 480 (3): 415–421. doi: 10.1016/j.bbrc.2016.10.064.
Liu J., Liang H., Chen C., Wang X., Qu F., Wang H., Yang K., Wang Q., Zhao N., Meng J., Gao A. Ivermectina induz autofagia mediada e morte celular através da via de sinalização AKT/mTOR em células de glioma. Biosci Rep. 2019; 39 (12) doi: 10.1042/bsr20192489.
Kwak HJ, Kim YJ, Chun KR, Woo YM, Park SJ, Jeong JA, Jo SH, Kim TH, Min HS, Chae JS, Choi EJ, Kim G., Shin SH, Gwak HS, Kim SK, Hong EK, Lee GK, Choi KH, Kim JH, Yoo H., Park JB, Lee SH Downregulation of Spry2 por miR-21 desencadeia malignidade em gliomas humanos. Oncogene. 2011; 30 (21):2433–2442. doi: 10.1038/onc.2010.620.
Yin J., Park G., Lee JE, Choi EY, Park JY, Kim TH, Park N., Jin X., Jung JE, Shin D., Hong JH, Kim H., Yoo H., Lee SH, Kim YJ, Park JB, Kim JH DEAD-box RNA helicase DDX23 modula a malignidade do glioma através da elevação da biogênese do miR-21. Cérebro. 2015; 138 (Pt 9): 2553-2570. doi: 10.1093/brain/awv167.
Kircik LH, Del Rosso JQ, Layton AM, Schauber J. Mais de 25 anos de experiência clínica com ivermectina: uma visão geral de segurança para um número crescente de indicações. J Drogas Dermatol. 2016; 15 (3):325–332.
Chen YP, Chan ATC, Le QT, Blanchard P., Sun Y., Ma J. Carcinoma nasofaríngeo. Lancet. 2019; 394 (10192):64-80. doi: 10.1016/s0140-6736(19)30956-0.
Gallardo F., Mariamé B., Gence R., Tilkin-Mariamé A.‑F. As lactonas macrocíclicas inibem a proliferação de células de carcinoma nasofaríngeo através da inibição de PAK1 e reduzem o crescimento tumoral in vivo. Design, Desenvolvimento e Terapia de Medicamentos. 2018; 12 :2805–2814. doi: 10.2147/dddt. S172538.
Thawani R., McLane M., Beig N., Ghose S., Prasanna P., Velcheti V., Madabhushi A. Radiômica e radiogenômica no câncer de pulmão: uma revisão para a clínica. Câncer de pulmão. 2018; 115 :34-41. doi: 10.1016/j.lungcan.2017.10.015.
Patel H., Yacoub N., Mishra R., White A., Long Y., Alanazi S., Garrett JT Avanços Atuais no Tratamento do Melanoma Mutante BRAF. Câncer (Basileia) 2020; 12 (2) doi: 10.3390/cancers12020482.
Franken MG, Leeneman B., Gheorghe M., Uyl-de Groot CA, Haanen J., van Baal PHM Uma revisão sistemática da literatura e meta-análise de rede de resultados de eficácia e segurança em melanoma avançado. Eur J Câncer. 2019; 123 :58-71. doi: 10.1016/j.ejca.2019.08.032.
Gallardo F., Teiti I., Rochaix P., Demilly E., Jullien D., Mariamé B., Tilkin-Mariamé A.-F. As lactonas macrocíclicas bloqueiam o crescimento do melanoma, o desenvolvimento de metástases e potencializam a atividade dos inibidores anti-BRAF V600. Câncer de Pele Clínica. 2016; 1 (1):4–14. doi: 10.1016/j.clsc.2016.05.001. e3. [ CrossRef ] [ Google Acadêmico ]
Deng F., Xu Q., Long J., Xie H. A supressão da autofagia dependente de ROS-TFE3 aumenta a apoptose induzida por ivermectina em células de melanoma humano. Revista de Bioquímica Celular. 2018; 120 (2): 1702-1715. doi: 10.1002/jcb.27490.
Nagata S. Apoptose e depuração de células apoptóticas. Annu Rev Immunol. 2018; 36 :489-517. doi: 10.1146/annurev-immunol-042617-053010.
Degterev A., Yuan J. Expansão e evolução de programas de morte celular. Nat Rev Mol Cell Biol. 2008; 9 (5):378–390. doi: 10.1038/nrm2393.
Galluzzi L., Green DR Autophagy-Independent Functions of the Autophagy Machinery. Célula. 2019; 177 (7): 1682-1699. doi: 10.1016/j.cell.2019.05.026.
Levy JMM, Towers CG, Thorburn A. Targeting autophagy in cancer. Nat Rev Câncer. 2017; 17 (9):528–542. doi: 10.1038/nrc.2017.53.
Gewirtz DA As quatro faces da autofagia: implicações para a terapia do câncer. Câncer Res. 2014; 74 (3):647–651. doi: 10.1158/0008-5472.Can-13-2966.
Galluzzi L., Pietrocola F., Bravo-San Pedro JM, Amaravadi RK, Baehrecke EH, Cecconi F., Codogno P., Debnath J., Gewirtz DA, Karantza V., Kimmelman A., Kumar S., Levine B., Maiuri MC, Martin SJ, Penninger J., Piacentini M., Rubinsztein DC, Simon HU, Simonsen A., Thorburn AM, Velasco G., Ryan KM, Kroemer G. Autofagia na transformação maligna e progressão do câncer. Embo j. 2015; 34 (7):856-880. doi: 10.15252/embj.201490784.
Galluzzi L., Bravo-San Pedro JM, Demaria S., Formenti SC, Kroemer G. Ativando a autofagia para potencializar a quimioterapia imunogênica e a radioterapia. Nat Rev Clin Oncol. 2017; 14 (4):247–258. doi: 10.1038/nrclinonc.2016.183.
Ravegnini G., Sammarini G., Nannini M., Pantaleo MA, Biasco G., Hrelia P., Angelini S. Tumores estromais gastrointestinais (GIST): Enfrentando a morte celular entre autofagia e apoptose. Autofagia. 2017; 13 (3):452–463. doi: 10.1080/15548627.2016.1256522.
Marino G., Niso-Santano M., Baehrecke EH, Kroemer G. Autoconsumo: a interação de autofagia e apoptose. Nat Rev Mol Cell Biol. 2014; 15 (2):81–94. doi: 10.1038/nrm3735.
Fang Y., Tian S., Pan Y., Li W., Wang Q., Tang Y., Yu T., Wu X., Shi Y., Ma P., Shu Y. Piroptose: Uma nova fronteira em câncer. Farmacêutico Biomédico. 2020; 121 :109595. doi: 10.1016/j.biopha.2019.109595.
Gong T., Liu L., Jiang W., Zhou R. DAMP-sensing receptores em inflamação estéril e doenças inflamatórias. Nat Rev Immunol. 2020; 20 (2):95-112. doi: 10.1038/s41577-019-0215-7.
Liu X., Zhang Z., Ruan J., Pan Y., Magupalli VG, Wu H., Lieberman J. A gasdermina D ativada pelo inflamassoma causa piroptose pela formação de poros de membrana. Natureza. 2016; 535 (7610): 153-158. doi: 10.1038/nature18629.
Zheng Z., Li G. Mecanismos e Regulação Terapêutica de Piroptose em Doenças Inflamatórias e Câncer. Int J Mol Sci. 2020; 21 (4) doi: 10.3390/ijms21041456.
Han SJ, Lovaszi M., Kim M., D’Agati V., Hasko G., Lee HT P2X4 receptor exacerba AKI isquêmica e induz a sinalização do inflamassoma NLRP3 tubular proximal renal. Faseb j. 2020; 34 (4):5465–5482. doi: 10.1096/fj.201903287R.
O’Brien CA, Kreso A., Jamieson CH Células-tronco cancerosas e auto-renovação. Clin Cancer Res. 2010; 16 (12):3113–3120. doi: 10.1158/1078-0432.CCR-09-2824.
Huang Z., Wu T., Liu AY, Ouyang G. Potenciais de diferenciação e transdiferenciação de células-tronco cancerosas. Oncotarget. 2015; 6 (37):39550–39563. doi: 10.18632/oncotarget.6098.
Bao S., Wu Q., McLendon RE, Hao Y., Shi Q., Hjelmeland AB, Dewhirst MW, Bigner DD, Rich JN As células-tronco de glioma promovem a radioresistência pela ativação preferencial da resposta ao dano do DNA. Natureza. 2006; 444 (7120): 756-760. doi: 10.1038/nature05236.
Dean M., Fojo T., Bates S. Tumor células-tronco e resistência a drogas. Nat Rev Câncer. 2005; 5 (4):275–284. doi: 10.1038/nrc1590.
Li X., Lewis MT, Huang J., Gutierrez C., Osborne CK, Wu MF, Hilsenbeck SG, Pavlick A., Zhang X., Chamness GC, Wong H., Rosen J., Chang JC Resistência intrínseca de células tumorigênicas de câncer de mama à quimioterapia. J Natl Cancer Inst. 2008; 100 (9):672–679. doi: 10.1093/jnci/djn123.
Diehn M., Células-tronco do câncer de Clarke MF e radioterapia: novos insights sobre a radiorresistência tumoral. J Natl Cancer Inst. 2006; 98 (24):1755-1757. doi: 10.1093/jnci/djj505.
Dominguez-Gomez G., Chavez-Blanco A., Medina-Franco JL, Saldivar-Gonzalez F., Flores-Torrontegui Y., Juarez M., Diaz-Chavez J., Gonzalez-Fierro A., Duenas-Gonzalez A. Ivermectina como inibidor de células cancerígenas. Mol Med Rep. 2018; 17 (2):3397–3403. doi: 10.3892/mmr.2017.8231.
Kim JH, Choi HS, Kim SL, Lee DS A via de sinalização PAK1-Stat3 ativa a transcrição do gene IL-6 e a formação de células-tronco de câncer de mama humano. Câncer (Basileia) 2019; 11 (10) doi: 10.3390/cancers11101527.
Wang J., Seebacher N., Shi H., Kan Q., Duan Z. Novas estratégias para prevenir o desenvolvimento de resistência a múltiplas drogas (MDR) no câncer. Oncotarget. 2017; 8 (48):84559–84571. doi: 10.18632/oncotarget.19187.
Niazi M., Zakeri-Milani P., Najafi Hajivar S., Soleymani Goloujeh M., Ghobakhlou N., Shahbazi Mojarrad J., Valizadeh H. Estratégias baseadas em nano para superar a resistência a drogas mediada por glicoproteína p. Especialista Opin Drug Metab Toxicol. 2016; 12 (9):1021–1033. doi: 10.1080/17425255.2016.1196186.
Dong J., Qin Z., Zhang WD, Cheng G., Yehuda AG, Ashby CR, Jr., Chen ZS, Cheng XD, Qin JJ Estratégias de química medicinal para descobrir inibidores da glicoproteína-P: Uma atualização. Atualização de resistência a drogas. 2020; 49 :100681. doi: 10.1016/j.drup.2020.100681.
Kibria G., Hatakeyama H., Harashima H. Resistência a múltiplas drogas de câncer: mecanismos envolvidos e estratégias para contornar o uso de um sistema de entrega de drogas. Arch Pharm Res. 2014; 37 (1):4–15. doi: 10.1007/s12272-013-0276-2.
Lespine A., Dupuy J., Orlowski S., Nagy T., Glavinas H., Krajcsi P., Alvinerie M. Interaction of ivermectina com proteínas de resistência a múltiplas drogas (MRP1, 2 e 3) Chem Biol Interact. 2006; 159 (3):169–179. doi: 10.1016/j.cbi.2005.11.002.
Pouliot JF, L’Heureux F., Liu Z., Prichard RK, Georges E. Reversão da resistência a múltiplas drogas associada à glicoproteína-P por ivermectina. Biochem Pharmacol. 1997; 53 (1):17–25. doi: 10.1016/s0006-2952(96)00656-9.
Lespine A., Martin S., Dupuy J., Roulet A., Pineau T., Orlowski S., Alvinerie M. Interação de lactonas macrocíclicas com glicoproteína-P: relação estrutura-afinidade. Eur J Pharm Sci. 2007; 30 (1):84-94. doi: 10.1016/j.ejps.2006.10.004.
Jiang L., Wang P., Sun YJ, Wu YJ A ivermectina reverte a resistência a drogas em células cancerosas através da via EGFR/ERK/Akt/NF-kappaB. J Exp Clin Cancer Res. 2019; 38 (1):265. doi: 10.1186/s13046-019-1251-7.
Loibl S., Gianni L. câncer de mama HER2-positivo. Lanceta. 2017; 389 (10087): 2415-2429. doi: 10.1016/s0140-6736(16)32417-5.
Lim SM, Syn NL, Cho BC, Soo RA Resistência adquirida à terapia direcionada de EGFR em câncer de pulmão de células não pequenas: Mecanismos e estratégias terapêuticas. Tratamento do Câncer Rev. 2018; 65 :1-10. doi: 10.1016/j.ctrv.2018.02.006.
Choi SK, Kam H., Kim KY, Park SI, Lee YS Visando a proteína 27 de choque térmico no câncer: um alvo drogável para o tratamento do câncer? Câncer (Basileia) 2019; 11 (8) doi: 10.3390/cancers11081195.
Kumar R., Gururaj AE, Barnes CJ quinases ativadas por p21 no câncer. Nat Rev Câncer. 2006; 6 (6):459–471. doi: 10.1038/nrc1892.
Rane CK, Minden A. P21 ativado quinase sinalização no câncer. Semin Cancer Biol. 2019; 54 :40–49. doi: 10.1016/j.semcancer.2018.01.006.
Dammann K., Khare V., Gasche C. Traçando PAKs de inflamação GI ao câncer. Intestino. 2014; 63 (7):1173–1184. doi: 10.1136/gutjnl-2014-306768.
Kumar R., Li DQ PAKs na progressão do câncer humano: do início ao câncer terapêutico para a futura oncobiologia. Adv Câncer Res. 2016; 130 :137-209. doi: 10.1016/bs.acr.2016.01.002.
Guzzo CA, Furtek CI, Porras AG, Chen C., Tipping R., Clineschmidt CM, Sciberras DG, Hsieh JY, Lasseter KC Segurança, tolerabilidade e farmacocinética da escalada de altas doses de ivermectina em indivíduos adultos saudáveis. J Clin Pharmacol. 2002; 42 (10):1122-1133. doi: 10.1177/009127002401382731.
Geyer J., Gavrilova O., Petzinger E. Penetração cerebral de ivermectina e selamectina em camundongos knockout deficientes em mdr1a, b P-glicoproteína e bcrp. J Vet Pharmacol Ther. 2009; 32 (1):87-96. doi: 10.1111/j.1365-2885.2008.01007. x.
Gao A., Wang X., Xiang W., Liang H., Gao J., Yan Y. Reversão de resistência a múltiplas drogas mediada por glicoproteína-P in vitro por doramectina e nemadectina. J Pharm Pharmacol. 2010; 62 (3):393–399. doi: 10.1211/jpp.62.03.0016.
