RESULTADOS E DISCUSSÃO
A ivermectina inibe a importação nuclear de múltiplas proteínas de carga Impα/β1
Recentemente, usamos triagem de alto rendimento para identificar vários compostos, incluindo mifepristona, como inibidores específicos do reconhecimento de IN por Impα/β1 (22). Além disso, vários compostos, incluindo a ivermectina, foram identificados que também foram capazes de inibir o reconhecimento por Impα/β1 de SV40 T-ag (4), levantando a possibilidade de que a ivermectina possa inibir especificamente a importação nuclear dependente de Impα/β1 em geral, e representam assim uma ferramenta valiosa para estudar o transporte nuclear. Para construir sobre essas observações preliminares, várias proteínas de localização nuclear foram expressas como proteínas de fusão GFP em células HeLa e tratadas com ou sem ivermectina ou mifepristona como controle. (figura 1 e tabela 1). Estes incluíram IN e T-ag, bem como as proteínas reconhecidas por Impα/β DENV NS5, p53 e hCMV UL44, e a TRF1 reconhecida por Impβ1. Como esperado (22), a acumulação nuclear IN foi inibida significativamente na presença de ivermectina e mifepristona, enquanto a acumulação nuclear T-ag foi inibida pela ivermectina, mas não pela mifepristona. É importante ressaltar que todas as outras proteínas de carga não foram afetadas pelo tratamento com mifepristona, consistente com o fato da mifepristona ser um inibidor altamente específico da acumulação nuclear de IN. Significativamente, o acúmulo nuclear de todas as proteínas de carga contendo NLSs reconhecidos por Impα/β1 foi reduzido (P<0,01) na presença de ivermectina, enquanto tal efeito não foi observado para TRF1, que é transportado para o núcleo de maneira dependente de Impβ1 sozinho. Esses resultados implicam que a ivermectina é um inibidor de amplo espectro da importação nuclear mediada por Impα/β1, através de um efeito no heterodímero Impα/β1.
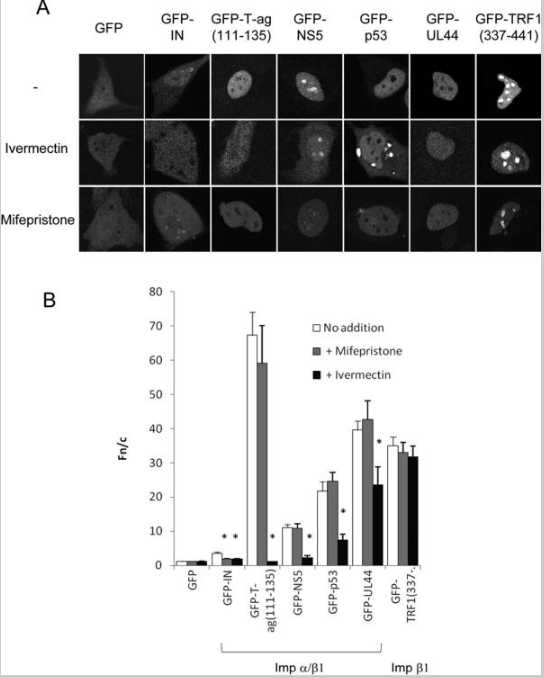
A ivermectina inibe a importação nuclear dependente de Impα/β1, mas não de Impβ1, enquanto a mifepristona inibe especificamente o acúmulo nuclear IN
(A) Imagens típicas de CLSM de células HeLa expressando as proteínas de fusão GFP indicadas 24h após a transfecção, tratadas com ou sem ivermectina 25 μM ou mifepristona 50 μM conforme indicado por 1h antes da imagem. (B) Resultados (média ± SEM, n>89) para análise quantitativa de imagens como as de (A) para determinar a razão de fluorescência nuclear para citoplasmática (Fn/c); * P <0,01.
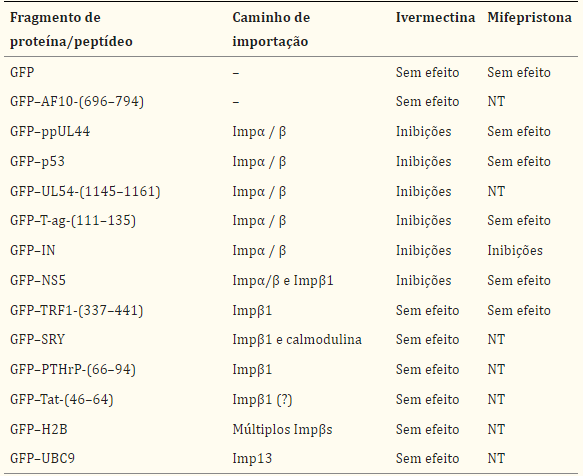
Resumo dos dados para os efeitos da ivermectina ou mifepristona na importação nuclear de uma série de cargas importadas por diferentes vias de importação nuclear
Os fragmentos peptídicos estão indicados por parênteses, indicando os resíduos do péptido; caso contrário, as proteínas eram de comprimento total. NT, não testado. AF10 é transportado para o núcleo independentemente de Imps através de interações diretas com nucleoporinas (29). Tat foi relatado para ser reconhecido diretamente por Impβ1 (27), mas mostrou ter um mecanismo de importação nuclear independente de Imp in vitro (28).
A ivermectina não afeta o acúmulo nuclear de proteínas de carga contendo NLSs reconhecidos por outros Imps
Para confirmar a especificidade da ação da ivermectina, várias proteínas de fusão GFP contendo NLSs reconhecidas por uma variedade de Imps foram expressas em células HeLa e tratadas com/sem ivermectina por 1h antes da imagem. Resultados (Figura 2 e tabela 1) indicam que a ivermectina apenas inibiu o acúmulo nuclear de hCMV UL54, que contém NLSs clássicos reconhecidos por Impα/β1 (40, 41). Em contraste, nenhum efeito foi observado em SRY ou PTHrP, que ambos contêm NLSs reconhecidos por Impβ1 (6, 42, 43), consistente com o observado para TRF1. Curiosamente, a histona H2B, que contém pelo menos dois NLSs e acredita-se que seja importada para o núcleo por vários homólogos de Impβ diferentes (44–46) também não foi afetada pela ivermectina, o que implica que a ivermectina não afeta essas várias vias de importação nuclear. Da mesma forma, a enzima conjugadora de SUMO UBC9, que é importada para o núcleo através da ação de Imp13 (47), não foi afetado pela ivermectina. Esses resultados (resumidos na tabela 1) indicam que a ivermectina é específica para cargas de importação nuclear reconhecidas por Impα/β1 e não tem efeito em nenhuma das outras vias de importação nuclear testadas, incluindo aquela mediada apenas por Impβ1.
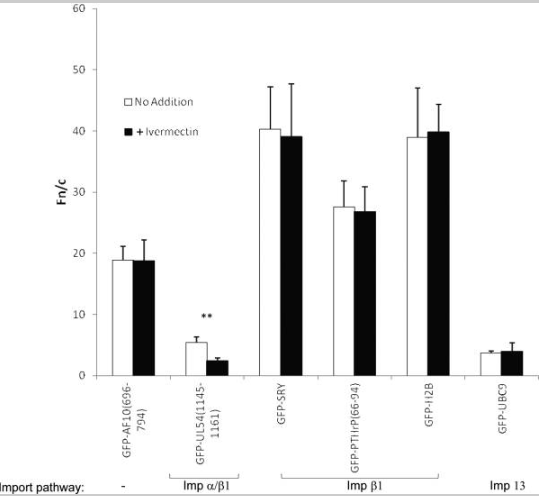
A ivermectina é um inibidor Impα/β1 de amplo espectro que não afeta outras vias de importação nuclear
As células HeLa transfectadas para expressar as proteínas de fusão GFP indicadas foram tratadas com ou sem 25 μM de ivermectina por 1h antes da imagem de células vivas 24h após a transfecção. Os resultados (média ± SEM, n>68) foram determinados conforme descrito na figura 1(B); ** P<0,001.
A ivermectina inibe a infecção por HIV-1 e DENV que dependem do transporte nuclear mediado por Impα/β1
A importação nuclear de proteínas virais é fundamental para o ciclo de vida de muitos vírus, incluindo muitos vírus de RNA que se replicam exclusivamente no citoplasma, como DENV, vírus sincicial respiratório e raiva (2, 3, 31, 48, 49). No caso do HIV, o vírus gera um PIC (complexo de pré-integração), que consiste no cDNA viral recém-transcrito e vários HIV (por exemplo, IN) e proteínas do hospedeiro. O PIC é então transportado para o núcleo provavelmente através da ação do IN (26), após o qual o IN integra o cDNA viral no genoma da célula hospedeira, o que é essencial para a infecção produtiva (50). Devido a estas funções nucleares críticas do IN, é provável que a inibição da importação nuclear do IN impeça a infecção produtiva pelo HIV. Para testar isso formalmente, células HeLa foram infectadas com NL4-3.Luc.RE-HIV pseudotipado 200 ng/titulação de VSV-G e a infecção foi sincronizada a 4°C por 2h. As titulações duplicadas foram então tratadas com ivermectina por 2h ou mifepristone por 6h e a infectividade viral foi medida pela atividade relativa da luciferase 48h após a infecção. (Figura 3A). Surpreendentemente, em comparação com as titulações de controle de DMSO, o tratamento com ivermectina em concentrações tão baixas quanto 25 μM por apenas 2h foi capaz de reduzir significativamente a produção de vírus; sob essas condições, não há essencialmente nenhuma toxicidade observável induzida pelos vários tratamentos (LD 50 os valores de ivermectina e mifepristona em 50% de células HeLa confluentes incubadas por 24h com cada composto foram 150 μM e 33 mM, respectivamente; o ensaio foi realizado usando o Ensaio de Citotoxicidade Invitrogen Multitox Fluor Multiplex). Isso é consistente com o fato de a ivermectina ser capaz de geralmente inibir a importação nuclear mediada por Impα/β1, que é essencial para a infecção pelo HIV e a primeira demonstração de que os inibidores da importação nuclear podem ter atividade antiviral potente. A mifepristona também inibiu significativamente a infectividade do HIV (Figura 3A), como esperado, consistente com sua capacidade de inibir especificamente a atividade de importação nuclear IN.
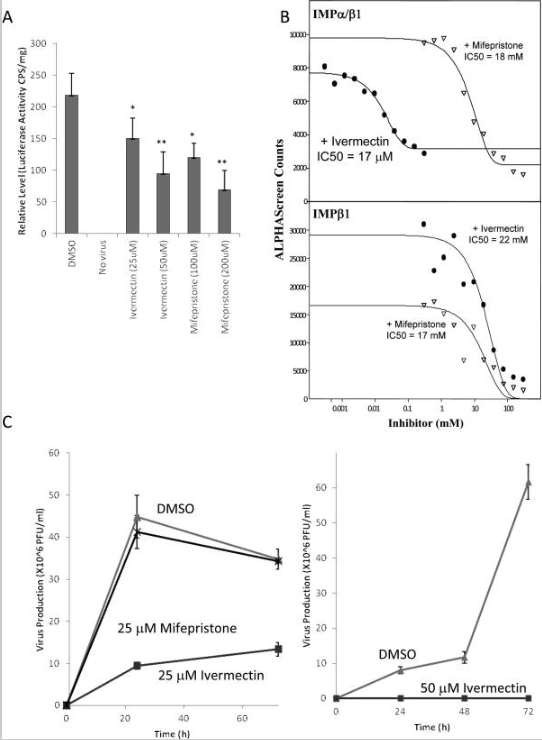
Ivermectina pode inibir infecção por HIV-1 e DENV
(A) As células HeLa foram infectadas com 200 ng (equivalente à proteína do capsídeo) de NL4-3.Luc.RE-HIV pseudotipado VSV-G, tratadas com ou sem os agentes indicados (concentração entre parênteses, μM) 2h após a infecção por 6h, então o meio foi removido e as células foram colhidas para medição da atividade repórter de luciferase. Os valores de LD 50 para ivermectina e mifepristona em 50% de células HeLa confluentes incubadas por 24h com cada composto foram 150 μM e 33 mM, respectivamente. Os resultados são médias ± SEM para uma média de quatro repetições; * P<0,05, ** P<0,01. (B) Curvas de inibição de ligação AlphaScreen para DENV NS5 e os Imps indicados. Os ensaios foram realizados conforme descrito na seção Materiais e métodos usando 30 μM HisProteína NS5 6-tagged e 30 μM de Impα/β1 biotinilado, na presença das concentrações indicadas de controle de ivermectina, mifepristona ou DMSO (veículo). (C) As células Vero foram tratadas com ou sem 25 μM (esquerda) ou 50 μM (direita) ivermectina ou mifepristona (como indicado) por 3h antes da infecção com DENV-2. O meio de cultura celular foi coletado e os títulos virais foram analisados em vários momentos após a infecção por ensaio de placa. PFU, unidades formadoras de placas.
No caso do DENV, foi demonstrado anteriormente que, apesar de seu papel crítico na replicação viral, que ocorre no citoplasma, a maioria da proteína DENV NS5 é encontrada no núcleo durante certas partes do ciclo de vida infeccioso do vírus e essa mutação de resíduos críticos no NLS reconhecido por Impα/β1 inibe severamente a produção de vírus (3). Como primeiro passo para investigar o uso de ivermectina como tratamento anti-DENV, a inibição da ligação de NS5 a Impα/β1 foi examinada pela primeira vez usando nosso ensaio de ligação proteína-proteína AlphaScreen. Verificou-se que a ivermectina inibe fortemente a ligação de Impα/β1 a NS5 (IC 50= 17μM, Figura 3B), mas não de Impβ1 sozinho para NS5 (IC 50> 22mM; deve-se notar que NS5 contém um NLS secundário reconhecido por Impβ1 sozinho que, em contraste com o NLS reconhecido por Impα/β1, não é essencial para NS5 nuclear acumulação) (3). Isso indica que a ivermectina é capaz de interromper especificamente a interação entre NS5 e Impα/β1. A mifepristona, em contraste, não mostrou nenhum efeito significativo na ligação de NS5 a qualquer Imp como esperado.
Para testar se a ivermectina pode inibir a infecção por DENV, as células Vero foram tratadas com ou sem ivermectina por 3 h antes da infecção com DENV-2. (Figura 3C). A ivermectina, em contraste com a mifepristona, aboliu quase completamente a produção de vírus quando utilizada a 50 μM e reduziu significativamente a produção de vírus a 25 μM, consistente com o papel crítico que a importação nuclear desempenha no ciclo de vida do DENV (3). Deve-se notar que o presente estudo teve como objetivo provar o princípio de que um inibidor da importação nuclear de proteína viral pode ter propriedades antivirais e não está propondo de forma alguma que a ivermectina deva ser usada a 25 μM ou algo próximo disso para tratar doenças virais. Neste contexto, também deve ser lembrado que não foram realizados experimentos de otimização ou análises rigorosas de dose-resposta; no entanto, mostra que os inibidores do transporte nuclear podem ser agentes antivirais potentes e fornecem uma plataforma para o desenvolvimento de antivirais no futuro.
Em resumo, os resultados do presente estudo mostram que a ivermectina é um novo inibidor da importação de proteína nuclear mediada especificamente por Impα/β1; o acúmulo nuclear de todas as cargas reconhecidas por Impα/β1 testadas até o momento pode ser inibida por tratamentos curtos com ivermectina sob condições que não levam à citotoxicidade, sem efeito na importação nuclear mediada por outros Imps, como Impβ1 sozinho ou Imp13. Nosso trabalho recente demonstrando que a ivermectina inibe a ligação de Impα2 a IN e NS5 mesmo na ausência de Impβ1 no ensaio AlphaScreen (SM Heaton, KM Wagstaff e DA Jans, trabalho não publicado) implica fortemente que o modo de ação da ivermectina é provavelmente através da ligação para o bolso de ligação de NLS de Impα, impedindo-o de reconhecer proteínas de carga contendo NLS, em vez de mecanismos alternativos, como interferir na heterodimerização de Impα/β. Isso está em forte contraste com os inibidores de importação nuclear de pequenas moléculas direcionados a Impβ1 que impedem a ligação ao RanGTP/liberação de carga. (10, 14), que são principalmente inadequados para o trabalho em células vivas devido a problemas de captação e precipitação e não são altamente eficientes em inibir a importação nuclear em todas as células. Mais importante ainda, no presente estudo, demonstramos pela primeira vez que inibidores de importação nuclear, como a ivermectina, podem ser potentes agentes antivirais, capazes de inibir significativamente a produção de HIV-1 e DENV em sistemas celulares infectados.
Além da importância das observações do presente estudo em termos do potencial uso da ivermectina no futuro para fins de pesquisa, os resultados sugerem que a importação nuclear de proteínas virais específicas é claramente um alvo viável para o desenvolvimento de antivirais urgentemente necessários para combater algumas das principais doenças do mundo. Compostos específicos na inibição da importação nuclear de proteínas virais, como a mifepristona, como mostrado no presente estudo, surgem como possibilidades interessantes neste contexto e são o foco de trabalhos futuros neste laboratório.
CONTRIBUIÇÃO DO AUTOR
Kylie Wagstaff projetou e executou a maioria dos experimentos (exceto conforme indicado) e escreveu, redigiu e editou o artigo antes da submissão. Haran Sivakumaran realizou o ensaio de infecciosidade do HIV (Figura 3UMA). Steven Heaton realizou alguns dos ensaios de infectividade do DENV (Figura 3C, painel esquerdo). David Harrich supervisionou/forneceu conhecimentos técnicos sobre os ensaios de infecciosidade do HIV. David Jans supervisionou/forneceu conhecimento técnico em todos os aspectos dos procedimentos experimentais e avaliou/editou criticamente o artigo antes da submissão.
RECONHECIMENTOS
Agradecemos a Cassandra David pela cultura de tecidos de rotina realizada para o presente estudo. Algumas das imagens confocais usadas no presente estudo foram realizadas nas instalações Monash Micro Imaging, Monash University, Clayton.
FINANCIAMENTO
Este trabalho é apoiado pelo National Health and Medical Research Council (concessão do projeto número 606409; e bolsa número APP1002486) e o Australian Research Council (bolsa número DP110104437).
REFERÊNCIAS
1- Hogarth C. A., Calanni S., Jans D. A., Loveland K. L. Importin α mRNAs have distinct expression profiles during spermatogenesis. Dev. Dyn. 2006; 235:253 – 262.
2- Moseley G. W., Filmer R. P., DeJesus M. A., Jans D. A. Nucleocytoplasmic distribution of rabies virus P-protein is regulated by phosphorylation adjacent to C-terminal nuclear import and export signals. Biochemistry (Moscow) 2007; 46:12053 – 12061.
3- Pryor M. J., Rawlinson S. M., Butcher R. E., Barton C. L., Waterhouse T. A., Vasudevan S. G., Bardin P. G., Wright P. J., Jans D. A., Davidson A. D. Nuclear localization of dengue virus nonstructural protein 5 through its importin α/β-recognized nuclear localization sequences is integral to viral infection. Traffic. 2007; 8:795 – 807.
4- Forwood J. K., Jans D. A. Nuclear import pathway of the telomere elongation suppressor TRF1: inhibition by importin α Biochemistry (Moscow) 2002; 41:9333 – 9340.
5- Forwood J. K., Lam M. H., Jans D. A. Nuclear import of Creb and AP-1 transcription factors requires importin-β1 and Ran but is independent of importin-α Biochemistry (Moscow) 2001; 40:5208–5217.
6- Lam M. H., Briggs L. J., Hu W., Martin T. J., Gillespie M. T., Jans D. A. Importin β recognizes parathyroid hormone-related protein with high affinity and mediates its nuclear import in the absence of importin α J. Biol. Chem. 1999; 274:7391 – 7398.
7- Lam M. H., Thomas R. J., Loveland K. L., Schilders S., Gu M., Martin T. J., Gillespie M. T., Jans D. A. Nuclear transport of parathyroid hormone (PTH)-related protein is dependent on microtubules. Mol. Endocrinol. 2002; 16:390 – 401.
8- Ambrus G., Whitby L. R., Singer E. L., Trott O., Choi E., Olson A. J., Boger D. L., Gerace L. Small molecule peptidomimetic inhibitors of importin α/β mediated nuclear transport. Bioorg. Med. Chem. 2010; 18:7611 – 7620.
9- Cansizoglu A. E., Lee B. J., Zhang Z. C., Fontoura B. M., Chook Y. M. Structure-based design of a pathway-specific nuclear import inhibitor. Nat. Struct. Mol. Biol. 2007; 14:452 – 454.
10- Hintersteiner M., Ambrus G., Bednenko J., Schmied M., Knox A. J., Meisner N. C., Gstach H., Seifert J. M., Singer E. L., Gerace L., Auer M. Identification of a small molecule inhibitor of importin β mediated nuclear import by confocal on-bead screening of tagged one-bead one-compound libraries. ACS Chem. Biol. 2010; 5:967 – 979.
11- Hou Y., McGuinness D. E., Prongay A. J., Feld B., Ingravallo P., Ogert R. A., Lunn C. A., Howe J. A. Screening for antiviral inhibitors of the HIV integrase–LEDGF/p75 interaction using the AlphaScreen luminescent proximity assay. J. Biomol. Screening. 2008; 13:406 – 414.
12- Kosugi S., Hasebe M., Entani T., Takayama S., Tomita M., Yanagawa H. Design of peptide inhibitors for the importin α/β nuclear import pathway by activity-based profiling. Chem. Biol. 2008; 15:940 – 949.
13- Mata M. A., Satterly N., Versteeg G. A., Frantz D., Wei S., Williams N., Schmolke M., Peña-Llopis S., Brugarolas J., Forst C. V., et al. Chemical inhibition of RNA viruses reveals REDD1 as a host defense factor. Nat. Chem. Biol. 2011; 7:712 – 719.
14- Soderholm J. F., Bird S. L., Kalab P., Sampathkumar Y., Hasegawa K., Uehara-Bingen M., Weis K., Heald R. Importazole, a small molecule inhibitor of the transport receptor importin-β ACS Chem. Biol. 2011; 6:700 – 708.
15- Wigle T. J., Herold J. M., Senisterra G. A., Vedadi M., Kireev D. B., Arrowsmith C. H., Frye S. V., Janzen W. P. Screening for inhibitors of low-affinity epigenetic peptide–protein interactions: an AlphaScreen-based assay for antagonists of methyl-lysine binding proteins. J. Biomol. Screening. 2010; 15:62 – 71.
16- Zhang J. H., Chung T. D., Oldenburg K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J. Biomol. Screening. 1999; 4:67 – 73.
17- Flint S. J., Huang W., Goodhouse J., Kyin S. A peptide inhibitor of exportin1 blocks shuttling of the adenoviral E1B 55 kDa protein but not export of viral late mRNAs. Virology. 2005; 337:7 – 17.
18- Kau T. R., Schroeder F., Ramaswamy S., Wojciechowski C. L., Zhao J. J., Roberts T. M., Clardy J., Sellers W. R., Silver P. A. A chemical genetic screen identifies inhibitors of regulated nuclear export of a Forkhead transcription factor in PTEN-deficient tumor cells. Cancer Cell. 2003; 4:463 – 476.
19- Kau T. R., Way J. C., Silver P. A. Nuclear transport and cancer: from mechanism to intervention. Nat. Rev. Cancer. 2004; 4:106 – 117.
20- Meissner T., Krause E., Vinkemeier U. Ratjadone and leptomycin B block CRM1-dependent nuclear export by identical mechanisms. FEBS Lett. 2004; 576:27 – 30.
21- Mutka S. C., Yang W. Q., Dong S. D., Ward S. L., Craig D. A., Timmermans P. B., Murli S. Identification of nuclear export inhibitors with potent anticancer activity in vivo. Cancer Res. 2009; 69:510–517.
22- Wagstaff K. M., Rawlinson S. M., Hearps A. C., Jans D. A. An AlphaScreen®- based assay for high-throughput screening for specific inhibitors of nuclear import. J. Biomol. Screening. 2011; 16:192 – 200.
23- Babalola O. E. Ocular onchocerciasis: current management and future prospects. Clin. Ophthalmol. 2011; 5:1479 – 1491.
24- Victoria J., Trujillo R. Topical ivermectin: a new successful treatment for scabies. Pediatr. Dermatol. 2001; 18:63 – 65.
25- Strycharz J. P., Yoon K. S., Clark J. M. A new ivermectin formulation topically kills permethrin-resistant human head lice (Anoplura: Pediculidae) J. Med. Entomol. 2008; 45:75 – 81.
26- Hearps A. C., Jans D. A. HIV-1 integrase is capable of targeting DNA to the nucleus via an importin α/β-dependent mechanism. Biochem. J. 2006; 398:475 – 484.
27- Efthymiadis A., Briggs L. J., Jans D. A. The HIV-1 Tat nuclear localization sequence confers novel nuclear import properties. J. Biol. Chem. 1998; 273:1623 – 1628.
28- Truant R., Cullen B. R. The arginine-rich domains present in human immunodeficiency virus type 1 Tat and Rev function as direct importin β-dependent nuclear localization signals. Mol. Cell. Biol. 1999; 19:1210 – 1217.
29- Cai Y., Gao Y., Sheng Q., Miao S., Cui X., Wang L., Zong S., Koide S. S. Characterization and potential function of a novel testis-specific nucleoporin BS-63. Mol. Reprod. Dev. 2002; 61:126 – 134.
30- Wagstaff K. M., Glover D. J., Tremethick D. J., Jans D. A. Histone-mediated transduction as an efficient means for gene delivery. Mol. Ther. 2007; 15:721 – 731.
31- Rawlinson S. M., Pryor M. J., Wright P. J., Jans D. A. CRM1-mediated nuclear export of dengue virus RNA polymerase NS5 modulates interleukin-8 induction and virus production. J. Biol. Chem. 2009; 284:15589 – 15597.
32- Poon I. K., Oro C., Dias M. M., Zhang J., Jans D. A. Apoptin nuclear accumulation is modulated by a CRM1-recognized nuclear export signal that is active in normal but not in tumor cells. Cancer Res. 2005; 65:7059 – 7064.
33- Poon I. K., Oro C., Dias M. M., Zhang J. P., Jans D. A. A tumor cell-specific nuclear targeting signal within chicken anemia virus VP3/apoptin. J. Virol. 2005; 79:1339 – 1341.
34- Wagstaff K. M., Jans D. A. Intramolecular masking of nuclear localization signals: analysis of importin binding using a novel AlphaScreen-based method. Anal. Biochem. 2006; 348:49 – 56.
35- Hubner S., Xiao C. Y., Jans D. A. The protein kinase CK2 site (Ser111/112) enhances recognition of the simian virus 40 large T-antigen nuclear localization sequence by importin. J. Biol. Chem. 1997; 272:17191 – 17195.
36- Xiao C. Y., Hubner S., Jans D. A. SV40 large tumor antigen nuclear import is regulated by the double-stranded DNA-dependent protein kinase site (serine 120) flanking the nuclear localization sequence. J. Biol. Chem. 1997; 272:22191 – 22198.
37- Wagstaff K. M., Fan J. Y., De Jesus M. A., Tremethick D. J., Jans D. A. Efficient gene delivery using reconstituted chromatin enhanced for nuclear targeting. FASEB J. 2008; 22:2232 – 2242.
38- Gualano R. C., Pryor M. J., Cauchi M. R., Wright P. J., Davidson A. D. Identification of a major determinant of mouse neurovirulence of dengue virus type 2 using stably cloned genomic-length cDNA. J. Gen. Virol. 1998; 79:437 – 446.
39- Pryor M. J., Gualano R. C., Lin B., Davidson A. D., Wright P. J. Growth restriction of dengue virus type 2 by site-specific mutagenesis of virus-encoded glycoproteins. J. Gen. Virol. 1998; 79:2631 – 2639.
40- Alvisi G., Ripalti A., Ngankeu A., Giannandrea M., Caraffi S. G., Dias M. M., Jans D. A. Human cytomegalovirus DNA polymerase catalytic subunit pUL54 possesses independently acting nuclear localization and ppUL44 binding motifs. Traffic. 2006; 7:1322 – 1332.
41- Cimica V., Chen H. C., Iyer J. K., Reich N. C. Dynamics of the STAT3 transcription factor: nuclear import dependent on Ran and importin-β1. PLoS ONE. 2011;6:e20188.
42- Kaur G., Jans D. A. Dual nuclear import mechanisms of sex determining factor SRY: intracellular Ca2+ as a switch. FASEB J. 2011; 25:665 – 675.
43- Lam M. H., Hu W., Xiao C. Y., Gillespie M. T., Jans D. A. Molecular dissection of the importin β1-recognized nuclear targeting signal of parathyroid hormone-related protein. Biochem. Biophys. Res. Commun. 2001; 282:629 – 634.
44- Jakel S., Albig W., Kutay U., Bischoff F. R., Schwamborn K., Doenecke D., Gorlich D. The importin β/importin 7 heterodimer is a functional nuclear import receptor for histone H1. EMBO J. 1999; 18:2411 – 2423.
45- Langer T. Nuclear transport of histone 2b in mammalian cells is signal- and energy-dependent and different from the importin α/β-mediated process. Histochem. Cell Biol. 2000; 113:455 – 465.
46- Mosammaparast N., Guo Y., Shabanowitz J., Hunt D. F., Pemberton L. F. Pathways mediating the nuclear import of histones H3 and H4 in yeast. J. Biol. Chem. 2002; 277:862 – 868.
47- Mingot J. M., Kostka S., Kraft R., Hartmann E., Gorlich D. Importin 13: a novel mediator of nuclear import and export. EMBO J. 2001;20:3685 – 3694.
48- Fulcher A. J., Jans D. A. Regulation of nucleocytoplasmic trafficking of viral proteins: an integral role in pathogenesis? Biochim. Biophys. Acta. 2011; 1813:2176 – 2190.
49- Ghildyal R., Ho A., Wagstaff K. M., Dias M. M., Barton C. L., Jans P., Bardin P., Jans D. A. Nuclear import of the respiratory syncytial virus matrix protein is mediated by importin beta1 independent of importin α Biochemistry (Moscow) 2005; 44:12887 – 12895.
50- Tavassoli A. Targeting the protein–protein interactions of the HIV lifecycle. Chem. Soc. Rev. 2011; 40:1337 – 1346.