A IVERMECTINA CONVERTE TUMORES FRIOS EM QUENTES E CRIA SINERGIA COM O BLOQUEIO DO PONTO DE CONTROLE IMUNOLÓGICO PARA O TRATAMENTO DO CÂNCER DE MAMA
RESUMO
Mostramos que o tratamento com o fármaco antiparasitário aprovado pela FDA, ivermectina, induz a morte imunogênica de células cancerígenas (CDI) e infiltração robusta de células T em tumores de mama. Como um modulador alostérico do eixo ATP/P2X4/P2X7 que opera em células cancerígenas e imunes, a ivermectina também atinge seletivamente populações imunossupressoras, incluindo células mielóides e Tregs, resultando em aumento da relação Teff/Tregs. Embora nenhum dos agentes sozinhos tenha mostrado eficácia in vivo, a terapia combinada com ivermectina e o anticorpo anti-PD1 inibidor do checkpoint alcançou sinergia na limitação do crescimento do tumor (p = 0,03) e promoveu respostas completas (p < 0,01), também levando à imunidade contra a reintrodução contralateral com respostas imunes antitumorais demonstradas. Indo além dos tumores primários, essa combinação alcançou redução significativa na recidiva após tratamento neoadjuvante (p = 0,03) e adjuvante (p < 0,001) e curas potenciais na doença metastática (p < 0,001). A modelagem estatística confirmou a atividade sinérgica genuína tanto no adjuvante (p = 0,007) quanto nas configurações metastáticas (p < 0,001). A ivermectina tem efeitos imunomoduladores duplos e indutores de CDI no câncer de mama, convertendo tumores frios em quentes, portanto, representa um parceiro mecanicista racional com bloqueio de checkpoint.
INTRODUÇÃO
O bloqueio do ponto de verificação surgiu como uma abordagem revolucionária que utiliza o próprio sistema imunológico do paciente para tratar o câncer. No entanto, os inibidores de checkpoint como agentes únicos são eficazes apenas em um subconjunto de pacientes e tipos de câncer. Estudos recentes sugerem que a eficácia dos inibidores de checkpoint é principalmente limitada a cânceres já infiltrados por células T – geralmente chamados de tumores “quentes”. Em contraste, os tumores “frios” têm pouca ou nenhuma infiltração de células T e geralmente não respondem ao bloqueio do checkpoint. Estudos clínicos com terapia de bloqueio de checkpoint no câncer de mama têm se concentrado no câncer de mama triplo negativo (TNBC), porque esse subtipo tem uma carga mutacional maior e é considerado mais “imunogênico”. Enquanto um estudo de fase inicial Ib (KEYNOTE-012) da monoterapia com pembrolizumabe (anticorpo anti-PD1) mostrou evidências preliminares de atividade clínica em um pequeno subconjunto (18,5%) de pacientes com TNBC avançado, o estudo de fase 3 (KEYNOTE-119) mostrou sem melhora em relação à quimioterapia. Além da monoterapia, o bloqueio do checkpoint mais combinações de quimioterapia estão sendo investigados. Atezolizumabe (anticorpo anti-PDL1) em combinação com nab-paclitaxel demonstrou eficácia para PD-L1-positivo não ressecável localmente avançado ou TNBC metastático em IMpassion130, levando à primeira aprovação da FDA de terapia de ponto de controle imunológico para câncer de mama em março 2019. No entanto, IMpassion131 (atezolizumabe + paclitaxel) foi recentemente relatado como negativo. Esses resultados destacam o desafio contínuo do câncer de mama para terapias de ponto de controle imunológico. Como tal, há uma necessidade considerável de identificar drogas capazes de preparar tumores de mama (transformar tumores “frios” em “quentes”) para sinergizar com o bloqueio do checkpoint.
Um fenômeno recentemente descrito, denominado morte celular imunogênica (CDI), é uma forma de morte celular que induz uma resposta imune do hospedeiro. O CDI se distingue da apoptose clássica e de outras formas não imunogênicas ou tolerogênicas de morte celular por várias características, incluindo a liberação de trifosfato de adenosina (ATP) e proteína box 1 do grupo de alta mobilidade (HMGB1) e exposição superficial de calreticulina. Em pacientes com câncer, as respostas imunes antitumorais baseadas no CDI estão ligadas a resultados benéficos produzidos por alguns agentes quimioterápicos convencionais. Por exemplo, a eficácia das antraciclinas no câncer de mama e da oxaliplatina no câncer colorretal correlaciona-se com aumentos pós-tratamento na proporção de linfócitos T CD8 + citotóxicos para células T regulatórias FoxP3 + dentro do tumor. Em contraste, respostas ruins à quimioterapia em tumores sólidos estão associadas à linfopenia. Assim, a quimioterapia indutora de CDI parece funcionar em conjunto com o sistema imunológico do hospedeiro para obter eficácia. No entanto, a quimioterapia é uma faca de dois gumes: pode suprimir e também estimular as células imunológicas. Um agente que induz ICD de células cancerígenas sem suprimir a função imunológica seria ideal para combinação com bloqueio de checkpoint. Buscando tal agente entre os medicamentos aprovados pela FDA, nosso grupo descobriu que o agente antiparasitário ivermectina promove ICD em células de câncer de mama. Entre nossas descobertas anteriores, havia evidências de que a ivermectina, uma droga antiparasitária usada em todo o mundo desde 1975, modula a via purinérgica P2X4/P2X7, sugerindo que a ivermectina pode aproveitar ainda mais os altos níveis extracelulares intrínsecos de ATP dos tumores para atividade anticancerígena. É importante observar que o purinoceptor P2X4 e o purinoceptor P2X7 (P2X4/P2X7) são amplamente expressos em várias subpopulações imunes, sugerindo que a ivermectina também pode ter efeitos imunomoduladores diretos.
RESULTADOS
Ivermectina pode transformar tumores de mama “frios” em “quentes”
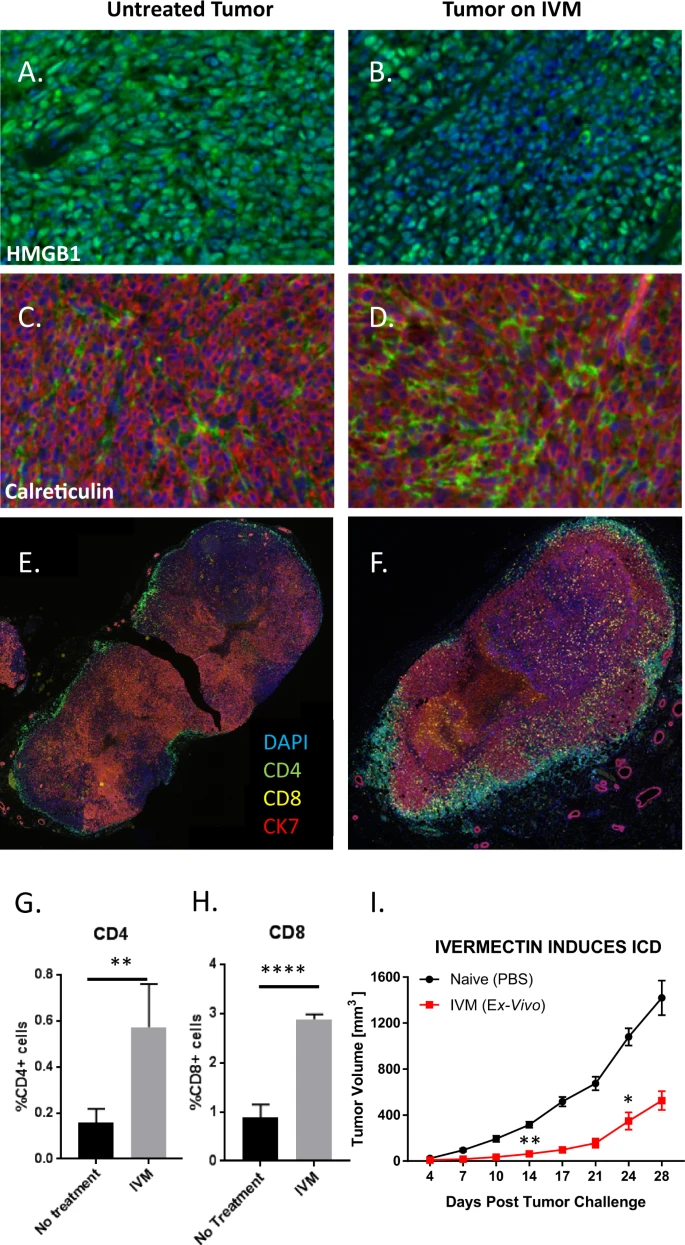
Estudamos os efeitos da ivermectina in vivo usando o modelo de camundongo 4T1 de TNBC. A HMGB1 é uma proteína da cromatina presente em todas as células e sua liberação é uma marca registrada da CID. A coloração de HMGB1 (verde) foi observada uniformemente em todo o tumor de camundongos não tratados (Fig. 1A). Em contraste, tumores isolados de camundongos tratados com ivermectina mostraram grandes áreas de células DAPI-positivas sem HMGB1 (Fig. 1B), sugerindo que HMGB1 havia sido liberado no espaço extracelular. O tratamento com ivermectina também alterou a expressão de calreticulina, com níveis mais altos (verde) observados em tumores de animais tratados, indicando um aumento significativo neste sinal e mediador profagocítico associado a ICD (Fig. 1C, D). A exposição de calreticulina endossômica na superfície de células estressadas, danificadas ou moribundas promove a fagocitose imunogênica e a apresentação cruzada de antígenos, antagonizando os sinais “não me coma” associados ao CD47 e os sinais tolerogênicos “coma-me” associados à fosfatidilserina (PS), enquanto promove a interação com seu receptor de proteína relacionada ao receptor de lipoproteína de baixa densidade (LRP) em células fagocíticas. Infiltração robusta de células T CD4 + e CD8 + foi observada em tumores tratados com ivermectina (Fig. 1F), mas não em tumores não tratados (Fig. 1E). Porcentagens significativamente maiores de células foram positivas para CD4 (p <0,01, Fig. 1G) e CD8 (p < 0,0001, Fig. 1H) em tumores tratados com ivermectina do que em tumores não tratados. Juntos, esses dados indicam que o tratamento com ivermectina induziu marcadores de ICD em tumores de mama 4T1 e recrutou grandes números de células T CD4 + e CD8 + para esses tumores. Para confirmar ainda mais que a ivermectina induz ICD in vivo, também utilizamos uma abordagem clássica de vacinação considerada como padrão-ouro para a detecção de ICD: tratamento de células 4T1 com IVM para induzir ICD in vitro seguido de inoculação em camundongos virgens, então subsequente desafio com Células 4T1 vivas para demonstrar a prevenção do crescimento tumoral. Este experimento informou uma possível indução de boa-fé ICD demonstrando proteção contra desafio subsequente com células 4T1 vivas (p < 0,01, Fig. 1I).
Fig. 1: O tratamento com ivermectina induz a morte celular imunogênica (CDI) in vivo e o recrutamento de células T para os tumores.
Tumores de mama 4T1 foram isolados de camundongos não tratados (painéis à esquerda) ou tratados com ivermectina (painéis à direita) diariamente por 14 dias. Os painéis A, B mostram coloração para HMGB1 (verde), uma marca registrada do CDI. Os painéis C, D mostram coloração para calreticulina (verde), outra característica do CDI. A coloração para CK7 (vermelho) identifica células 4T1. Os dados são representativos de dois experimentos independentes. Os painéis E, F mostram coloração para CD4 + (verde), células T CD8 + (amarelo) e células cancerígenas por meio de coloração para CK7 (vermelho). Os dados são representativos de três experimentos independentes. Painéis G, Hexibir dados quantitativos sobre a infiltração de células T mostrados em E, F. Os dados foram obtidos pela quantificação de cinco campos aleatórios de imagens de tumores inteiros. O painel I demonstra o efeito protetor da vacinação subcutânea profilática com 1 milhão de células 4T1 tratadas com 12 μM de ivermectina ex vivo (24 h), depois desafiadas contralateralmente com células 4T1 vivas 1 semana após a vacinação (n = 4). A significância estatística foi avaliada usando o modelo linear de efeitos mistos de log do volume do tumor; * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001, **** p ≤ 0,0001.
Efeitos imunomoduladores diretos da ivermectina
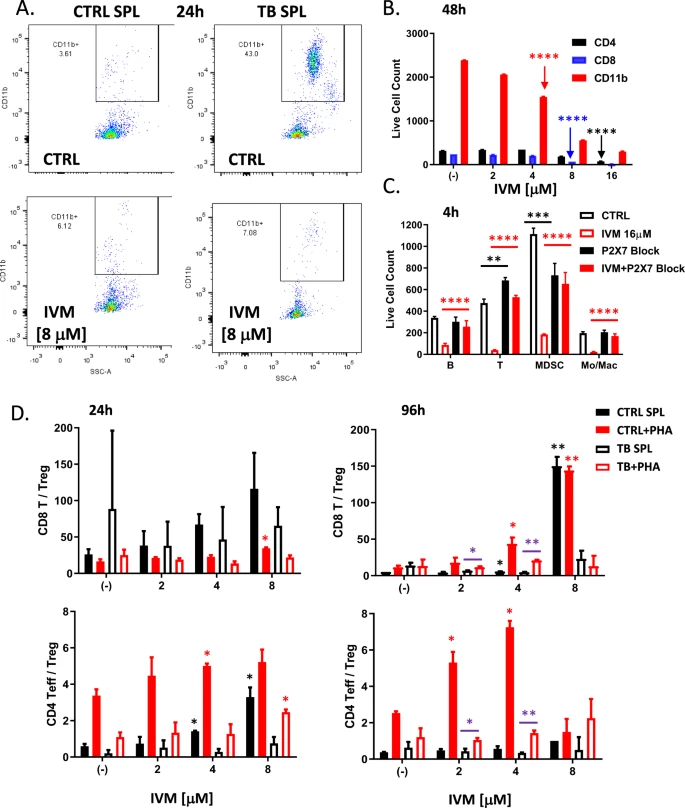
O tratamento com ivermectina in vivo não produziu quaisquer alterações significativas nas frequências de várias subpopulações de células T CD4 efetoras e reguladoras (Fig. S2A) ou CD8 (Fig. S2B) isoladas dos baços de animais tratados. No entanto, a interrogação funcional de esplenócitos isolados de camundongos de controle versus 4T1 portadores de tumor revelou efeitos imunomoduladores significativos. Camundongos portadores de tumor, 1 mês após a inoculação desenvolveram baços aumentados com uma população expandida de células mielóides CD11b + (Fig. 2A), que inclui células supressoras derivadas de mielóide CD11b + GR-1 + (MDSCs) e CD11b + GR-1 −Monócitos/Macrófagos (Mon/Mac). O tratamento com ivermectina ex vivo depletou preferencialmente esta população mielóide CD11b + expandida, normalizando o equilíbrio entre os compartimentos mielóide e de células T (Fig. 2A). As populações de células mielóides e linfóides mostraram sensibilidade diferencial a doses crescentes de ivermectina (Fig. 2B e S2C). Um modelo linear de efeitos mistos de log de contagem de células ajustado para o tipo de célula revelou que as células mielóides CD11b + foram as mais sensíveis à ivermectina, mostrando reduções significativas com apenas 4 μM após 48 h, 8 μM após 24 h ou 16 μM após 4 h — demonstrando direcionamento rápido e seletivo desta população imunossupressora (cada resultado, p < 0,0001). Em contraste, alcançar reduções semelhantes em células CD4 ou CD8 T exigiu doses mais altas e/ou exposição mais longa à ivermectina: observado em células T CD8 somente após 48 h de 8 μM ou 24 h de 16 μM, e em células T CD4 somente após a exposição máxima (48 h de 16 μM). Consistente com o fato de a ivermectina ser um modulador alostérico do eixo de sinalização ATP/P2X4/P2X7 que opera em células cancerígenas e imunes, a sensibilidade diferencial em células mieloides era dependente de P2X7 (Fig. 2C). O bloqueio P2X7 com 10 μM KN62 reverteu a depleção ex vivo de CD11b + GR-1 + MDSCs, CD11b + GR-1 − Mon/Mac e outros subconjuntos imunes por ivermectina (p < 0,001). Para imitar condições de exposição fisiologicamente mais relevantes, também tratamos esplenócitos com doses não citotóxicas mais baixas de ivermectina e observamos que, em exposição prolongada, a ivermectina teve um efeito potencializador significativo nas células T estimuladas por fitohemaglutinina (PHA) e aumentou as proporções de CD8 + e CD4 + Teff/Tregs (Fig. 2D). O PHA induz estimulação de células T inespecíficas pela ligação a proteínas de superfície glicosiladas, incluindo, mas não exclusivamente, o receptor de células T (TCR), causando reticulação de TCR e sinalização a jusante, resultando em ativação e proliferação de células T. Os efeitos imunopotenciadores da exposição prolongada a doses não citotóxicas mais baixas de ivermectina foram aumentados após a estimulação de TCR (via PHA) e foram inibidos em esplenócitos de camundongos portadores de tumor (Fig. 2D), onde diferentes mecanismos, incluindo MDSCs, bem como PD Sabe-se que a imunossupressão mediada por -1 interfere na sinalização e função adequadas do TCR.
Fig. 2: Efeitos imunomoduladores da ivermectina ex vivo.
Os esplenócitos (SPL) foram isolados dos baços de camundongos de controle não portadores de tumor (CTRL) ou camundongos portadores de tumor 4T1 não tratados (TB), 1 mês após a inoculação do tumor, então cultivados em cultura de tecidos de 96 poços -placas tratadas em meio R10 completo por 4h–48h e analisadas por citometria de fluxo para alterações espontâneas e induzidas por ivermectina em várias subpopulações imunes. A Depleção das células mielóides CD11b + expandidas isoladas dos baços de camundongos portadores de tumor por tratamento com ivermectina ex vivo. B, C Esplenócitos isolados de camundongos portadores de tumor 4T1 foram expostos a doses crescentes de ivermectina por 4 h ou 48 h, mostrando sensibilidade dependente da dose e do tempo diferencial de diferentes subpopulações imunes (ver também Fig. S2C). A depleção de CD11b + GR-1 + MDSCs, CD11b + GR-1 − Monócitos/Macrófagos, células CD19 + B e células CD3 + T por IVM pode ser revertida por um inibidor de P2X7/CaMKII (KN62 a 10 μM). D Esplenócitos de camundongos não tratados e ingênuos não portadores de tumor (CTRL) e camundongos portadores de tumor (TB) 4T1 foram incubados por 24 horas e 4 dias com doses crescentes de ivermectina (1-16 μM) com ou sem PHA para imitar a estimulação do TCR. Os gráficos mostram médias e desvio padrão com base em triplicatas; dados representativos de pelo menos dois experimentos independentes. A significância estatística versus (-) CTRL ou conforme indicado foi avaliada usando o modelo linear de efeitos mistos de contagem de células logarítmicas ajustadas para o tipo de célula: * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001, **** p ≤ 0,0001.