A ivermectina sinergiza com o anticorpo anti-PD1 para controlar o crescimento do tumor e induz a imunidade protetora
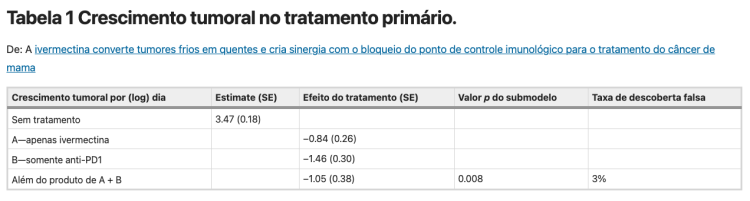
O ICD anti-câncer e os efeitos imunomoduladores diretos da ivermectina levantaram a possibilidade de que ele pudesse ser combinado com o bloqueio do checkpoint. Em seguida, investigamos a eficácia da ivermectina e do anticorpo anti-PD1, isoladamente ou em combinação, em relação a nenhum tratamento (esquema na Fig. S1A). O volume médio do tumor ao longo do tempo diminuiu significativamente pela combinação de ivermectina e anticorpo anti-PD1 em relação a nenhum tratamento (p <0,001, Fig. 3A). Por meio de um modelo estatístico conjunto de volumes tumorais longitudinais, a ivermectina e o anticorpo anti-PD1 demonstraram atividade sinérgica, definida como um efeito significativamente maior do que a soma dos efeitos individuais das drogas (submodelo p = 0,008, taxa de descoberta falsa/FDR 3%, Tabela 1). A regressão completa do tumor foi observada em 6/15 camundongos no tratamento combinado, 1/20 com ivermectina sozinha, 1/10 com anticorpo anti-PD1 sozinho e 0/25 sem tratamento. Camundongos que resolveram tumores na terapia de combinação de ivermectina e anti-PD1 foram re-desafiados com 100.000 células 4T1 nas almofadas de gordura mamária contralateral. Todos estes camundongos resistiram ao desenvolvimento de novos tumores (Fig. 3B), enquanto animais de controle naïve desenvolveram tumores (dados não mostrados). Isso sugere que o tratamento combinado com ivermectina e anti-PD1 induz imunidade antitumoral protetora em respondedores completos.
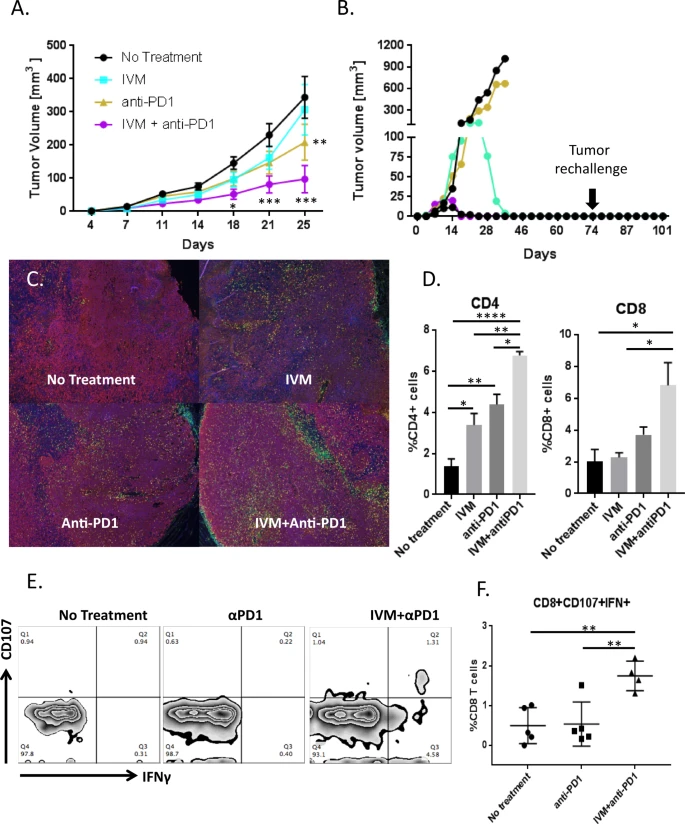
Fig. 3: A ivermectina sinergiza com a terapia anti-PD1 para controlar o crescimento do tumor in vivo.
Os camundongos foram inoculados com 100.000 células 4T1 4 dias antes de iniciar a terapia com ivermectina sozinha (n = 20), anticorpo anti-PD1 sozinho (n = 10), ambas as drogas (n = 15) ou nenhum tratamento (n = 25). A Volume tumoral em animais de controle e tratados; * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001. B Crescimento tumoral em animais individuais tratados com ivermectina mais anticorpo anti-PD1 (cinco camundongos individuais de um representante de três experimentos mostrados). Três dos cinco animais tratados com combinação resolveram completamente seus tumores. Os animais que resolveram os tumores foram novamente desafiados com 100.000 células 4T1 na almofada de gordura mamária contralateral 30 dias após o término da terapia. Os camundongos foram observados e palpados duas vezes por semana por mais 30 dias para o estabelecimento de uma massa tumoral. C – F A terapia combinada com ivermectina e anti-PD1 recruta significativamente mais células T para os locais do tumor e gera células T CD8 + reativas ao tumor. Os tumores foram isolados de camundongos no dia 21. A coloração foi realizada para núcleos (azul), CD4 + (verde), células CD8 + (amarelo) e células tumorais (vermelho) (C). A porcentagem positiva para CD4 ou CD8 foi medida em cinco campos aleatórios em cada grupo e dividida pelo número de núcleos no campo (D). Os dados são representativos de dois experimentos independentes; * p ≤ 0,05, ** p ≤ 0,01, **** p ≤ 0,0001. Esplenócitos isolados de camundongos portadores de tumor que não receberam tratamento (n = 5), anti-PD1 sozinho (n = 5) ou ivermectina com anti-PD1 (n = 4) foram cocultivados com células 4T1. CD8 + reativoas células foram determinadas pela mobilização de CD107 e expressão de IFNγ por citometria de fluxo. Gráficos de fluxo representativos para cada grupo de tratamento são mostrados em E. F Porcentagem de células T CD8 + reativas contra 4T1 por camundongo, agrupadas por tratamento; ** p ≤ 0,01.
Para obter mais informações sobre o mecanismo subjacente à eficácia do tratamento combinado, comparamos a magnitude em que a ivermectina, o anti-PD1 e sua combinação potencializaram a infiltração de células T. Conforme mostrado visualmente na Fig. 3C e quantitativamente na Fig. 3D, a infiltração de células T CD4 + e CD8 + em tumores 4T1 (dia 21) foi maior após o tratamento com a combinação de ivermectina e anti-PD1. Para medir as células T antitumorais, os esplenócitos foram isolados de camundongos não tratados, tratados com agente único ou tratados com combinação de ivermectina mais anti-PD1, depois co-cultivados com células 4T1 como alvos para medir a mobilização de CD107 e a expressão de IFN-γ como marcadores para respostas de células T funcionais. Uma resposta imune específica do tumor funcional foi confirmada pela presença de uma população discreta de células T CD8 + positivas para CD107 e IFN-γ em camundongos tratados com ivermectina mais anti-PD1, mas não em camundongos tratados com anti-PD1 sozinho ou não tratados controles (p < 0,01; Fig. 3E, F).
Terapia combinada eficaz em todo o espectro de configurações clinicamente relevantes
Indo além do controle dos tumores primários, procuramos testar essa combinação de imunoterapia nos principais cenários clinicamente relevantes: tratamentos neoadjuvantes, adjuvantes e metastáticos. Também exploramos os efeitos de aumentar ainda mais essa imunoterapia combinada com interleucina-2 (IL-2). A IL-2 foi a primeira citocina a ser utilizada com sucesso no tratamento do câncer para induzir a ativação de células T. Um grande desafio no desenvolvimento da IL-2 como agente terapêutico antitumoral é que a IL-2 pode atuar tanto nas células T quanto nas células T reguladoras (Tregs). As ações contrastantes da IL-2 levaram a respostas inconsistentes e limitaram o desenvolvimento de altas doses de IL-2 para imunoterapia contra o câncer. O aumento da meia-vida da IL-2 tem se mostrado uma estratégia promissora para melhorar a imunoterapia baseada em IL-2. Isso pode reduzir bastante a dose de IL-2 necessária para a atividade terapêutica, aumentando tanto a segurança quanto a eficácia. Exploramos a hipótese secundária de que a adição de uma fusão recombinante de albumina-IL-2 com meia-vida estendida ao regime de ivermectina e anti-PD1 (terapia anti-PD-1 + IL-2, denominada “IP” para simplificar) pode promover melhorar a eficácia do nosso tratamento combinado.
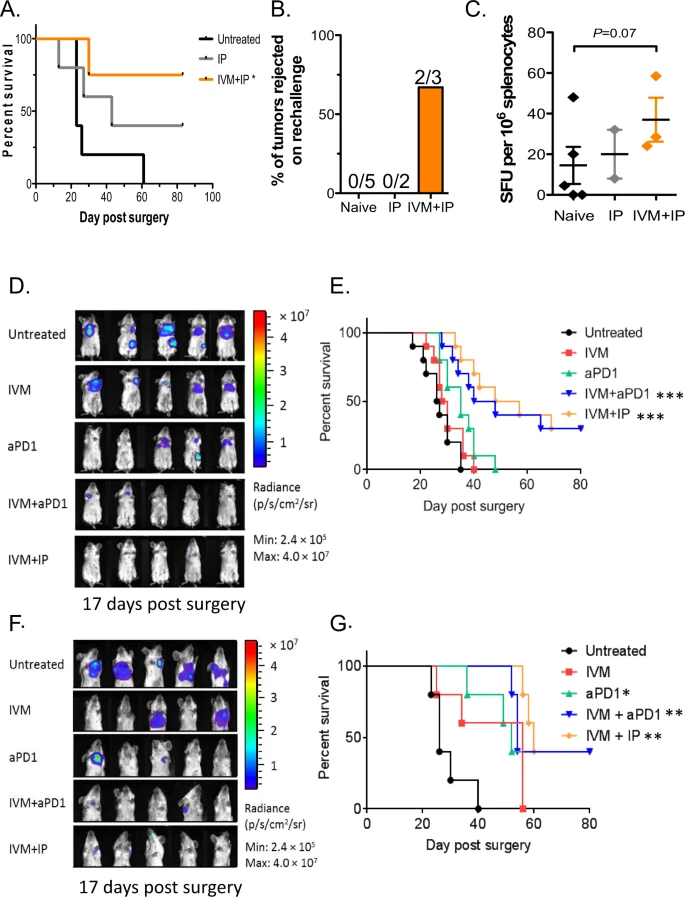
A terapia neoadjuvante tem vindo a desempenhar um papel cada vez mais importante no tratamento do cancro. Testamos o tratamento de ivermectina combinado com anti-PD-1 e IL-2 monitorando a sobrevivência de animais recebendo terapia de combinação neoadjuvante seguida por ressecção cirúrgica do tumor primário no dia 16 após a inoculação do tumor (esquema na Fig. S1A). O desenvolvimento de recorrência loco-regional e metástases distantes foram monitorados por imagem bioluminescente, e os animais foram eutanasiados após declínio no escore de condição corporal e sinais de morbidade. Todos os animais não tratados necessitaram de eutanásia devido a doenças letais por volta do dia 20-25 após a ressecção cirúrgica do tumor primário (Fig. 4A). O tratamento apenas com terapia IP proporcionou algum benefício de sobrevivência com cerca de 40% dos animais permanecendo livres de doença letal. O melhor resultado de sobrevida foi observado com a combinação de IP e terapia com ivermectina, com cerca de 75% dos animais se tornando sobreviventes de longo prazo após a ressecção cirúrgica (p < 0,05, Fig. 4A). Os camundongos tratados sobreviventes foram desafiados novamente com 100.000 células 4T1 nas almofadas de gordura mamária contralateral. A maioria dos camundongos tratados com IVM + IP não desenvolveu novos tumores, o que é indicativo do desenvolvimento de imunidade específica do tumor de longa duração (Fig. 4B), enquanto os tumores tratados com IP e virgens de controle desenvolveram bem. Os esplenócitos destes animais foram reativos (através de ELISPOT) contra células 4T1, demonstrando evidências de respostas de células T antitumorais nos animais tratados com IVM + IP (Fig. 4C). Esses resultados sugerem que o tratamento de combinação IVM + IP é eficaz no cenário neoadjuvante e induz imunidade antitumoral protetora potencialmente mais forte em respondedores.
Fig. 4: Combinação de ivermectina e terapia IP nas configurações neoadjuvante, adjuvante e metastática.
A Sobrevivência de animais após ressecção cirúrgica do tumor primário (no dia 16 após a inoculação do tumor). B Indução de imunidade protetora em camundongos tratados que sobreviveram além do dia 80, então re-desafiados com células 4T1 na almofada de gordura mamária contralateral. C Análise IFNγ ELISPOT de esplenócitos reativos a 4T1 em animais tratados. Média ± sd, n = 5 camundongos, dados agrupados de dois experimentos independentes; * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001. D Imagens de bioluminescência in vivo de camundongos (no dia 17 após a cirurgia e após a conclusão de todo o esquema de tratamento) tratados com ivermectina, anti-PD1, ivermectina + anti-PD1 ± IL-2 (IP) ou controle no cenário adjuvante. Média ± sd, n = 5 camundongos, dados agrupados de dois experimentos independentes. E Sobrevivência de animais no cenário adjuvante após ressecção cirúrgica da carga tumoral primária e tratados 2 dias depois com ivermectina, anti-PD1, ivermectina + anti-PD1 ± IL-2 (IP) ou controle; n = 5 camundongos por grupo, teste de log-rank bicaudal; ** p ≤ 0,01, **** p ≤ 0,0001. F Imagens de bioluminescência in vivo (no dia 17 após a cirurgia e após a conclusão de todo o esquema de tratamento) de camundongos com metástase documentada, então tratados com ivermectina, anti-PD1, ivermectina + anti-PD1 ± IL-2 (IP) ou controle. Média ± sd, n = 5 camundongos, dados agrupados de dois experimentos independentes. G Análise de sobrevivência de Kaplan–Meier de camundongos no cenário metastático tratados com ivermectina, anti-PD1, ivermectina + anti-PD1 ± IL-2 (IP) ou controle; n = 5 camundongos por grupo, teste de log-rank bicaudal; * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
A cirurgia continua sendo o tratamento primário para o câncer de mama; no entanto, a recidiva é comum, necessitando de terapia adjuvante em pacientes de alto risco após a cirurgia. Avaliamos a eficácia da ivermectina, anti-PD1 e IL-2 recombinante isoladamente ou em combinação como imunoterapia adjuvante após a cirurgia. Células 4T1 expressando luciferase (0,5 × 106, 4T1-Luc) foram injetadas na almofada mamária de camundongos BALB/c fêmeas e deixadas crescer em tumores palpáveis por 10 dias, após os quais os tumores foram ressecados cirurgicamente. O tratamento foi iniciado no dia 2 após a cirurgia para simular a terapia adjuvante (esquema na Fig. S1A). O desenvolvimento de recorrência e metástase foi monitorado em vários pontos de tempo por meio de imagens de bioluminescência (dia 17 mostrado, Fig. 4D), então os animais foram monitorados até atingirem os critérios de eutanásia com base no declínio no escore de condição corporal e sinais de morbidade. O tratamento com anti-PD1 ou IVM sozinho levou a uma sobrevivência semelhante aos controles não tratados (Fig. 4E). Os animais tratados com a combinação de ivermectina e anti-PD1 (com ou sem IL-2) tiveram uma sobrevida significativamente prolongada, com cerca de 40% dos animais se tornando sobreviventes de longo prazo (p < 0,001, Fig. 4E). Por meio de modelagem estatística, a combinação de ivermectina e anti-PD1 mostrou ser altamente sinérgica em comparação com IVM ou anti-PD-1 sozinho (submodelo p = 0,007, FDR 2%, Tabela 2). Curiosamente, a adição de IL-2 não aumentou ainda mais o benefício de sobrevida da combinação de ivermectina e anti-PD1 (submodelo p = 0,51, FDR 67%, Tabela 2). Esses dados demonstram que o tratamento com ivermectina e anti-PD1 (com ou sem IL-2) é eficaz no cenário adjuvante, sem evidência de toxicidade relacionada à droga ou sinérgica com base em observações paralelas de peso corporal (Fig. S1B).
A metástase é a principal causa de morte em pacientes com câncer, incluindo câncer de mama. Para testar a eficácia desta combinação no cenário metastático, atrasamos o tratamento até que pelo menos 25% dos animais pós-cirurgia tivessem metástase detectável (geralmente dia 7 após a ressecção cirúrgica do tumor primário). A progressão da metástase foi monitorada através de imagens de bioluminescência (esquema na Fig. S1A), e os animais foram monitorados até atingirem os critérios de eutanásia com base no declínio no escore de condição corporal e sinais de morbidez (exemplos mostrados na Fig. 4F). Todos os animais não tratados necessitaram de eutanásia devido à doença metastática por volta do dia 20-40 após a ressecção cirúrgica do tumor primário (Fig. 4G). O tratamento apenas com IVM levou a um prolongamento modesto e não significativo da sobrevivência em comparação com os controles não tratados (Fig. 4G). A sobrevida foi ligeiramente prolongada em animais tratados apenas com anti-PD1 (p < 0,05), mas todos os animais precisaram de eutanásia no dia 60 como no grupo IVM sozinho. A sobrevida foi significativamente prolongada em animais tratados com ivermectina e anti-PD1 (p <0,001), ou ivermectina, anti-PD1 e IL-2 (p <0,01) em comparação com controles não tratados (Fig. 4G). Aproximadamente 40% dos animais na terapia de combinação tornam-se sobreviventes a longo prazo. O efeito combinado de IVM e anti-PD-1 na sobrevivência no cenário metastático foi novamente considerado altamente sinérgico em comparação com IVM ou anti-PD-1 sozinho (submodelo p <0,001, FDR <1%, Tabela 3). Como no cenário adjuvante, a adição de IL-2 não aumentou ainda mais o benefício de sobrevida da combinação de ivermectina e anti-PD1 (submodelo p = 0,64, FDR 73%, Tabela 3). Esses dados demonstram que o tratamento com ivermectina e anti-PD1 (com ou sem IL-2) também é eficaz no cenário metastático.