A proteína Spike ativa fibroblastos, o que pode explicar praticamente todas as sequelas da exposição à COVID/proteína Spike.
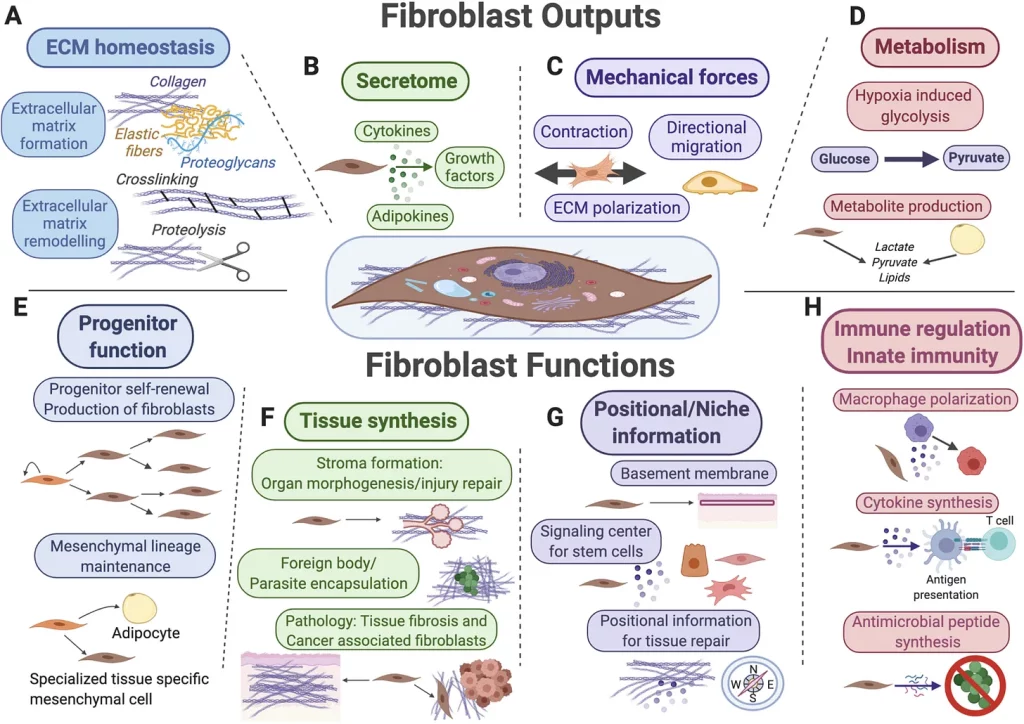
As principais funções dos fibroblastos (mostrados no centro) e suas linhagens mesenquimais incluem secreção e remodelação da matriz extracelular (ECM) (A), secreção de fatores de sinalização para células circundantes (B), geração de força mecânica (C) e regulação do metabolismo do tecido e secreção de metabólitos (D). Os fibroblastos também funcionam como células progenitoras para linhagens mesenquimais (E), como “fabricantes” de novos tecidos durante a morfogênese do órgão, reparo do tecido e em várias condições patológicas (F), como fontes de informações posicionais em distintas regiões anatômicas do mesmo órgão e como principais contribuintes de sinais para nichos de células-tronco (G), bem como células-alvo e moduladores recíprocos de diversas funções imunológicas inatas e adaptativas (H).
Peço desculpas por usar BREAKTHROUGH pela segunda semana consecutiva, no entanto, acredito que o insight discutido hoje explica tanto, que precisamos, mais uma vez, reavaliar essa doença “respiratória”.
Como os leitores deste Substack sabem, na semana passada eu propus que a Doença Endotelial da Proteína Spike (SPED) era um estágio inicial de uma doença que, em última análise, envolve a Matriz Extracelular. Tenho investigado isso na semana passada e encontrei evidências abundantes de que esse é quase certamente o caso. Na verdade, parece que o principal ator nessa doença da ECM são os fibroblastos, que a Proteína Spike ativa.
Métodos: Utilizamos ensaios de scratch, Western blotting e imunofluorescência para avaliar a migração, sinalização de fibrose, níveis de cálcio mitocondrial, produção de espécies reativas de oxigênio (ROS) e morfologia celular de fibroblastos cardíacos humanos cultivados (FCs) tratados com proteína spike (S1) por 24 h com ou sem um anticorpo neutralizante anti-ACE2, um bloqueador de TLR4 ou um inibidor de NLRP3.
Resultados: A proteína S1 aumentou a migração de CFs e as expressões de colágeno 1, α-actina de músculo liso, fator de crescimento transformador β1 (TGF-β1), SMAD2/3 fosforilado, interleucina 1β (IL-1β) e fator nuclear kappa-light-chain-enhancer de células B ativadas (NF-κB). A proteína S1 aumentou a produção de ROS, mas não afetou o conteúdo de cálcio mitocondrial e a morfologia celular. O tratamento com um anticorpo neutralizante anti-ACE2 atenuou os efeitos da proteína S1 nas expressões de colágeno 1 e TGF-β1. Além disso, os inibidores de NLRP3 (MCC950) e NF-kB, mas não o inibidor de TLR4 TAK-242, impediram a migração de CFs aumentada pela proteína S1 e a superexpressão de colágeno 1, TGF-β1 e IL-1β.
Conclusão: A proteína S1 ativa os FCs humanos ao preparar os inflamossomos NLRP3 por meio da sinalização NF-κB de maneira dependente de ACE2.
Proteína Spike do SARS-CoV-2 ativa a fibrogênese cardíaca por meio de inflamossomos NLRP3 e sinalização NF-κB
https://pubmed.ncbi.nlm.nih.gov/39195221/
Se examinarmos as sequelas do SARS-CoV-2, podemos observar como os fibroblastos ativados podem ser a força motriz por trás delas.
FIBROSE PULMONAR
Muitas formas de fibrose pulmonar envolvem a obliteração progressiva e inexorável do tecido parenquimatoso, o que acaba prejudicando a troca gasosa, causando insuficiência respiratória e morte. Embora nenhum modelo animal recapitule com precisão todos os aspectos da fibrose pulmonar humana, a lesão pulmonar induzida por bleomicina pode aumentar transitoriamente a abundância de miofibroblastos αSMA+ e ECM em regiões alveolares (Rock et al., 2011). O rastreamento de linhagem neste modelo de camundongo implicou inúmeras células mesenquimais como a fonte de miofibroblastos fibróticos, incluindo fibroblastos PDGFRα+, lipofibroblastos, pericitos e células mesoteliais WT1+ (El Agha et al., 2017; Hung et al., 2013). Essa contribuição cooperativa de vários tipos de células mesenquimais residentes em tecidos para a fibrose é paralela a observações análogas em outros órgãos, incluindo respostas da pele a ferimentos.
FIBROSE CARDÍACA/MORTE CARDÍACA SÚBITA (ARRITMIAS)
O músculo cardíaco é um órgão contrátil anatomicamente e fisiologicamente complexo, cuja população celular principal, cardiomiócitos, conectam-se uns aos outros para formar um tecido eletricamente acoplado por meio de discos intercalados que constituem sua camada intermediária chamada miocárdio. O coração também é rico em fibroblastos que geram e remodelam uma rede ECM robusta, essencial para a condutividade elétrica e o ritmo dos batimentos cardíacos.
Fibroblastos: origens, definições e funções na saúde e na doença
https://pmc.ncbi.nlm.nih.gov/articles/PMC8566693/#S12
DESMIELINIZAÇÃO/EM/SEQUELAS NEUROLÓGICAS
A esclerose múltipla é uma doença autoimune. Foi relatado que tanto as células semelhantes a fibroblastos meníngeos PDGFRα+PDGFRβ+ quanto os pericitos PDGFRα−PDGFRβ+ aumentam e formam uma rede nas meninges de camundongos no modelo experimental de encefalite autoimune de esclerose múltipla.78 Após estímulos inflamatórios, como células TH17 (T-helper 17) e IL-17/IL-22, essas células secretam proteínas e citocinas da MEC, levando a uma resposta imune aprimorada e desmielinização.78 Essas descobertas sugerem que as células semelhantes a fibroblastos meníngeos podem desempenhar um papel prejudicial na encefalite autoimune experimental. Usando camundongos transgênicos Col1α1-GFP, foi demonstrado que células semelhantes a fibroblastos perivasculares na medula espinhal são ativadas e infiltram-se no tecido neural na encefalite autoimune experimental.79 Curiosamente, essa mudança está associada a déficits comportamentais animais, desmielinização, acúmulo de células mieloides e deposição de ECM,79 indicando um papel prejudicial das células semelhantes a fibroblastos perivasculares na encefalite autoimune experimental. Além disso, descobriu-se que meios condicionados por fibroblastos e ECM derivada de fibroblastos inibem a diferenciação de células progenitoras de oligodendrócitos in vitro.79 Dado que a deposição anormal de ECM é observada na esclerose múltipla em camundongos80 e humanos,81,82 acredita-se que células semelhantes a fibroblastos afetam a patologia e os resultados da esclerose múltipla, pelo menos parcialmente, por meio de suas proteínas de ECM. Essa hipótese e os mecanismos moleculares subjacentes, no entanto, precisam de mais investigação.
Células semelhantes a fibroblastos do sistema nervoso central em acidente vascular cerebral e outros distúrbios neurológicos
https://www.ahajournals.org/doi/full/10.1161/STROKEAHA.120.033431
EMERGÊNCIA DO TURBOCÂNCER
Os fibroblastos no estroma tumoral são bem reconhecidos como tendo um papel indispensável na carcinogênese, incluindo no início da formação de tumores epiteliais. A associação entre células cancerígenas e fibroblastos foi destacada em vários estudos anteriores. Fatores de regulação liberados de fibroblastos associados ao câncer (CAFs) no microambiente tumoral têm papéis essenciais, incluindo o suporte do crescimento tumoral, angiogênese, metástase e resistência à terapia. Uma interação mútua entre ativação de fibroblastos induzida por tumor e proliferação tumoral induzida por fibroblastos e metástase ocorre, portanto, os CAFs atuam como suportes tumorais. Estudos anteriores relataram que, ao desenvolver medicamentos direcionados a fibroblastos, pode ser possível interromper a interação entre fibroblastos e o tumor, resultando na supressão do crescimento tumoral e metástase. A presente revisão focou no ciclo de feedback recíproco entre fibroblastos e células cancerígenas e avaliou a aplicação potencial de agentes anti-CAF no tratamento do câncer.
Fibroblastos associados ao câncer: um papel essencial no microambiente tumoral
https://pmc.ncbi.nlm.nih.gov/articles/PMC5588104/
DOENÇA INFLAMATÓRIA INTESTINAL
Os fibroblastos intestinais são jogadores essenciais na manutenção da homeostase do tecido e na orquestração de respostas a lesões e inflamações no trato gastrointestinal (GI). Os fibroblastos contribuem significativamente para a patogênese da doença inflamatória intestinal (DII), incluindo a doença de Crohn e a colite ulcerativa (CU), secretando citocinas pró-inflamatórias, modulando a atividade das células imunes e promovendo a fibrose. Além disso, os fibroblastos desempenham papéis cruciais no reparo e regeneração do tecido após lesão aguda ou inflamação crônica. A desregulação das funções dos fibroblastos pode levar a complicações fibróticas, como estenoses e obstruções intestinais, que são comuns em estágios avançados da DII.
Heterogeneidade de fibroblastos na doença inflamatória intestinal
https://pubmed.ncbi.nlm.nih.gov/39684719/
FIBROSE DO FÍGADO/RIM
Fibroblastos ativados estão presentes na resposta a lesões, tumorigênese, fibrose e inflamação em uma variedade de tecidos e uma miríade de tipos de doenças. Resumo: Durante o reparo normal do tecido, fibroblastos quiescentes se transformam em um fenótipo proliferativo e contrátil denominado miofibroblastos e são então perdidos conforme o reparo se resolve para formar uma cicatriz. Quando níveis excessivos são atingidos, fibroblastos ativados proliferam e produzem grandes quantidades de matriz extracelular, que se acumula no espaço intersticial de diferentes órgãos. Esse acúmulo leva à disfunção fibrótica e à síndrome de disfunção de múltiplos órgãos.
Regulação metabólica da ativação e proliferação de fibroblastos durante fibroses de órgãos
https://karger.com/kdd/article/8/2/115/824530/Metabolic-Regulation-of-Fibroblast-Activation-and
Estarei pesquisando terapêuticas para melhorar a ativação de fibroblastos, além de neutralizar a Proteína Spike. Minha esperança é que agora possamos conter os efeitos adversos da Proteína Spike. Isso pode garantir que previnamos a indução de cânceres, doenças neurológicas e fibrose de órgãos.
Fonte: https://wmcresearch.substack.com/p/breakthrough-does-sars-cov-2-infectionspike