Da infecção à terapia genética, a proteína Spike enche órgãos com agregados não funcionais.
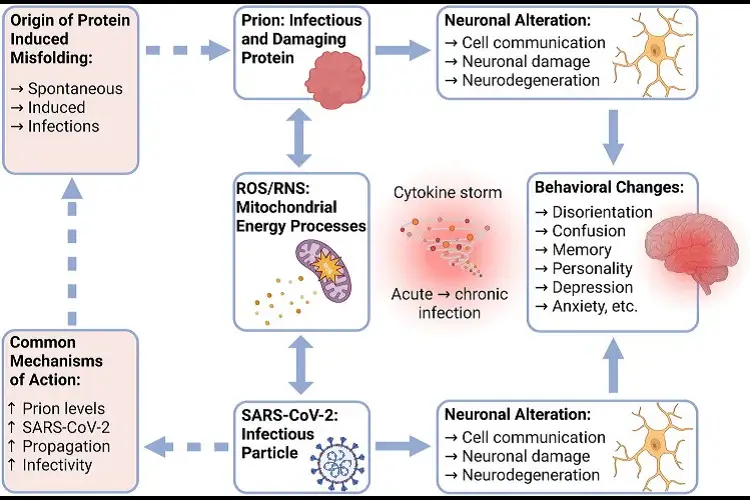
Ilustração mecanicista hipotética do direcionamento mitocondrial do príon e do SARS-CoV-2. Os príons são partículas proteicas infecciosas que têm sido funcionalmente associadas à progressão de grandes distúrbios neurodegenerativos humanos, como a doença de Creutzfeldt-Jakob. Os modos de ação empiricamente elucidados dos príons infecciosos incluem múltiplos padrões inibitórios que afetam adversamente a comunicação neural normativa, bem como o início de danos neurais apoptóticos ou necróticos. Além disso, um provável mecanismo de disfunção neural relacionada ao príon também pode envolver a restituição aberrante da conformação nativa de proteínas celulares anormalmente dobradas. Esses efeitos fisiopatológicos podem ser potencialmente devidos à perda do funcionamento normativo do proteassoma devido ao aumento de espécies reativas de oxigênio associadas ao comprometimento do metabolismo energético das mitocôndrias. As doenças infecciosas por príons também podem induzir anormalidades de memória, personalidade e movimento, bem como depressão, confusão e desorientação. Curiosamente, algumas dessas mesmas sequelas comportamentais também foram observadas ocorrendo subsequentemente à COVID-19 e também podem compartilhar danos mitocondriais patogênicos causados pela infecção por SARS-CoV-2 com produção subsequente de ROS ou RNS. Tomados em conjunto, especulamos que os efeitos fisiopatológicos da COVID longa podem envolver a indução da produção espontânea de espécies de príons infecciosos. Curiosamente, as mitocôndrias podem representar o foco central de ambos os distúrbios induzidos
Um relato de caso foi publicado em 2 de julho deste ano, o que confirmou uma hipótese minha de longa data: o SARS-CoV-2 e sua proteína Spike induzem doença priônica. O caso envolve um senhor idoso que apresentou um início tardio da doença de Creutzfeldt-Jakob (CJD) mais de um ano após a infecção por COVID. A linha do tempo é muito perturbadora.
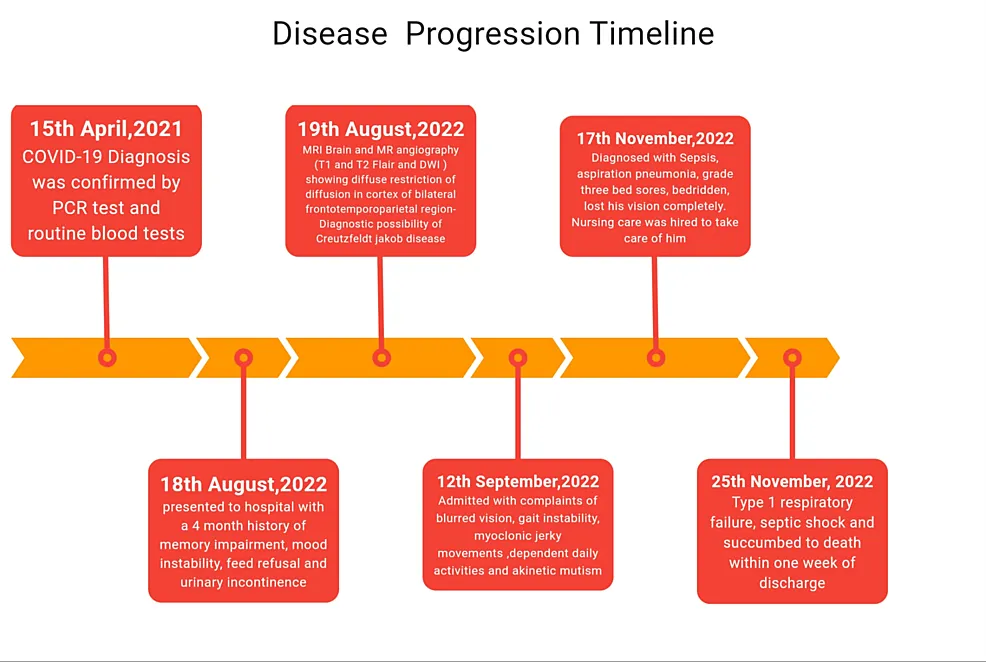
Início anormalmente tardio da doença de Creutzfeldt-Jakob após infecção por COVID-19 na Índia: um relato de caso https://www.cureus.com/articles/263323-unusually-late-onset-of-creutzfeldt-jakob-disease-following-covid-19-infection-in-india-a-case-report#!/
No entanto, depois de muita pesquisa e contemplação adicionais, finalmente me ocorreu. Não estamos lidando apenas com CJD – a doença príon “tradicional”. Não. Proponho que estamos lidando com uma nova forma de doença príon que não se limita ao curso neurodegenerativo tradicional. Para entender o conceito, imagine um jogo celular de pega-pega. As proteínas que você toca se tornam “isso”. As proteínas idênticas que elas tocam se tornam “isso”. E elas podem se autorreplicar. Como? O RBD da Proteína Spike é o catalisador para esse fenômeno. Ele contém um domínio príon. Além disso, como o gráfico inicial explica, as propriedades inflamatórias da Proteína Spike também podem induzir dobramento incorreto e doença príon.
Um estudo abrangente usando bioinformática identificou um grande número de proteínas virais de diversas espécies que têm assinaturas semelhantes a príons em sua sequência genética. Em particular, eles identificaram domínios semelhantes a príons em proteínas de superfície virais envolvidas na ligação do receptor e fusão com a célula hospedeira [19]. Esses mesmos autores publicaram posteriormente um artigo analisando o potencial semelhante a príons da proteína spike. Eles encontraram um domínio semelhante a príons no RBD da proteína spike do SARS-COV-2, que estava ausente do vírus SARS-CoV original. As regiões ricas em asparagina (N) e glutamina (Q) são características de muitas proteínas príons.
E, mais importante:
Um estudo que avaliou o potencial amiloidogênico da proteína spike usou métodos teóricos e experimentais para verificar se a proteína spike do SARS-CoV-2 pode causar o aparecimento de fibrilas semelhantes a amiloides após a proteína ter sido submetida à proteólise. Previsões teóricas identificaram sete sequências potencialmente amiloidogênicas dentro da proteína spike. Em experimentos de laboratório onde a proteína foi incubada com a protease elastase de neutrófilos, fibrilas semelhantes a amiloides apareceram durante 24 horas de coincubação. Um segmento específico, spike 194-213 (FKNIDGYFKI), foi altamente abundante após seis horas, e se sobrepôs quase completamente com a sequência mais amiloidogênica identificada teoricamente. Os neutrófilos que respondem à ativação imunológica liberam elastase de neutrófilos no meio, onde teriam acesso à proteína spike e seriam capazes de quebrá-la nos segmentos amiloidogênicos [29]. A proteína spike do SARS-CoV-2 tem uma inserção polibásica única de quatro aminoácidos, RRAR, na junção dos segmentos S1 e S2, que não está presente no SARS-CoV. Esta sequência tem vários locais de clivagem suscetíveis a proteases, como a elastase de neutrófilos [30]. Elastases de neutrófilos secretadas por neutrófilos atraídos para os locais de inflamação causados pela proteína spike do SARS-CoV-2 podem presumivelmente clivar a proteína spike encontrada e liberar o segmento S1 na circulação, potencializando uma resposta amilogênica.
Os autores foram ousados o suficiente para declarar o que quase certamente já sabíamos sobre as vacinas. Por que isso não foi manchete?
Examinamos a extensa literatura sobre as propriedades semelhantes a príons da glicoproteína spike do SARS-CoV-2. Além disso, identificamos vias pelas quais as vacinas de mRNA podem ser capazes de entregar a proteína spike ao cérebro, o que sugerimos que acontece por meio de exossomos liberados de centros germinativos no baço viajando pelo nervo vago, aumentando o risco de doença neurodegenerativa.
Um papel potencial da proteína Spike em doenças neurodegenerativas: uma revisão narrativa https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9922164/
Acredita-se também que os príons sejam um fator na COVID Longa. Novamente, os autores deste estudo estão se concentrando no aspecto neurodegenerativo tradicional da doença priônica.
Nesse sentido, levantamos a hipótese de que doenças que foram atribuídas à síndrome conhecida como COVID-19 de longa duração podem, na verdade, originar-se, em parte, da produção espontânea de príons. Observamos que, embora distúrbios de príons totalmente desenvolvidos sejam universalmente fatais, proteínas mal dobradas que se acumulam em resposta à infecção por SARS-CoV-2 podem provavelmente ser eliminadas após um breve atraso. Em contraste, na ausência de outro desafio imunológico, os mecanismos de eliminação são severamente sobrecarregados no cenário de doença de príons totalmente desenvolvida. Simplificando, a infecção por vírus altera o processo pelo qual os príons se reproduzem. Embora o SARS-CoV-2 ainda não tenha sido amplamente localizado no SNC, seus danos foram associados à infecção (Douaud et al. 2022; Stein et al. 2022). Esse fenômeno justifica atenção adicional, dadas as semelhanças clínicas exibidas pela COVID-19 de longa duração e doenças de príons.
Potencial envolvimento de príons na neuropatologia da COVID-19 longa, incluindo comportamento https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10047479/
É aqui que proponho que precisamos olhar muito além da doença neurodegenerativa tradicional do príon. Precisamos olhar para ela sob uma nova luz. Que esse processo pode se aplicar a TODOS os órgãos. Agora, fornecerei alguns exemplos de pesquisas atuais.
SEQUELAS DE DOENÇAS CARDÍACAS
Relatos de caso descreveram cardiomiopatia associada a príons e estudos de controle de caso apoiam a premissa de que a doença cardíaca é tanto uma causa quanto uma consequência da doença de príons. Essas observações clínicas são apoiadas por nossas observações preliminares em modelos de camundongos de doença de príons.
Projeto 1. Devemos nos preocupar com doenças cardíacas associadas a príons? https://biomedicalsciences.unimelb.edu.au/sbs-research-groups/microbiology-and-immunology-research-groups/lawson-lab-neurodegenerative-caused-by-prions/project-1.-should-we-worry-about-prion-associated-heart-disease
SEQUELAS DE DIABETES
O diabetes tipo 2 (DT2) é uma doença metabólica altamente prevalente caracterizada por resistência crônica à insulina e disfunção e perda de células β, levando à liberação prejudicada de insulina e hiperglicemia. Embora o mecanismo responsável pela disfunção e morte das células β não seja completamente compreendido, descobertas recentes sugerem que o acúmulo de agregados mal dobrados do polipeptídeo amiloide das ilhotas (IAPP) nas ilhotas de Langerhans pode desempenhar um papel importante nos danos pancreáticos. O mal dobramento e agregação de diversas proteínas e seu acúmulo como amiloide em diferentes órgãos é a característica marcante em um grupo de doenças crônicas e degenerativas denominadas distúrbios de mal dobramento de proteínas (PMDs). Os PMDs incluem doenças humanas altamente prevalentes, como Alzheimer e Parkinson, bem como mais de 25 distúrbios mais raros. Entre elas, as doenças priônicas são únicas porque a patologia pode ser transmitida por um agente infeccioso proteico, denominado príon, que induz a doença ao propagar o mal dobramento e agregação de proteínas. Este fenômeno tem uma semelhança impressionante com o processo de dobramento incorreto e agregação de proteínas em todos os PMDs, sugerindo que agregados mal dobrados têm um potencial intrínseco de serem transmissíveis. De fato, estudos recentes mostraram que as características patológicas de vários PMDs podem ser induzidas in vivo sob condições experimentais pela inoculação de extratos de tecido contendo agregados de proteínas em modelos animais. Nesta revisão, descrevemos nossa compreensão atual do mecanismo molecular subjacente à transmissão semelhante a príons de agregados de proteínas e seu possível papel no T2D
Agregados de proteínas semelhantes a príons e diabetes tipo 2 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5411686/
OS COÁGULOS
Curiosamente, descobriu-se que a PrP acelera a formação de coágulos ricos em fibrina, que são resistentes à fibrinólise mediada por plasmina, o que é consistente com a estabilidade aumentada do trombo provocada pela PrP.
Fibrinogênio atenua ativação plaquetária mediada por príons e toxicidade de células neuronais https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8977893/
Acredito que agora você entende completamente minhas preocupações. Estamos quase certamente olhando para uma forma inteiramente nova de doença de príons. Uma que não se limita à doença neurodegenerativa tradicional. Esta nova versão ataca múltiplas proteínas, múltiplos órgãos.
Precisamos de biópsias e autópsias para determinar até que ponto, se houver, isso está ocorrendo. Meu medo é que haja uma onda silenciosa de doença de príons se formando que pegará (alguns de) nós de surpresa.
Fonte: https://wmcresearch.substack.com/p/the-spike-protein-and-systemic-prion