Nanopartículas magnéticas como uma ferramenta para manipulações remotas de DNA em um nível de molécula única
Aleksey A. Nikitin*, Anton Yu Yurenya, Timofei S. Zatsepin, Ilya O. Aparin, Vladimir P. Chekhonin, Alexander G. Majouga, Michael Farle, Ulf Wiedwald, e Maxim A. Abakumov*
Cite isto: ACS Appl. Mater. Interfaces 2021 , 13 , 12 , 14458–14469
Data de Publicação : 19 de março de 2021
https://doi.org/10.1021/acsami.0c21002
Copyright © 2021 American Chemical Society
DIREITOS E PERMISSÕES
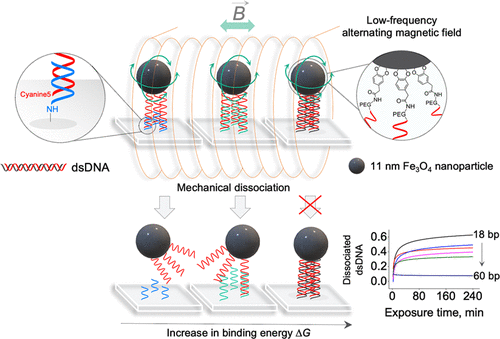
O controle remoto de células e moléculas únicas por nanopartículas magnéticas em campos magnéticos externos que não aquecem é uma abordagem em perspectiva para muitas aplicações, como tratamento de câncer e regulação da atividade enzimática. No entanto, a possibilidade e os mecanismos de efeitos diretos de pequenas nanopartículas magnéticas individuais em tais processos em experimentos magneto-mecânicos ainda permanecem obscuros. Neste trabalho, mostramos a dissociação mecânica controlada remotamente de duplexes curtos de DNA (18–60 bp) sob a influência de campos magnéticos alternados de baixa frequência sem aquecimento usando nanopartículas magnéticas individuais de 11 nm. A técnica desenvolvida permite (1) manipulação simultânea de milhões de moléculas individuais de DNA e (2) avaliação das energias das interações intermoleculares em duplexes curtos de DNA ou em outras moléculas. Finalmente, mostramos que a dissociação dos duplexes de DNA é mediada por estresse mecânico e produzida pelo movimento de nanopartículas magnéticas em campos magnéticos, mas não por superaquecimento local. A técnica apresentada abre um novo caminho para a manipulação de alta precisão de DNA e geração de biossensores para quantificação de energias de interação intermolecular.
As informações de suporte estão disponíveis gratuitamente em https://pubs.acs.org/doi/10.1021/acsami.0c21002 .
Representação esquemática da ligação de microarray ativado por epóxi com alvos SSO (Figura S1); (I) Fabricação de MNP-oligo; componentes principais de vários tampões de sal usados no trabalho (Tabela S1); curvas hidrodinâmicas de MNPs e seus conjugados (Figura S2); principais parâmetros hidrodinâmicos e potencial ζ de MNPs e seus conjugados (Tabela S2); curvas hidrodinâmicas de MNPs @ DOPAC @PEG em vários tampões de sal (Figura S3); principais parâmetros hidrodinâmicos e potencial ζ de MNPs @ DOPAC@PEG (Tabela S3); principais parâmetros hidrodinâmicos e potencial ζ de MNP-oligo-12 (Tabela S4); Ensaio de estabilidade MNP-oligo-12 com base na medição do tamanho hidrodinâmico por 180 min por DLS em vários tampões de sal (Figura S4); (II) Quantificar o número de moléculas de sonda SSO fixadas em um único MNP; dependência da intensidade de fluorescência do corante de ssDNA QuantiFluor na concentração da sonda SSO (Figura S5); dependência dos MNPs @ DOPACAbsorvância da solução @PEG em sua concentração (Figura S6); ensaio de estabilidade de MNP-oligo (Figura S7); (III) Caracterização física de MNPs e seus conjugados; caracterização de MNPs e seus conjugados (Figura S8); parâmetros espectrais de Mössbauer calculados (Tabela S5); (IV) Imobilização de SSO-alvos na superfície do vidro e hibridização para SSO-sondas complementares; imagens representativas dos microarrays formados usando MNP-oligo-2 antes e depois do tratamento pelo LF-AMF ( f = 180 Hz, B = 100 mT) (Figura S9); influência do LF-AMF ( f = 180 Hz, B = 100 mT) na clivagem de duplexes de DNA em tempo para MNP-oligo-12 (Figura S10); imagens representativas do microarray antes e após o procedimento de hibridização usando MNPs @ sCy5solução contendo 0,25 μM sCy5 (Figura S11); imagens representativas do microarray após três varreduras consecutivas (A) e histograma correspondente da intensidade de fluorescência sCy5 após cada varredura (B) (Figura S12); imagens fluorescentes representativas de microarrays de 60 nt após hibridização com SSO-sonda pura ou MNP-oligo e após coloração com SYBR Green I. A concentração de SSO-sonda puro e MNP-oligo durante a hibridização foi normalizada para o conteúdo SSO-sonda. Histograma da intensidade de fluorescência normalizada de 532/635 nm (Figura S13); (V) Fundamentação teórica do efeito magneto-mecânico mediado por MNP individual no LF-AMF; representação esquemática das bobinas magnéticas LF-AMF com indicação de seus principais parâmetros (Figura S14); ilustração esquemática dos efeitos magneto-mecânicos mediados por MNP individual no LF-AMF (Figura S15); (VI) Estudo experimental da clivagem do duplex de DNA; e histogramas da intensidade de fluorescência sCy5 após o tratamento de duplexes (18-60 bp) formados usando MNP-oligo-12 pelo LF-AMF (f = 180 Hz, τ = 10 min) em várias amplitudes de campo (Figura S16) ( PDF )