Resumo
Várias vacinas contra a COVID-19 usam nanopartículas para proteger a carga de antígenos (proteínas ou ácidos nucleicos), aumentar a imunogenicidade e, finalmente, a eficácia. A caracterização desses nanomedicamentos é desafiadora devido à sua complexidade intrínseca e requer o uso de técnicas e competências multidisciplinares. A caracterização precisa de nanovacinas pode ser conceituada como uma combinação de ensaios físico-químicos, imunológicos e toxicológicos. Isso ajudará a abordar os principais desafios na caracterização pré-clínica, orientará o rápido desenvolvimento de vacinas seguras e eficazes para crises de saúde atuais e futuras e agilizará o processo regulatório.
Principal
O esforço global sem precedentes para desenvolver vacinas contra a COVID-19 levou, em cerca de dois anos, a mais de 30 vacinas aprovadas ou em ensaios clínicos de fase 3. Várias dessas vacinas usam nanopartículas orgânicas (NPs) em suas formulações para a proteção e entrega da substância ativa (AS). A AS é uma proteína spike recombinante ou um ácido nucleico que codifica o antígeno viral (a proteína spike inteira do SARS-CoV-2 ou suas subunidades). Duas vacinas autorizadas pela Food and Drug Administration (FDA) dos EUA e pela European Medicines Agency (EMA) usam NPs lipídicas (LNP) para transportar o mRNA que codifica a proteína spike do SARS-CoV-2. Devido ao tamanho dos nanocarreadores (NCs), geralmente entre 50 e 200 nm, a formulação completa é geralmente chamada de nanovacina (NV). A NC na formulação contribui para as propriedades imunomoduladoras gerais da própria vacina, além da entrega e proteção da carga.
Os relatórios de avaliação dos dois NVs LNP–RNA mensageiro (mRNA) pela FDA e EMA destacam as dificuldades e desafios em sua caracterização e a amplitude de técnicas e considerações necessárias para uma tradução clínica bem-sucedida desses sistemas complexos. Para evitar contratempos dispendiosos, os pesquisadores devem incorporar no início do projeto e desenvolvimento dos NVs uma estratégia de caracterização adequada que utilize múltiplas técnicas, como combinar medições ortogonais e experiência interdisciplinar.
O primeiro relatório da EMA sobre a vacina de mRNA BNT162b2 (produzida pela BioNTech, Pfizer, comercialmente chamada de Comirnaty) destacou a necessidade de análises adicionais da medição do RNA intacto encapsulado, destino das espécies de mRNA truncado e/ou modificado, caracterização da proteína traduzida, avaliação de impurezas relacionadas a lipídios e caracterização biológica para fornecer uma avaliação completa do desempenho clínico.
A caracterização limitada demonstrou ser responsável pela administração errônea da dose no ensaio clínico de fase 3 da vacina de vetor viral Vaxzevria COVID-19, na qual um subconjunto da coorte recebeu meia dose da vacina como primeira dose. O erro foi corrigido após uma mudança na metodologia para quantificação da dosagem. Esse erro levou a um atraso na liberação da permissão da vacina e gerou ceticismo com implicações evidentes na confiança pública, o que destaca ainda mais a necessidade crítica e a importância de processos e diretrizes de caracterização robustos. Esses aspectos são de particular importância em situações de emergência nas quais o período de tempo para o desenvolvimento e a produção da vacina é extremamente crítico.
Como são totalmente sintéticos, os LNPs representam tecnologias flexíveis que devem evitar o risco de imunidade antivetor experimentado em relação aos vetores virais. Os NVs trazem a esperança de reduzir e/ou evitar a imunogenicidade do portador e permitir uma estratégia eficiente de reforço primário com o mesmo portador, que pode ser usada para a administração de doses adicionais de uma vacina contra a COVID-19 (como é o caso da gripe anual) em resposta às variantes emergentes ou para explorar a mesma NC em vacinas contra outros patógenos.
Para projetar vacinas capazes de induzir uma resposta ótima, é essencial otimizar sua imunogenicidade sem aumentar a reatogenicidade. Para abordar esses desafios, uma estratégia de caracterização comumente compartilhada é importante durante o desenvolvimento pré-clínico e também ajudaria os reguladores a avaliar melhor e mais rapidamente a eficácia e a segurança do produto.
Nanopartículas em nanovacinas contra a COVID-19
Vários NVs de COVID-19 foram desenvolvidos; eles podem ser agrupados em três categorias principais com base em seus componentes funcionais: vírus (não abordado aqui), baseados em proteínas ou baseados em ácidos nucleicos (Fig. 1a). Quase todos os NCs compartilham vários componentes, como lipídios ionizáveis, lipídios de polietilenoglicol (PEG), lipídios estruturais e colesterol (Fig. 1a), montados como NPs de 50 a 150 nm de tamanho. O objetivo de um design racional de NV é provocar uma resposta imune adaptativa eficaz que gere memória imunológica. Isso significa um sistema de vigilância de vida relativamente longa de células B de memória específicas capazes de construir uma expansão clonal massiva de blastos de plasma com subsequente diferenciação em células plasmáticas capazes de produzir anticorpos específicos em resposta à exposição ao patógeno. Esses anticorpos específicos devem bloquear a interação entre o vírus e a célula hospedeira (neutralização) e, finalmente, levar à eliminação do vírus. Além da geração de anticorpos neutralizantes, a ativação de células T CD8 + citotóxicas (CD, cluster of differentiation) é essencial para limpar células hospedeiras infectadas pelo vírus.
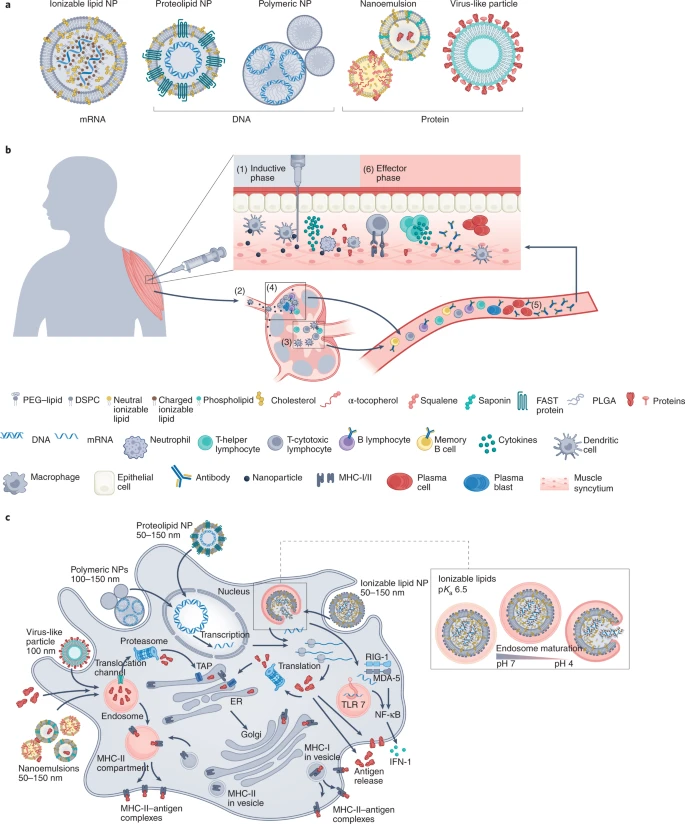
A administração intramuscular (IM) é a principal via de escolha para NVs de COVID-19, pois produz uma baixa reatogenicidade local e garante uma biodistribuição eficiente, o que contribui para a imunogenicidade geral dos NVs. Na injeção IM, o NV entra nos vasos linfáticos e é entregue aos linfonodos (Fig. 1b, (1) e (2)). Os NVs também são internalizados por células apresentadoras de antígenos residentes no tecido (APC: células dendríticas (DCs), monócitos e macrófagos) e por células musculares (Fig. 1b, (1)). Independentemente do NP usado, o objetivo final de todas essas nanoformulações é a entrega e/ou expressão eficiente do antígeno dentro da célula, seu processamento, o upload dos epítopos no complexo principal de histocompatibilidade (MHC) e a exposição na superfície do APC (Fig. 1c) para ativação de células T que suporta a produção de anticorpos de células B Fig. 1b, (6).
Caracterização de nanovacinas
A caracterização dos NVs é intrinsecamente diferente daquela das vacinas “tradicionais” ou dos nanomedicamentos; o NC geralmente contém vários componentes, a carga é frequentemente uma molécula biológica complexa e a administração do AS, o destino intracelular, a biodistribuição e, finalmente, a imunogenicidade dependem da composição do NC e das propriedades físico-químicas.
Aqui propomos uma estratégia de caracterização iterativa para a avaliação pré-clínica da qualidade, eficácia e segurança de NVs com base nas medições de propriedades físicas, químicas e de estabilidade, imunogenicidade e toxicidade in vitro e in vivo (Fig. 2). A ênfase na caracterização da imunogenicidade é uma grande diferença em comparação com a caracterização de segurança de nanomedicamentos administrados intravenosamente para tratamentos de câncer. De fato, para NVs o objetivo principal é promover uma resposta imune eficaz à carga, minimizando a resposta ao NC; para nanomedicamentos administrados intravenosamente, ao contrário, há uma necessidade de evitar ou reduzir a interação com o sistema imunológico. A Figura 2 destaca a natureza iterativa do processo de desenvolvimento que leva às formulações ideais com alta potência e toxicidade reduzida. Os métodos e os critérios de aceitabilidade para cada parâmetro crítico devem ser estabelecidos com base no mecanismo de ação da vacina específica e no impacto no desempenho de cada componente da formulação. Além disso, NVs baseados em mRNA ou proteína exigirão técnicas diferentes para a caracterização do AS.
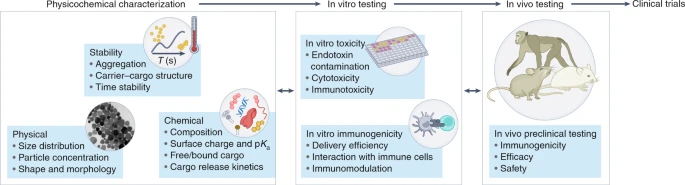
Propriedades físico-químicas da formulação impactam em sua imunogenicidade e segurança, por exemplo, o valor p Ka do lipídio ionizável na vacina LNP–mRNA da Moderna está diretamente ligado à sua potência e segurança geral. A disponibilidade dessas informações para uma ampla gama de formulações diferentes pode permitir que grupos estabeleçam correlações entre características físico-químicas de uma determinada formulação e sua imunogenicidade, eficácia e segurança. Para obter correlações significativas com dados experimentais publicados, há uma necessidade de melhorar a reprodutibilidade e robustez dos relatórios, conforme proposto pela iniciativa MIRIBEL (Minimum Information Reporting in Bio-Nano Experimental Literature).
Caracterização física
Tamanho ou, melhor, distribuição de tamanho de partícula, é uma propriedade chave de NVs e influencia tanto a imunomodulação quanto a biodistribuição do sistema NC–AS. Por exemplo, partículas LNP–mRNA de 146 nm induziram um título de imunoglobulina G (IgG) estatisticamente significativo maior em camundongos em comparação com os menores (64 nm). A dispersão dinâmica de luz é provavelmente a técnica mais usada para medir tamanho; é muito simples e fácil de usar, pode ser muito útil como um ponto de verificação preliminar para triagem de amostra, mas não é apropriado para amostras polidispersas. Técnicas que combinam uma etapa de separação (com base no tamanho das diferentes partículas) com uma medição on-line de tamanho (dispersão dinâmica de luz e/ou dispersão de luz multiangular) podem medir com precisão a distribuição de tamanho de amostras desafiadoras. Em particular, o fracionamento de fluxo de campo de fluxo assimétrico acoplado a multidetectores é bem adequado para NPs baseados em lipídios, mesmo que alguns ajustes técnicos precisem ser feitos para LNP–RNA. Outras técnicas, como análise de rastreamento de NP, detecção de pulso resistivo ajustável e ultracentrifugação analítica, também podem fornecer as informações necessárias, com vários graus de precisão, bem como outros dados complementares. A microscopia eletrônica de transmissão é a técnica mais usada (mesmo que tecnicamente exigente) para obter imagens de LNP–mRNA.
Caracterização química
A identificação e quantificação dos diferentes componentes tanto do NC quanto do AS é a principal etapa de caracterização química para NVs; geralmente requer uma preparação cuidadosa da amostra, seguida de medições com as técnicas analíticas apropriadas. A mais usada é geralmente a separação por cromatografia líquida (LC) acoplada a detectores de concentração com uma linearidade e sensibilidade apropriadas. A LC acoplada a um detector de aerossol carregado fornece resultados precisos para identificação e quantificação dos NCs lipídicos de vacinas autorizadas por LNP-mRNA. Resultados semelhantes também podem ser obtidos com detectores de espectrometria de massa (MS). A espectroscopia de RMN pode ser usada tanto para investigar a estrutura molecular dos novos excipientes lipídicos quanto para quantificá-los, e a espectrometria de massa de alta resolução pode fornecer informações complementares sobre a estrutura dos componentes lipídicos complexos. A caracterização do AS também é particularmente desafiadora — devido à complexidade das proteínas e ácidos nucleicos, ela precisa seguir sua hierarquia estrutural. A eletroforese (particularmente a eletroforese em gel capilar) é uma técnica versátil que pode fornecer informações sobre a integridade do ácido nucleico e da proteína, peso molecular e concentração, mas também, no caso de proteínas, sobre a agregação, ligações dissulfeto e glicosilação. O acoplamento de um método de separação analítica (como uma eletroforese capilar ou LC) a um detector MS/MS revela informações úteis sobre a sequência e modificações pós-traducionais de proteínas, bem como sobre a presença de eventuais contaminantes de fabricação (por exemplo, DNA residual). Para vacinas baseadas em RNA e DNA, a sequência pode ser confirmada por sequenciamento de última geração.
O encapsulamento na cauda poli-A 5′ e 3′ é importante para a estabilidade do mRNA e sua eficiência translacional, e resulta em uma maior produção do antígeno desejado, o que potencialmente leva a um índice terapêutico mais favorável. A quantidade de mRNA não encapsulado pode ser medida por LC-MS. De fato, a EMA em sua avaliação do BNT162b2 para autorização de comercialização exigiu mais dados de caracterização para o atributo de qualidade RNA intacto encapsulado.
A estrutura secundária de antígenos proteicos e mRNA pode ser medida com técnicas biofísicas clássicas, como dicroísmo circular. O conteúdo de AS pode ser medido com as técnicas analíticas sofisticadas descritas acima, mas também com outras mais simples (como absorção ultravioleta e fluorescência) usando sondas de marcação apropriadas para aumentar a sensibilidade. A medição da carga livre e/ou encapsulada é de importância crítica. Os métodos usuais combinam uma etapa de ultrafiltração para separar as moléculas de carga livre das ligadas, seguida pela quantificação com a técnica analítica apropriada. A medição do potencial ζ (o potencial eletrostático no plano hidrodinâmico de cisalhamento dos NPs) por meio de espalhamento de luz eletroforético é atualmente o método mais difuso e direto para caracterização de carga de superfície em nanocolóides. NCs que contêm lipídios ionizáveis também requerem a avaliação de seu p Ka, uma característica fundamental para a funcionalidade do NP (especialmente para escape endosomal, Fig. 1c), que pode ser avaliada por vários métodos, como potenciometria e fluorimetria.
Estabilidade
Dada a disseminação global da COVID-19, a distribuição e o armazenamento de vacinas têm levantado grande preocupação; o anúncio da aprovação regulatória da vacina BNT162b2 iniciou uma corrida tecnológica para encontrar sistemas mais estáveis e tolerantes a altas temperaturas. Diretrizes gerais de testes de estabilidade podem ser aplicadas para esses NVs (por exemplo, ICH Q1A (R2) e ICH Q5C); no entanto, como esta é a estreia de tal combinação de AS biotecnológica e nanotecnologias inovadoras de portadores, atenção especial é necessária.
Em vacinas baseadas em proteínas, o desdobramento estrutural do antígeno proteico pode reduzir a potência; a estabilidade e o desdobramento térmico dos antígenos proteicos ligados ao NC podem ser monitorados por dicroísmo circular e por calorimetria de varredura diferencial.
A identidade química, física e biológica da formulação deve ser avaliada em diferentes pontos de tempo, tratando as amostras de acordo com as condições reais de uso e armazenamento, que incluem ciclos de congelamento-degelo e o tempo de manipulação em temperatura ambiente. A tradução do laboratório para a aplicação real passa por uma avaliação de consistência de lote para lote. Devido à variedade de produtos existentes e à diversidade de suas características físico-químicas, é importante selecionar atributos de qualidade específicos para cada formulação, avaliar sua reprodutibilidade dentro de intervalos estabelecidos e realizar isso para um número apropriado de lotes.
Testes in vitro
Imunoestimulação in vitro
A avaliação da eficiência de entrega in vitro, a interação com células imunes, as propriedades imunomoduladoras e como modificações da composição de NP podem afetar essas propriedades é essencial na caracterização de novas vacinas baseadas em NP (Fig. 2). NPs desempenham um papel importante na ativação de APCs, que determinam a iniciação e polarização da resposta imune, uma etapa essencial para moldar e otimizar as respostas humorais e celulares da vacina (Fig. 1b, (3) e (4)). De fato, embora a internalização de NP ocorra mesmo em células musculares na injeção IM, DCs são o alvo principal e mais eficiente para entrega de NV (Fig. 1c), mesmo que outras APCs profissionais, como macrófagos e células B, possam apresentar o antígeno às células T. A interação e entrega de antígeno de NVs para DCs é, portanto, crítica e deve ser avaliada para otimizar o NV para a indução subsequente de respostas humorais e celulares da vacina (Fig. 1b, (3) e (4)). DCs derivadas de monócitos isoladas de células mononucleares do sangue periférico humano podem ser usadas para avaliar a captação de NV, ativação celular, processamento de antígeno e apresentações de MHC classe I e II (Fig. 1c). A cinética da captação de NV por células-alvo pode ser seguida por microscopia óptica de NPs e/ou carga corados com fluorescência. A maturação de DC pode ser monitorada pela análise da expressão de marcadores de ativação (moléculas T-coestimulatórias, como CD40, CD80 e CD86) usando citometria de fluxo multiparamétrica e produção de citocinas (cujo nível deve ser equilibrado para não superestimular a via inflamatória) com ensaio multiplex e citometria de fluxo intracelular.
Atualmente, novas tecnologias são implementadas para estudar a resposta imune in vitro. Vale ressaltar que a engenharia de tecidos (por exemplo, organoides tridimensionais) visa recriar uma versão in vitro de órgãos humanos, que são uma substituição muito promissora de modelos animais para apreciar o mecanismo de localização e acumulação de NP, e para realizar estudos toxicológicos e imunológicos.
Toxicologia in vitro
Após avaliar a esterilidade (ISO 11737-2:2019), biocarga (EN ISO 11737-1:2018) e presença de endotoxina (ISO 29701:2010 ou em ensaios alternativos baseados no receptor Toll-like 4 (TLR4)), outra etapa importante na caracterização do NV é o estabelecimento do perfil toxicológico, um pré-requisito para a biocompatibilidade da nanoformulação. A toxicologia pode ser avaliada in vitro seguindo os padrões disponíveis (ASTM E2526-08 e ISO 10993-22); no entanto, é recomendado também usar células-alvo mais relevantes, como células mononucleares do sangue total e do sangue periférico, bem como subtipos específicos de células imunes, como CEM (células T), Raji (linfócitos B) e linhas celulares THP-1 (monócitos humanos) para definir relações claras de exposição-resposta. As células mononucleares do sangue periférico são células adequadas para um teste de micronúcleo, que é necessário para a avaliação de risco de cada novo componente e excipiente NV. Embora os NVs sejam geralmente administrados IM, eles podem, no entanto, interagir com o sangue. Assim, a hematotoxicidade e a imunotoxicidade sanguínea, que incluem hemólise e ativação do complemento, devem ser avaliadas. Para este escopo, métodos de teste in vitro padrão projetados para NPs e dispositivos médicos (ASTM E2524-08, ISO 10993-4 e ISO/TR 10993-22:2017) fornecem um sistema estruturado de seleção de teste e referências que são úteis para também personalizar a análise de compatibilidade sanguínea para NVs, e são mais rápidos e menos dispendiosos do que os métodos in vivo. Estudos de ativação sistêmica do complemento dose-resposta são fundamentais, especialmente no caso de formulações baseadas em lipossomas ou biológicas, devido a potenciais reações de hipersensibilidade.
A coagulação e a cascata de coagulação são outro ponto crítico, pois a alteração desse sistema de cascata pode ter efeitos adversos importantes, como trombose. A trombocitopenia trombótica induzida por vacina, mediada pela presença de anticorpos ativadores de plaquetas contra o fator 4, surgiu como uma reação idiossincrática rara às vacinas contra a COVID-19 baseadas em adenovírus. Um caso da AstraZeneca sobre o risco de correlação entre a vacina contra a COVID-19 com adenovírus e trombose gerou grande preocupação, o que ressalta a importância dessa avaliação. Os efeitos sobre os glóbulos brancos também precisam ser avaliados, pois as interações adversas com nanomateriais podem prejudicar a defesa imunológica natural do corpo.
Testes pré-clínicos in vivo
Os modelos animais desempenham um papel crítico na avaliação da imunogenicidade, eficácia e segurança dos candidatos a vacinas (Fig. 2) e os dados pré-clínicos são obrigatórios para avançá-los para as fases clínicas. Com base nas diretrizes da Organização Mundial da Saúde sobre a avaliação não clínica de vacinas, os estudos pré-clínicos em modelos animais devem ser conduzidos em estrita conformidade com as regulamentações nacionais e internacionais para a proteção de animais de laboratório e requisitos de biossegurança. É importante ressaltar que a via de administração deve corresponder àquela pretendida para os estudos clínicos. Modelos de pequenos animais, como camundongos e ratos, são úteis para uma avaliação preliminar da segurança, imunogenicidade e dosagem dos candidatos a vacinas. Primatas não humanos (ou seja, macacos rhesus) são reconhecidos, até o momento, como os melhores modelos para avaliar a eficácia protetora dos candidatos a vacinas, pois são filogeneticamente relacionados aos humanos (seu sistema imunológico, anatomia do sistema respiratório e estrutura do tecido são muito semelhantes).
A biodistribuição e persistência do NP podem ser avaliadas por técnicas de imagem in vivo, que nos permitem otimizar o NV facilitando o transporte e o acúmulo para órgãos-alvo (órgãos linfáticos secundários), ao mesmo tempo em que limitam a frequência e a gravidade dos eventos adversos reduzindo as reações locais (efeitos fora do alvo).
A indução e persistência de anticorpos específicos do domínio de ligação ao receptor (RBD) e spike do SARS-CoV-2 ao longo do tempo devem ser avaliadas como indicadores de respostas humorais específicas do vírus. A funcionalidade do anticorpo induzido (especialmente a capacidade de prevenir a infecção da célula hospedeira pela neutralização do vírus) pode ser avaliada usando ensaios de neutralização por redução de placa de vírus vivo ou do tipo pseudovírus e com o teste de neutralização do vírus substituto do SARS-CoV-2 baseado em um bloqueio mediado por anticorpos da interação proteína-proteína ACE2-spike (ensaio de inibição de hACE2/RBD; hACE2, enzima conversora de angiotensina humana 2). Dado que o vírus SARS-CoV-2 infecta principalmente a superfície mucosa do trato respiratório, é particularmente importante avaliar as respostas imunes da mucosa de anticorpos IgA secretores e IgG local em amostras de mucosa coletadas no trato respiratório (lavagens pulmonares e nasais) e respostas de células B e T específicas de antígeno provocadas no tecido linfoide associado à mucosa nasal de roedores (que se assemelha ao anel de Waldeyer humano) ou em linfonodos cervicais de drenagem.
A indução de células B de memória é um resultado crítico de uma estimulação eficaz do sistema imunológico pela vacinação. As células B de memória spike e RBD específicas do SARS-CoV-2 podem ser analisadas por citometria de fluxo multiparamétrica usando um antígeno spike fluorescente como sonda combinada com diferentes anticorpos marcadores de superfície específicos para o fenótipo de memória. Para avaliar a função efetora das células B positivas para antígeno na vacinação, a frequência de células secretoras de anticorpos específicos para antígeno pode ser determinada por um ensaio de ponto absorvente imune ligado a enzima na reestimulação do antígeno.
A imunogenicidade da formulação NV também é medida pela capacidade de direcionar células T auxiliares (TH) em direção às respostas TH1, TH2 e/ou TH17 , analisando o perfil de citocinas das células T (por exemplo, interferon γ (IFN-γ), interleucina 2 (IL-2), fator de necrose tumoral α, IL-4, IL-5, IL-10, IL-13 e IL-17), que pode ser medido com coloração de citocina intracelular (ICS) por citometria de fluxo ou ensaio de citocina multiplex. Os tetrâmeros MHC-peptídeo representam uma tecnologia poderosa para a detecção de células T específicas de antígeno por ligação específica ao seu receptor de células T, e sua combinação com ensaios funcionais, ou seja, coloração de citocina intracelular, pode ser instrumental para caracterizar a resposta de células T efetoras específicas de antígeno. Neste contexto, a análise computacional de dados complexos de citometria de fluxo multiparamétrica representa uma ferramenta poderosa para dissecar todos os possíveis fenótipos celulares de forma imparcial e independente do operador e pode ser conduzida para caracterizar profundamente vários subconjuntos de células B e T.
Para vacinas contra a COVID-19, a eficácia depende principalmente de anticorpos neutralizantes. Embora ainda não haja um limite de proteção unânime estabelecido para humanos, estudos de desafio in vivo em camundongos podem demonstrar o papel protetor e a segurança do NV. Os modelos animais de infecção por SARS-CoV-2 atualmente usados são camundongos transgênicos hACE2 e primatas não humanos (este último, embora não explicitamente exigido em documentos de orientação regulatória, é um modelo animal crítico para a avaliação imunológica de NVs) infectados intranasalmente ou intratraquealmente. Estudos de desafio-proteção que monitoram a ausência de replicação do patógeno em órgãos-alvo (por exemplo, pulmões e corneto nasal para a doença COVID-19) e eventual perda de peso corporal ou outras condições patológicas associadas devem ser conduzidos. Modelos de infecção humana controlada, como os já usados em estudos de influenza ou salmonela, também foram propostos como uma possível abordagem para acelerar o desenvolvimento da vacina contra SARS-CoV2.
Estudos toxicológicos in vivo são necessários para avançar para ensaios clínicos e devem ser conduzidos de acordo com as diretrizes da OMS. Estudos de toxicidade devem abordar o potencial da vacina para causar reações inflamatórias locais e possíveis efeitos nos gânglios linfáticos drenantes, toxicidade sistêmica e no sistema imunológico, juntamente com observações de sinais clínicos de rotina (como peso corporal, postura, marcha e consumo de alimentos).
Nos relatórios de avaliação pública da EMA, para o respectivo NV, a Pfizer/BioNTech e a Moderna forneceram dados imunológicos da vacina sobre a caracterização da resposta imune humoral (resposta de anticorpos IgG específicos para antígeno, afinidade de ligação anticorpo-antígeno e título de anticorpos neutralizantes) e celular (subconjuntos de células T CD4+ e CD8+ e caracterização do imunofenótipo de células B e T em linfonodos de camundongos) e perfil de citocinas em dois modelos animais (camundongos e primatas não humanos) e conduziram estudos de desafio em macacos rhesus como uma prova de conceito não clínica, enquanto testes de toxicologia pré-clínica, para avaliação de segurança, foram conduzidos em ratos.
Conclusões e perspectiva
A velocidade sem precedentes de avanço das vacinas contra a COVID-19 mudou a estratégia convencional para o desenvolvimento de vacinas (por exemplo, estudos de segurança e eficácia foram conduzidos simultaneamente, protocolos de testes tradicionais foram encurtados e procedimentos de regulamentação foram conduzidos em paralelo em vários países) e destaca seu papel estratégico no combate a pandemias.
A capacidade dos NCs de modular respostas humorais e celulares, criticamente importantes no caso de um sistema imunológico comprometido ou senescente, como na população idosa, juntamente com o sucesso comprovado na administração sistêmica e mucosa, os tornam particularmente úteis para o design de vacinas. De fato, eles podem incorporar diversos antígenos e imunoestimulantes em comparação com vacinas convencionais de subunidade e/ou adjuvantes e, além disso, melhorar a estabilidade e a vida útil do AS.
A atual emergência pandêmica deu um impulso excepcional aos testes clínicos dessas nanotecnologias, que servem como um banco de testes global que está nos levando a repensar os parâmetros convencionais da nanomedicina e adaptar os processos de caracterização de acordo. A implementação de uma estratégia de caracterização estruturada contribuirá para melhorar o desempenho da vacina e reduzir os tempos de desenvolvimento, um aspecto crítico, especialmente em resposta a surtos de patógenos emergentes e resistência antimicrobiana, um desafio ‘futuro’ já declarado. Encontrar o fluxo de trabalho certo significa que devemos avaliar criticamente cada técnica de medição e, eventualmente, inovar os métodos quando necessário. As diferentes técnicas (e especialmente as mais inovadoras) precisarão de materiais de referência e métodos padrão para garantir a confiança necessária nas medições. A caracterização otimizada desempenhará um papel fundamental no rápido desenvolvimento dos NVs de ‘próxima geração’ que, idealmente, serão estáveis à temperatura ambiente e, portanto, exigirão condições de armazenamento menos rigorosas e, portanto, serão mais simples de produzir e entregar.
As inúmeras plataformas de vacinas propostas exigem linhas de produção muito distintas, o que aumentou a incerteza do investimento e, portanto, alguns candidatos dependem de abordagens de vacinas comprovadas adaptadas por grandes empresas farmacêuticas com experiência comprovada em regulamentação e fabricação. Empresas menores e laboratórios acadêmicos demonstraram ser participantes importantes no desenvolvimento de vacinas contra a COVID-19, particularmente adequadas para o desenvolvimento e caracterização de NVs, mas muitos não têm o amplo espectro de competências e técnicas de medição e ampla experiência no processo regulatório. Eles poderiam se beneficiar particularmente de um processo de caracterização de vacinas predefinido que pudesse orientá-los nas etapas de caracterização a serem conduzidas, além de serviços externos para a análise que não pode ser realizada internamente. Existem, de fato, vários laboratórios de caracterização e infraestruturas de pesquisa, como o US National Cancer Institute Nanotechnology Characterization Laboratory (https://ncl.cancer.gov/), o European Union Nanomedicine Characterization Laboratory (www.euncl.org), o consórcio TRANSVAC (www.transvac.org) e organizações especializadas de pesquisa contratada que poderiam fornecer a análise necessária uma vez guiadas por um processo de caracterização definido. Isso seria particularmente relevante para que os reguladores apoiassem a avaliação de novas vacinas e acelerassem o processo de aprovação, especialmente em emergências.
Dada a escala e a urgência, a colaboração internacional tem um papel fundamental para desenvolver, validar e aplicar métodos de medição e padrões em NVs. Cientistas pesquisadores da academia, indústria e agências reguladoras devem unir forças para identificar e priorizar medições e padrões específicos necessários para facilitar o desenvolvimento pré-clínico dessas vacinas inovadoras.
s41565-022-01129-w
