Evidência adicional de como infecções repetidas e exposições à proteína Spike destroem órgãos importantes.
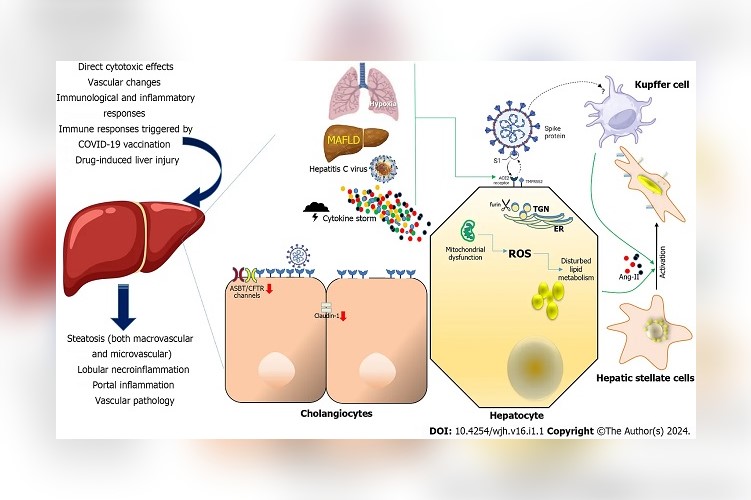
Mecanismos de lesão hepática induzida pela doença do coronavírus-2 da síndrome respiratória aguda grave e suas consequências no nível do órgão (esquerda). Alvos celulares do coronavírus-2 da síndrome respiratória aguda grave envolvidos em danos ao fígado (centro e direita). Vários fatores foram postulados como contribuindo para a lesão hepática no contexto da doença por coronavírus 2019 (COVID-19), incluindo efeitos citotóxicos diretos, alterações vasculares, respostas imunológicas e inflamatórias associadas à COVID-19, respostas imunes desencadeadas pela vacinação contra a COVID-19, e lesão hepática induzida por drogas. No contexto da lesão hepática associada à COVID-19, os padrões histológicos abrangem características como esteatose (macrovascular e microvascular), necroinflamação lobular, inflamação portal e patologia vascular. No nível celular, a hipóxia, a doença hepática gordurosa associada à disfunção metabólica e a infecção concomitante pelo vírus da hepatite C e a tempestade de citocinas podem regular positivamente a expressão da enzima conversora de angiotensina-2 (ECA2), da serina protease 2 transmembrana e da furina nos hepatócitos. A disfunção mitocondrial foi afetada diretamente pela infecção dos hepatócitos por síndrome respiratória aguda grave por coronavírus-2 (SARS-CoV-2), que por sua vez pode estar ligada à inflamação pré-existente e aos impactos adversos do tecido adiposo excessivo e disfuncional. Nos colangiócitos, o SARS-CoV-2 leva a uma diminuição na expressão do mRNA da Claudina-1 e regula negativamente a expressão de transportadores hepatobiliares, como o ASBT e o canal de cloreto CFTR. A expressão da ECA-2 nas células de Kupffer ainda é controversa. As células estreladas hepáticas parecem não expressar ACE2 em nenhum estado de ativação. A sua activação é um evento crucial na progressão da doença hepática crónica, uma vez que estas células servem como fonte primária de fibrose, e é induzida por sinais pró-inflamatórios e pró-fibróticos, incluindo a angiotensina II, que é gerada pela acção catalítica da ECA como parte do ramo profibrótico do sistema renina-angiotensina. As células do fígado e de Kupffer são criadas com BioRender.com. ROS: Espécies reativas de oxigênio; ECA2: Enzima conversora de angiotensina-2; TMPRSS2: serina protease 2 transmembrana; MAFLD: doença hepática gordurosa associada à disfunção metabólica; RE: retículo endoplasmático; TGN: Rede Trans-Golgi.
Afirmei repetidamente que, embora as infecções iniciais e as exposições à Proteína Spike possam resultar em danos recuperáveis aos principais órgãos, as exposições repetidas podem iniciar um ciclo de feedback de ROS. Este ciclo de feedback pode então progredir inexoravelmente para um estado em que os órgãos afetados se tornam uma massa fibrótica não funcional.
Na verdade, isso foi comprovado.
No coração:
Conclusão: Nossos dados demonstraram que a proteína Spike poderia induzir a supressão transcricional a longo prazo dos genes metabólicos das mitocôndrias e causar fibrose cardíaca e comprometimento contrátil miocárdico, fornecendo insights mecanísticos para a cardiomiopatia relacionada ao PACS.
A proteína Spike SARS-CoV-2 induz perturbações transcricionais de longo prazo de genes metabólicos mitocondriais, causa fibrose cardíaca e reduz a contrátil miocárdica em camundongos obesos
https://pubmed.ncbi.nlm.nih.gov/36656778/
Os pulmões:
No presente estudo, mostramos que a administração sistêmica da proteína S1 derivada do SARS-CoV-2 provoca, por si só, uma lesão pulmonar progressiva em camundongos, caracterizada por disfunção precoce das células endoteliais, levando a subsequentes danos tromboinflamatórios e fibróticos.
A proteína spike SARS-CoV-2 induz disfunção das células endoteliais pulmonares e tromboinflamação dependendo da sinalização do receptor C3a/C3a
https://www.nature.com/articles/s41598-023-38382-5#
Os rins:
Talvez a parte mais interessante do estudo de Jansen e colegas4 sejam os dados obtidos a partir de organoides renais humanos. Este modelo foi usado anteriormente para avaliar as respostas às terapias experimentais de COVID-19 porque os organoides renais humanos expressam ACE2 e protease transmembrana serina 2 (TMPRSS2) em estruturas semelhantes a túbulos proximais. O TMPRSS2 é necessário para a preparação da proteína spike do SARS-CoV-2 e subsequente entrada viral nas células. Os organoides renais são facilmente infectáveis com SARS-CoV-2 e fornecem um modelo independente de fatores hemodinâmicos ou sistêmicos para examinar o impacto da invasão viral direta na fibrose. Organoides renais infectados com SARS-CoV-2 regularam positivamente as vias de sinalização pró-fibróticas em comparação com organoides não infectados.
Potencial infecção renal por SARS-CoV-2 e caminhos para lesões
https://www.nature.com/articles/s41581-022-00551-6
Agora há evidências que mostram que esse mesmo mecanismo ocorre no fígado.
Mais uma vez, não posso enfatizar demais o quão perigoso é ter o ACE2 como receptor principal.
LEMBRE-SE: O HIV infecta células CD4. O CD4 é encontrado… nas células CD4. ACE2 está EM TODA PARTE.
No entanto, o ambiente pró-inflamatório instigado pela lesão direta ou indireta de hepatócitos e colangiócitos no contexto da COVID-19 pode estabelecer condições propícias à ativação de células estreladas hepáticas, iniciando assim o processo de fibrose (Figura 1). Este cenário pode ser particularmente pertinente para indivíduos que já apresentam doenças hepáticas crônicas subjacentes, como a MAFLD, uma condição caracterizada por esteatose em > 5% do parênquima hepático. Embora os dados disponíveis indiquem que a lesão hepática causada pela COVID-19 é tipicamente ligeira e temporária, estudos de vigilância a longo prazo são essenciais para avaliar completamente a possibilidade de desenvolvimento de fibrose hepática como um efeito a longo prazo da COVID-19, especialmente em doentes com pré- -doenças hepáticas existentes.
Contudo, este não é o ponto mais importante. Essa seria a presença de Spike dentro dessas células – a ORIGEM.
No entanto, alguns investigadores conseguiram demonstrar a presença de partículas distintas de coronavírus, incluindo estruturas de espículas, no citoplasma dos hepatócitos em indivíduos com COVID-19. Estas observações foram acompanhadas por sinais de inchaço mitocondrial e apoptose, sugerindo uma ligação potencial entre o vírus e danos celulares no fígado. O espectro diversificado de padrões de lesões histológicas observados em indivíduos infectados com SARS-CoV-2, incluindo características como esteatose macrovascular e microvascular, necroinflamação lobular, inflamação portal e patologia vascular, provavelmente enfatiza a natureza intrincada e multifatorial subjacente aos resultados anormais dos testes hepáticos em no contexto da lesão hepática associada à COVID-19.
Mecanismos moleculares subjacentes ao hepatotropismo e danos hepáticos do SARS-CoV-2
https://www.wjgnet.com/1948-5182/full/v16/i1/1.htm
Então, o que estamos enfrentando é que infecções/exposições repetidas INDUZEM/EXACERBAM essas condições hepáticas. O que existe torna-se pior, o que é saudável torna-se patológico.
E aqui. AQUI ESTÁ O PONTO PRINCIPAL.
Com exposições e infecções repetidas, como é que o fígado (ou qualquer outro órgão) tem tempo para CURAR antes do início do próximo ataque?
Continuo pesquisando terapias para construir uma fortaleza poderosa dentro de nossos corpos para manter a proteína Spike sob controle, limitar os danos e permitir que nossos corpos se curem. No entanto, com o vírus se tornando cada vez mais transmissível… Você vê o dilema? Mesmo assim, continuarei trabalhando e tendo esperança.