Um estudo médico revisado por pares mostra que dois suplementos comuns de venda livre combinam-se para destruir a proteína spike do SARS-CoV-2. Este artigo reimprime o estudo revisado por pares e informa quais suplementos ELES usaram para eliminar a proteína spike. Talvez as pessoas que tomaram as “vacinas” possam usar isso para eliminar as proteínas spike dentro de si mesmas, que estão deixando muitas delas doentes e matando muitas outras?
No interesse da divulgação completa, NÃO vendo nenhum dos suplementos mencionados aqui e NÃO ganho DINHEIRO de ninguém, por passar essas informações para você. Eu faço isso como um serviço público.
Este artigo revisado por pares foi publicado em março de 2021, mas ninguém na mídia se preocupou em contar ao público. A única coisa que a mídia fez foi empurrar a vacina. Agora, muitas pessoas estão mortas, morrendo ou muito doentes por causa da vacina.
Parece que o RNA mensageiro na vacina faz com que nossas células humanas “expressem uma proteína spike” como a do Coronavírus que causa o COVID. Exceto que as células humanas não “expressam uma proteína spike”.
Abaixo, está o estudo que mostrou dois suplementos alimentares de venda livre, bromelaína e acetilcisteína (NAC), quando usados juntos – não separadamente – fazem com que as ligações das proteínas spike se desfaçam e se dissolvam em nada. As imagens dos resultados estão abaixo!
A COMBINAÇÃO DE BROMELAÍNA E ACETILCISTEÍNA (BROMAC) INATIVA SINERGICAMENTE O SARS-COV-2
Introdução
A recentemente emergente síndrome respiratória aguda grave coronavírus 2 (SARS-CoV-2) é o agente causador da doença de coronavírus 2019 (COVID-19), que pode variar de formas assintomáticas a formas graves e letais com uma síndrome de resposta inflamatória sistêmica. Em 21 de fevereiro de 2021, mais de 111 milhões de casos confirmados foram relatados, com uma mortalidade geral estimada de 2,2%. Atualmente, existem poucos agentes terapêuticos comprovadamente benéficos na redução da progressão da doença em estágio inicial e tardio. Embora existam, felizmente, muitos candidatos a vacina, sua ampla disponibilidade para vacinação pode não ser imediata, a duração da proteção imunológica pode ser limitada, e a eficácia das vacinas pode ser reduzida por novas variantes de SARS-CoV-2. A exploração contínua de tratamentos eficazes é, portanto, ainda necessária.
Estruturalmente, o SARS-CoV-2 contém proteínas spike de superfície, proteínas de membrana e proteínas de envelope, bem como nucleoproteínas internas que empacotam o RNA. A proteína spike é um complexo de glicoproteína homotrímero com diferentes funções realizadas por meio de modificações conformacionais dinâmicas, baseadas em parte em pontes dissulfeto. Ele permite a infecção de células-alvo pela ligação aos receptores da enzima conversora de angiotensina humana (ACE2), entre outros, que desencadeiam a proteólise pela protease transmembrana serina 2 (TMPRSS2), furina e talvez outras proteases, levando ao vírion e à membrana da célula hospedeira fusão.
A entrada de vírus nas células de mamíferos, ou “internalização do vírus”, é um mecanismo chave da infecção por vírus envelopados e é baseada em mudanças conformacionais dinâmicas de suas glicoproteínas de superfície, ou seja, mediadas pela redução da ligação dissulfeto e reguladas por oxidorredutases e proteases da superfície celular. Foi demonstrado que a entrada do SARS-CoV-2 nas células hospedeiras começa com a desestabilização da proteína spike por meio da transição mecânica alostérica, que induz uma mudança conformacional do estado fechado “para baixo” para abrir o estado “para cima” do domínio de ligação ao receptor (RBD) da proteína spike. As mudanças conformacionais de RBD e ligação do vírus são induzidas por TMPRSS2 ou Catepsina L, que desencadeiam a transição do estado de pré-fusão para pós-fusão. A energia liberada pela redução da ligação dissulfeto aumenta a flexibilidade da proteína, que é máxima quando o estado reduzido está completo, permitindo assim a fusão das membranas hospedeiro-vírus, que de outra forma seria impossível devido às forças repulsivas de hidratação presentes antes da redução.
A bromelaína é extraída principalmente do caule da planta do abacaxi (Ananas comosus) e contém uma série de enzimas que lhe conferem a capacidade de hidrolisar ligações glicosídicas em carboidratos complexos. Estudos anteriores indicaram que a bromelina remove as proteínas spike e hemaglutinina do vírus Semliki Forest, vírus Sindbis, coronavírus gastrointestinal de camundongo, vírus da encefalomielite hemaglutinante e vírus influenza H1N1. Como molécula terapêutica, é utilizado para desbridamento de queimaduras. A acetilcisteína é um poderoso antioxidante que é comumente nebulizado nas vias aéreas para acúmulo de muco e também é usado como agente hepatoprotetor na overdose de paracetamol. Mais importante no presente contexto, a acetilcisteína reduz as pontes dissulfeto. Além disso, a associação das proteínas spike e envelope por seus respectivos motivos triplos de cisteína garante a hipótese de impactar a estabilidade do vírion após a ruptura da ponte dissulfeto pela ação da acetilcisteína. A combinação de bromelaína e acetilcisteína (BromAc) apresenta um efeito mucolítico sinérgico que é utilizado no tratamento de tumores mucinosos e como um quimiossensibilizador de várias drogas anticancerígenas. Essas diferentes ações se devem à capacidade do BromAc de desdobrar as estruturas moleculares de glicoproteínas complexas, permitindo assim que ocorra a ligação devido à alta afinidade entre RBD e ACE2.
Portanto, no presente estudo, nos propusemos a determinar se o BromAc pode interromper a integridade das proteínas spike e envelope do SARS-CoV-2 e, subsequentemente, examinar seu potencial de inativação contra a replicação in vitro de duas cepas virais, incluindo uma com uma alteração mutante de spike do novo local de clivagem S1/S2.
Materiais e métodos
2.1. Materiais
O API de bromelaína foi fabricado por Mucpharm Pty Ltd (Kogarah, Austrália) como um pó estéril. A acetilcisteína foi adquirida da Link Pharma (Cat# AUST R 170803; Warriewood, Austrália). A proteína spike SARS-COV-2 recombinante foi obtida da SinoBiological (Cat# 40589-V08B1; Beijing, China). A proteína do envelope recombinante foi obtida de MyBioSource (Cat# MBS8309649; San Diego, CA, EUA). Todos os outros reagentes eram da Sigma Aldrich (St. Louis, MO, EUA).
2.2. Eletroforese de gel de envelope e spike recombinante
As proteínas spike ou envelope foram reconstituídas em água destilada estéril de acordo com as instruções do fabricante e as alíquotas foram congeladas a -20 °C. Dois microgramas e meio de spike ou proteína de envelope foram incubados com 50 ou 100 µg/mL de bromelaína, 20 mg/mL de acetilcisteína ou uma combinação de ambos em água Milli-Q. O controle não continha drogas. O volume total da reação foi de 15 µL cada. Após 30 min de incubação a 37 °C, 5 µL de tampão de amostra foram adicionados a cada reação. Um total de 20 µL de cada reação foi submetido a eletroforese em um SDS-PAGE (Cat# 456-1095; Bio-Rad Hercules, CA, EUA). Os géis foram corados com azul de Coomassie.
2.3. Detecção espectral de UV de pontes dissulfeto em proteínas spike e envelope
O método de Iyer e Klee para a medição da taxa de redução de pontes dissulfeto tem sido usado para detectar pontes dissulfeto em proteínas spike e envelope. A proteína spike SARS-CoV-2 recombinante a uma concentração de 3,0 µg/mL em solução salina tamponada com fosfato (PBS) (pH 7,0) contendo ácido etilenodiaminotetracético (EDTA) 1 mM foi incubada com 0, 10, 20, 40 e 50 µL de Acetilcisteína (0,5 M), agitado a 37 °C por 30 min, seguido pela adição equivalente de Ditiotreitol (DTT) (0,5 M) e agitado por mais 30 min a 37 °C. A proteína spike foi incubada em paralelo apenas com DTT (0,5 M) como antes sem qualquer acetilcisteína e agitada a 37°C por 30 min. A absorbância foi então lida a 310 nm. A detecção espectral de UV de pontes dissulfeto na proteína do envelope foi realizada de maneira semelhante.
2.4. Inativação do vírus inteiro SARS-CoV-2 com BromAc
Respeitando totalmente as orientações provisórias de biossegurança da Organização Mundial da Saúde (OMS) relacionadas à doença do coronavírus, os testes de inativação do vírus SARS-CoV-2 foram realizados com uma cepa do tipo selvagem (WT) representativa dos primeiros vírus europeus circulantes (número de acesso GISAID EPI_ISL_578176). Uma segunda cepa de SARS-CoV-2 (denotada como ∆S), relatada por meio de vigilância genômica de rotina na região de Auvergne-Rhône-Alpes, na França, foi adicionada aos testes de inativação devido a uma mutação rara no local de clivagem S1/S2 da spike e sua disponibilidade de cultura no laboratório (número de acesso GISAID EPI_ISL_578177).
Esses testes foram conduzidos com concentrações incrementais de bromelaína sozinha (0, 25, 50, 100 e 250 µg/mL), acetilcisteína sozinha (20 mg/mL) e a reação cruzada das diferentes concentrações de bromelaína combinada com uma constante de 20 mg/mL de formulação de acetilcisteína, contra duas diluições de cultura de vírus a 10 5,5 e 10 4,5 TCID50/mL. Após 1 h de exposição à droga a 37 °C, todas as condições, incluindo o controle, foram diluídas 100 vezes para evitar citotoxicidade, inoculadas em quadruplicado em células Vero confluentes (CCL-81; ATCC ©, Manassas, VA, EUA) e incubado por 5 dias a 36 °C com 5% de CO2. As células foram mantidas em meio essencial mínimo de Eagle (EMEM) com 2% de penicilina-estreptomicina, 1% de L-glutamina e 2% de soro fetal bovino inativado. Os resultados foram obtidos por observações diárias de microscopia óptica, um ensaio de coloração de lise celular de ponto final e reação em cadeia da polimerase com transcriptase reversa (RT-PCR) de extratos de RNA sobrenadante. Resumidamente, o ensaio de coloração de lise celular de ponto final consistiu na adição de corante vermelho neutro (Merck KGaA, Darmstadt, Alemanha) a monocamadas celulares, incubação a 37 °C por 45 min, lavagem com PBS e adição de etanol citrato antes da densidade óptica (OD) foi medida a 540 nm (Labsystems Multiskan Ascent Reader, Thermo Fisher Scientific, Waltham, MA, EUA). OD foi diretamente proporcional às células viáveis, portanto, um baixo OD significaria importante lise celular devido à replicação do vírus. Além disso,® (bioMérieux, Lyon, FR) e SARS-CoV-2 RdRp IP2-targeted RdRp Institute Pasteur RT-PCR foi realizado em um sistema QuantStudio™ 5 (Applied Biosystems, Thermo Fisher Scientific, Foster City, CA, EUA). Os valores de redução de log 10 (LRV) da replicação viral foram calculados pela diferença entre os poços de tratamento e controle por condição dividida por 3,3 (como 1 log 10 ≈ 3,3 limiares do ciclo de PCR (Ct)).
2.5. Cinética de replicação por análise celular em tempo real
Para comparar a capacidade de replicação in vitro das cepas WT e ∆S SARS-CoV-2, a cinética de replicação foi determinada medindo a impedância do eletrodo de sensores de células microeletrônicas no xCELLigence Real-Time Cell Analyzer (RTCA) DP Instrument (ACEA Biosciences, Inc., San Diego, CA, EUA). Células Vero foram semeadas a 20.000 células por poço em um E-Plate 16 (ACEA Biosciences, Inc., San Diego, CA, EUA) e incubadas com as mesmas condições de meio descritas anteriormente a 36 °C com 5% de CO2. Após 24 h, os isolados da cultura SARS-CoV-2 foram inoculados em triplicado em uma multiplicidade de infecção de 10-2. Infecções simuladas foram realizadas em quadruplicata. Os dados de impedância eletrônica (índice celular) foram coletados continuamente em intervalos de 15 minutos por 6 dias. Área sob a análise da curva do índice celular normalizado, estabelecido no momento da inoculação, foi então calculado em intervalos de 12 horas. Em cada intervalo, a viabilidade celular foi determinada pela normalização contra o controle celular correspondente. Testes de comparação múltipla de Tukey foram usados para comparar cada condição no GraphPad Prism (software versão 9.0; San Diego, CA, EUA).
Resultados
3.1. Alteração das proteínas spike e envelope do SARS-CoV-2
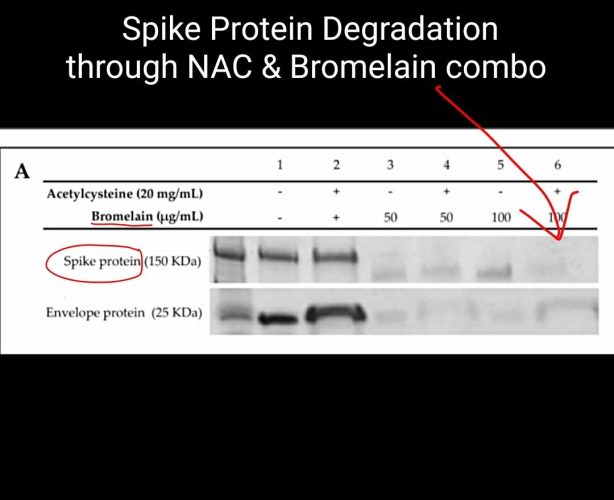
O tratamento da proteína spike apenas com acetilcisteína não apresentou nenhuma alteração da proteína, enquanto que as concentrações de Bromelaína a 50 e 100 µg/mL e BromAc a 50 e 100 µg/20 mg/mL resultaram em alteração da proteína (Figura 1 A). O tratamento com Acetilcisteína na proteína do envelope não alterou a proteína, enquanto o tratamento com Bromelaína a 50 e 100 µg/mL e BromAc a 50 e 100 µg/20 mg/mL também resultou em fragmentação quase completa (Figura 1 A).
Figura 1. (A) A bromelaína e a acetilcisteína apresentam um efeito sinérgico na spike de coronavírus da síndrome respiratória aguda grave (SARS-CoV-2) e na desestabilização da proteína do envelope. SDS-PAGE das subunidades S1 + S2 da proteína spike SARS-CoV-2 recombinante (150 kDa) e proteína do envelope (25 kDa). As proteínas foram tratadas com 20 mg/mL de Acetilcisteína sozinha, 100 e 50 µg/mL de Bromelaína sozinha e uma combinação de 100 e 50 µg/20 mg/mL de BromAc. (B) Redução de dissulfeto da proteína spike SARS-CoV-2 recombinante por acetilcisteína. O ensaio diferencial entre Acetilcisteína (Ac) e Ditiotreitol (DTT) para a redução das pontes dissulfeto encontradas na proteína spike indica que a Acetilcisteína reduz 42% das pontes dissulfeto antes da adição de DTT. As ligações restantes são reduzidas por DTT para produzir o cromogênio detectado em 310 nm. (C) Redução de dissulfeto da proteína recombinante do envelope SARS-CoV-2 por acetilcisteína. O ensaio diferencial entre Acetilcisteína (Ac) e Ditiotreitol (DTT) para a redução das ligações dissulfeto encontradas na proteína do envelope indica que a Acetilcisteína reduz 40% das ligações antes da adição do DTT.
3.2. A detecção espectral de UV demonstra a alteração das pontes dissulfeto em proteínas spike e envelope
A redução comparativa de ligações dissulfeto na proteína spike entre DTT sozinho e DTT com acetilcisteína demonstrou uma diferença de 42% (Figura 1 B), com base na inclinação dos gráficos (0,002599/0,006171 (100) = 42%). A acetilcisteína foi assim capaz de reduzir 58% das ligações dissulfeto na amostra, após o que as pontes dissulfeto restantes foram reduzidas por DTT para produzir o cromogênio que foi monitorado nos espectros. Da mesma forma, o ensaio diferencial entre acetilcisteína e DTT para a redução das pontes dissulfeto encontradas na proteína do envelope (0,007866/0,01293 (100) = 60%) indica que a acetilcisteína reduz 40% das pontes dissulfeto antes da adição de DTT (Figura 1 C).