A destruição lenta e progressiva da microvasculatura pode explicar a patogênese da COVID Longa e da doença/lesão da Proteína Spike.
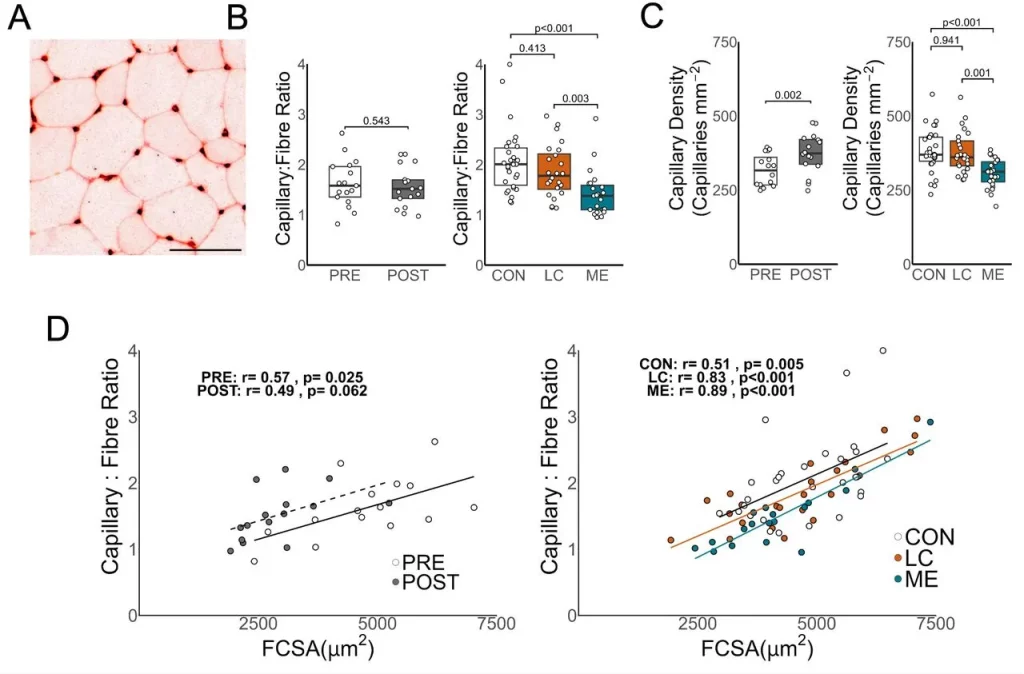
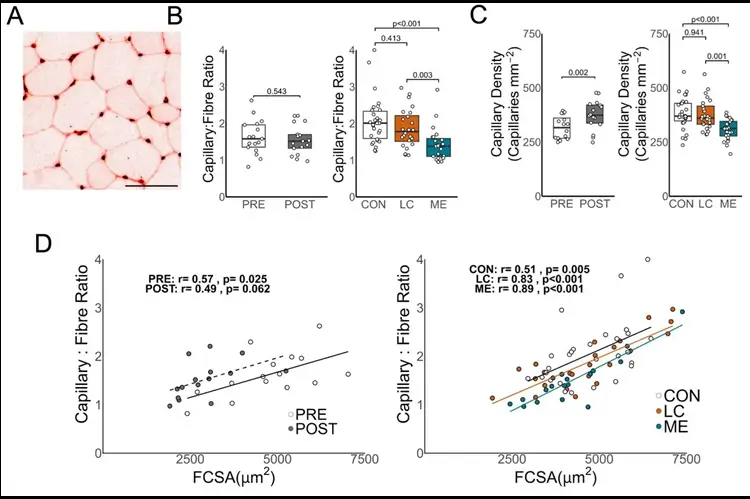
Um exemplo típico de coloração com lectina para capilares é mostrado em A. A barra de escala representa 100 µm. Após o repouso no leito, a relação capilar/fibra não foi significativamente diferente (B), enquanto pacientes com EM/SFC apresentaram uma relação capilar/fibra significativamente menor em comparação com pacientes com COVID longa e controles saudáveis. A densidade capilar (C) aumentou significativamente após o repouso no leito, enquanto pacientes com COVID longa e pacientes com EM/SFC apresentaram densidades capilares significativamente menores em comparação com controles saudáveis (D). A relação entre a área transversal da fibra (AFC) e a relação capilar/fibra correlacionou-se significativamente em todas as condições (embora P = 0,062 após o repouso no leito). A relação entre FCSA e razão capilar-fibra não foi significativamente diferente após repouso no leito (z = 0,495, P = 0,621), no entanto, em comparação com controles saudáveis, tanto os pacientes com COVID longa (z = – 2,176, P = 0,030) quanto os pacientes com EM (z = −2,602, P = 0,009) apresentaram relações significativamente diferentes (G). Os dados de densidade capilar e razão capilar-fibra foram distribuídos normalmente após a transformação de Box-Cox. Testes t pareados foram usados para avaliar dados paramétricos da coorte de repouso no leito. Dados não paramétricos da coorte de repouso no leito foram avaliados usando o teste U de Mann-Whitney. ANOVA, com teste post-hoc de Tukey HSD ou teste H de Kruskal-Wallis, com testes de Wilcoxon pareados com correção de Benjamini-Hochberg post-hoc para coortes de pacientes. As relações lineares foram avaliadas usando a correlação de Pearson em dados não transformados. Linhas sólidas representam correlações significativas, linhas tracejadas representam correlações com P<0,10.
Uma pré-publicação foi publicada na semana passada, a qual, acredito, lança uma grande luz sobre a compreensão do que é a doença/lesão da COVID Longa/Proteína de Espiga e como ela progride. Um estudo interessante foi conduzido. Um grupo de controles saudáveis recebeu repouso absoluto de 60 dias e suas propriedades musculares esqueléticas foram então comparadas com as de pessoas com COVID Longa e EM/SFC. Uma observação muito reveladora foi feita. Aqueles que tiveram COVID Longa e EM/SFC não sofreram atrofia muscular, mas apresentaram capilares reduzidos.
O repouso no leito causou atrofia muscular, e a redução da fosforilação oxidativa foi relacionada a reduções na captação máxima de oxigênio. Pacientes com COVID-19 prolongada e EM/SFC não apresentaram atrofia muscular, mas apresentaram menos capilares e mais fibras glicolíticas, fatores que não foram associados à captação máxima de oxigênio. Embora a capacidade aeróbica corporal total seja semelhante após o repouso no leito em comparação aos pacientes, as características do músculo esquelético diferiram, sugerindo que a inatividade física por si só não explica a menor capacidade de exercício em pacientes com COVID-19 prolongada e EM/SFC.
As propriedades do músculo esquelético em pacientes com COVID longa e ME/CFS diferem daquelas induzidas pelo repouso no leito
https://www.medrxiv.org/content/10.1101/2025.05.02.25326885v1.full-text
Isso me lembrou de um artigo que li sobre os cérebros de 36 autópsias de COVID. TODAS elas tinham vasos sanguíneos.
Todos os casos apresentavam muitos capilares atróficos ou regredidos (em forma de cordão), apresentando-se como tubos com lúmen estreito ou colapsado e geralmente vazio. Alguns canais microcirculatórios semelhantes, porém longos, podem ter sido derivações arteriolares pré-capilares ou vênulas pós-capilares, em vez de capilares (Fig. 3E). Na maioria dos casos, foram identificados capilares “fantasmas”, sem núcleos murais ou conteúdo luminal, e estes eram ocasionalmente frequentes, pelo menos focalmente.
Microvasculopatia inflamatória aguda e reativa em 36 cérebros de autópsia de COVID-19
https://europepmc.org/article/ppr/ppr489756
No contexto do que chamei de SPED (doença endotelial da proteína spike), isso faz todo o sentido. A criação de vasos em forma de corda — capilares cujo endotélio foi destruído.
O que é um vaso de cordas?
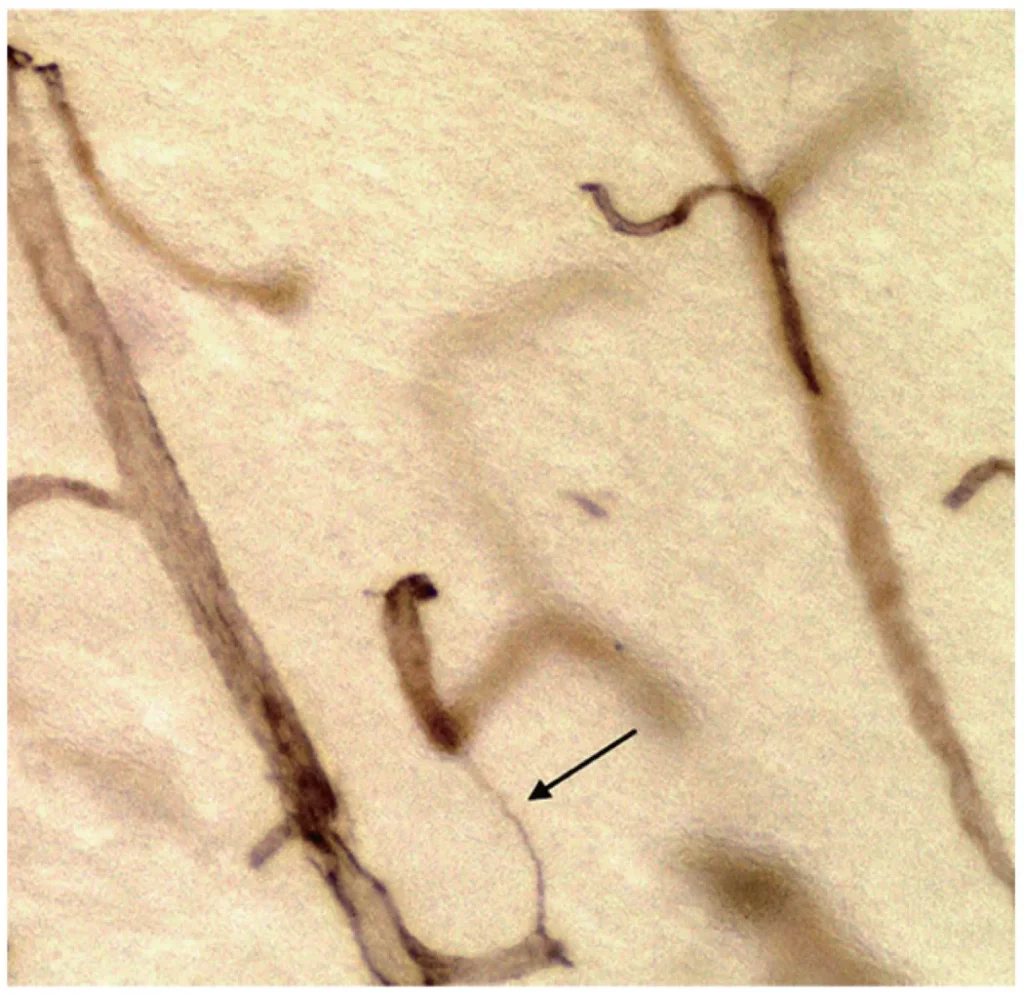
Vasos filamentosos são finos filamentos de tecido conjuntivo, remanescentes de capilares, sem células endoteliais; eles não conduzem o fluxo sanguíneo. Ocorrem em inúmeras espécies, particularmente no sistema nervoso central, mas podem ocorrer em qualquer tecido onde os capilares tenham morrido. Vasos filamentosos são frequentemente associados a patologias como doença de Alzheimer, isquemia e irradiação, mas também são encontrados em cérebros humanos normais, desde bebês prematuros até idosos.
Uma revisão de vasos de corda ou tubos de membrana de porão vazios e colapsados
https://pmc.ncbi.nlm.nih.gov/articles/PMC3081641/
Esse conhecimento, combinado com a compreensão de que o SARS-CoV-2 Mpro e a proteína Spike induzem vasos sanguíneos, pode explicar praticamente toda a COVID longa e a doença/lesão da proteína Spike.
A disfunção metabólica ou apoptose de BMECs também pode desempenhar um papel na interrupção da BHE durante a COVID-19. Vasos em cadeia são vasos sanguíneos colapsados, incapazes de fluxo sanguíneo, e estão associados à disfunção vascular durante doenças neurodegenerativas. A análise de tecido cerebral post-mortem de COVID-19 identificou aumento na formação de vasos em cadeia e apoptose vascular [54]. A investigação utilizando uma linhagem de células endoteliais in vitro e administração intravenosa de um vetor adenoviral em camundongos identificou a protease principal do SARS-CoV-2 (Mpro) como um potencial indutor da formação de vasos em cadeia. Mecanicamente, a adição de Mpro às células endoteliais degradou o modulador NFkB, Nemo, que induziu uma via apoptótica dependente da interação do receptor serina/treonina quinase 3 (RIPK3) [54]. A adição de proteína S às células endoteliais in vitro não causou alterações na viabilidade, mas induziu alterações morfológicas em direção a um estado contrátil, o que é um sinal de estresse celular, e inibiu a função mitocondrial em uma linhagem de células pericitas [55,56].
Neuroinflamação e COVID-19
https://www.sciencedirect.com/science/article/pii/S0959438822001027
Tudo isso está relacionado à Matriz Extracelular – ecoando minha observação anterior de que a Proteína Spike nos transforma em uma massa de “cartilagem viva”.
Foi demonstrado que os vasos sanguíneos em cordão começam como tubos vazios de membrana basal (BM), após a destruição das células endoteliais. Vários nomes para essas estruturas aparecem na literatura, portanto, uma tentativa de unificar a terminologia pode ser útil. Quando o capilar perde suas células endoteliais pela primeira vez, ele se torna um tubo de membrana basal vazio. Este nome claro e descritivo pode ser preferível a capilar acelular, porque tais tubos não transportam mais sangue. O tubo de membrana basal vazio logo colapsa em um cordão de colágeno, deixando um traço do capilar destruído. Nesse estágio, ele poderia muito bem ser descrito como um filamento de colágeno, mas o nome “vaso em cordão” talvez seja melhor porque acrescenta a informação de que esse filamento de colágeno é o remanescente de um vaso.
Uma revisão de vasos de corda ou tubos de membrana de porão vazios e colapsados
https://pmc.ncbi.nlm.nih.gov/articles/PMC3081641/
Vasos em corda são uma característica marcante tanto da DA quanto da DP. Assim como propus que encaremos a doença autoimune induzida pelo SARS-CoV-2/Proteína Spike não como o desenvolvimento de doenças discretas, mas como resultado da Ativação de Macrófagos, também devemos encarar o que acontece no cérebro (e em outros órgãos) das vítimas de forma diferente. Não é que o vírus e a proteína causem DA/DP, por exemplo, mas sim que eles destroem a microvasculatura.
Contexto: Vasos em cordão são membranas basais colapsadas, sem endotélio, e não têm função na circulação. A formação de vasos em cordão contribui para a degeneração vascular na doença de Alzheimer. Comparando com casos de controle pareados por idade, relatamos recentemente degeneração endotelial em capilares cerebrais de pacientes com doença de Parkinson (DP) humana.
Conclusões: A degeneração endotelial e a preservação da membrana basal resultam em aumento da formação de vasos em cordão na DP. Os dados podem sugerir um possível papel da hipoperfusão cerebral na degeneração neuronal característica da DP, o que necessita de mais investigação. A astrocitose elevada no núcleo caudado em casos de DP pode estar associada à ruptura da barreira hematoencefálica nessa região cerebral.
A formação de vasos sanguíneos é aumentada no cérebro de pessoas com doença de Parkinson
https://pubmed.ncbi.nlm.nih.gov/26444086/
Espero que essa compreensão nos ajude a encontrar terapias para lidar com esses problemas subjacentes causados pelo vírus e suas proteínas. Continuarei estudando e relatando minhas descobertas.
Fonte: https://wmcresearch.substack.com/p/microvascular-destruction-sars-cov