Bijay Bhandari, Gaurav Rayamajhi, Pratik Lamichhane, e Ashok K. Shenoy
Abstrato
Numerosas vacinas contra a COVID-19 estão sendo administradas a pessoas em todo o mundo. Eventos adversos após a imunização (EAPV) com vacinas contra a COVID-19 foram relatados por profissionais de saúde, bem como por órgãos de vigilância. Existe uma riqueza de informações sobre a eficácia e segurança das vacinas na literatura e o conhecimento neste setor está crescendo exponencialmente. Uma revisão narrativa da literatura foi realizada em fontes acessadas no PubMed, Google Scholar e Cochrane Review de março de 2021 a julho de 2021. Esta revisão tem como objetivo descrever EAPV associados às vacinas contra COVID-19 atualmente disponíveis, com ênfase na narração de prováveis EAPV, e em ajudar a uma melhor compreensão das vacinas contra a COVID-19.
1. Introdução
A pandemia da Doença do Coronavírus 2019 (COVID-19) afetou o mundo inteiro. Embora possa levar de 10 a 14 anos para que uma vacina seja desenvolvida, muitas vacinas COVID-19 surgiram neste período atípico de desenvolvimento clínico em alta velocidade. No entanto, o resultado esperado da vacina pode ofuscar os possíveis riscos. A aprovação das vacinas COVID-19 é um passo importante para mitigar o impacto devastador do COVID-19. No entanto, as vacinas podem não estar isentas de efeitos adversos que podem permanecer indetectáveis em ensaios clínicos, pelo que a avaliação, monitorização e vigilância dos efeitos adversos após a imunização (EAPV) são vitais.
De acordo com a Organização Mundial da Saúde (OMS), um EAPV é definido como “qualquer ocorrência médica desfavorável que se segue à imunização e que não tem necessariamente uma relação causal com o uso da vacina”. Os EAPV podem ser divididos em cinco grandes categorias:
- Relacionado ao produto da vacina: quando um componente da vacina é responsável por uma reação adversa
- Relacionado à qualidade da vacina: quando o evento está associado a um processo de fabricação: por exemplo, se um lote de vacinas for contaminado ou se um fabricante o colocar em seringas defeituosas
- Relacionado a erros de imunização: quando a reação é devida ao manuseio, prescrição ou administração inadequada da vacina: por exemplo, se for injetada na parte errada do corpo ou se a vacina congelar acidentalmente durante o transporte
- Relacionado ao estresse da imunização: quando o evento adverso é devido ao medo de ser injetado. Isso pode resultar em respostas físicas: como desmaios, tonturas, formigamento nas mãos ou ao redor da boca, vômitos ou até convulsões
- Coincidente: quando um evento adverso não tem relação direta com a vacina ou com qualquer um dos itens acima, mas ocorre logo após a vacinação e, portanto, pode ser atribuído a ela mesmo assim
Evento Adverso de Interesse Especial (AESI) é um evento clinicamente significativo pré-identificado e predefinido que tem o potencial de ser causalmente associado a um produto vacinal que precisa ser cuidadosamente monitorado e confirmado por estudos específicos adicionais. Os EAIE abrangem reações graves, bem como problemas graves, mas raramente fatais ou duradouros, como reações alérgicas ou convulsões. Um dos EAPV incomuns, porém graves, a anafilaxia é uma reação de hipersensibilidade tipo I mediada por IgE, que foi relatada em uma dose de vacina por milhão. Essas reações alérgicas podem ser devidas a ingredientes ativos (um componente viral ou microbiano no caso da vacina) ou excipientes utilizados na formulação da vacina, como conservantes, diluentes e tampões.
Através deste artigo, pretendemos rever os EAPV associados às vacinas contra a COVID-19 atualmente disponíveis, com o foco principal de narrar prováveis EAPV e ajudar no desenvolvimento de um perfil benefício-risco adequado das vacinas.
2. Métodos
Para acessar a literatura, foram utilizados mecanismos de busca, como Google Scholar, e bases de dados como PubMed e Cochrane Review. Entretanto, foram pesquisados websites oficiais, relatórios da OMS, da Aliança Global para a Iniciativa de Vacinas (GAVI), da Food and Drug Authority (FDA) e do Centro de Controlo de Doenças (CDC) para aceder a conteúdos relevantes. O primeiro artigo foi pesquisado em março de 2021, e a pesquisa bibliográfica foi realizada até julho de 2021. Todos os artigos relevantes encontrados foram organizados utilizando o gerenciador de referências Zotero 5.0.96.2.
Os artigos de interesse foram pesquisados utilizando operadores booleanos. Cada palavra sinônima foi separada por um operador booleano, “OR”, as frases foram colocadas entre aspas e grupos de palavras sinônimas foram colocados entre colchetes. Cada grupo sinônimo de duas ou mais palavras diferentes foi interligado pelo operador “AND”. Para uma extensa pesquisa no PubMed, foi utilizada a base de dados Medical Subject Heading (MeSH). Para esta revisão, consideramos relatórios da OMS, autoridades governamentais, sociedades profissionais, estudos observacionais, relatórios de farmacovigilância, estudos de caso e mais de 90 peças de literatura publicada em inglês. Estes relatos de EAPV associados às vacinas contra a COVID-19 foram extensivamente estudados para extrair conclusões importantes. As palavras-chave utilizadas para a busca na literatura foram “EAPV”, “efeito adverso”, “farmacovigilância”, “vacina COVID-19” ou qualquer combinação desses termos.
3. Descobertas
Para facilitar a compreensão deste artigo, classificamos as vacinas COVID-19 nas seguintes categorias.
3.1. Vacinas de mRNA
3.1.1. Vacina Pfizer-BioNTech COVID-19 (BNT162b2)
Os efeitos adversos mais comuns após a vacinação são sintomas semelhantes aos da gripe, como dor, fadiga, mialgia, dor de cabeça, calafrios, febre, dor nas articulações, náusea, espasmo muscular, sudorese, tontura, rubor, sensação de alívio, confusão mental, anorexia, inchaço localizado, diminuição da qualidade do sono, coceira, formigamento, diarréia, congestão nasal e palpitações. Embora reações graves, como linfadenopatia persistente grave ou prurido no local da injeção com duração superior a uma semana e dor (excluindo dor de cabeça, dores musculares e articulares) não sejam incomuns, efeitos como a paralisia de Bell são raros, com uma frequência variando de 1/10.000 a 1/1.000. Os efeitos adversos comuns foram mais pronunciados com a segunda dose, especialmente na faixa etária mais jovem (abaixo de 45 anos) e na população feminina. Os efeitos colaterais sistêmicos foram relatados por 13,5% e 22,0% dos indivíduos após a primeira e segunda doses da vacina, respectivamente. Da mesma forma, os efeitos adversos locais e sistêmicos foram maiores em indivíduos com histórico de infecção anterior por SARS-CoV-2. Além disso, de acordo com um estudo transversal randomizado realizado com 803 profissionais de saúde, 103 (12,83%) tiveram problemas temporários para realizar seu trabalho diário, 99 (12,33%) se afastaram do trabalho, 5 (0,62%) tiveram que procuraram serviço ambulatorial e 2 (0,25%) necessitaram de internação. O CDC identificou que entre 1.893.360 receptores da primeira dose da vacina Pfizer-BioNTech COVID-19, 83 (0,004%) pessoas relataram reações alérgicas não anafiláticas, enquanto 21 (0,001%) pessoas tiveram reações anafiláticas. Dos 21 receptores, 17 tinham histórico prévio de alergia a alimentos, medicamentos ou vacinas, como ARV e vacinas contra influenza.
3.1.2. Vacina Moderna COVID-19 (mRNA-1273)
Como a Moderna também é uma vacina de mRNA, os efeitos adversos habituais não graves são semelhantes aos da Pfizer-BioNTech, sendo a fadiga o mais comum. Os efeitos adversos da vacina Moderna também foram mais intensificados após a segunda dose. Em um estudo com 4.041.396 receptores da primeira dose da vacina Moderna, 43 (0,001%) relataram reações alérgicas não anafiláticas, enquanto 10 (0,0002%) mulheres tiveram reações anafiláticas, com um tempo médio de 30 minutos desde o recebimento da vacina até o início de reação. Em cada dez, cinco indivíduos tinham histórico de alergia a substâncias como penicilina, contraste intravenoso e iodo. Braço dolorido, mialgia, dor nas articulações, náusea, confusão/nebulização cerebral foram alguns dos efeitos adversos comuns observados entre os receptores da vacina nos Estados Unidos.
3.2. Vacinas de vetores virais
3.2.1. Vacina Oxford-AstraZeneca/Covishield contra COVID-19 (ChAdOx1 nCoV-19)
Os efeitos adversos comuns geralmente observados após a vacinação com a vacina Oxford/AstraZeneca COVID-19 são dor no local da injeção, sensação de febre, dor muscular e dor de cabeça. Descobriu-se que essas reações são menos prevalentes em receptores com mais de 70 anos de idade em comparação com aqueles com menos de 55 anos de idade. Cerca de 33,7% e 58,7% dos receptores da vacina desenvolveram efeitos adversos sistêmicos e locais, respectivamente, após a primeira dose da vacina.
Sah et al. relataram que os receptores no Nepal desenvolveram dor de cabeça leve e tontura 30 minutos após receberem a primeira dose de ChAdOx1 nCoV-19 (Covishield): uma formulação da vacina Oxford/AstraZeneca COVID-19 fabricada pelo Serum Institute of India Private Limited. Alguns dos receptores da vacina queixaram-se de irritabilidade quatro horas após a vacinação, enquanto outros queixaram-se de mialgia, náuseas, sensibilidade no local da injeção e febre com arrepios após 6-12 horas da vacinação, que foram resolvidas com a ingestão de paracetamol. Do segundo ao terceiro dia, os sintomas foram parcialmente resolvidos.
Shrestha et al. do Nepal relataram que, além dos EAPV comuns, foram notificados três EAPV graves. O primeiro caso apresentou cólicas abdominais, fezes moles, queda postural da pressão arterial e ataque de síncope; o segundo com cólicas abdominais e queda postural da pressão arterial; e o terceiro com urticária e episódio de síncope. Adhikari et al. relataram efeitos colaterais relacionados ao local da injeção como os EAPV mais comuns, mais prevalentes na faixa etária abaixo de 30 anos, com um valor de p de 0,007 (significativo em p <0,05). Curiosamente, Madhi et al. descreveram os únicos eventos adversos graves observados nos receptores da vacina Oxford AstraZeneca COVID-19 como febre acima de 40 graus Celsius, que cedeu em 24 horas.
3.2.2. Vacina Janssen COVID-19 (Ad26.COV2-S [Recombinante])
Dor no local da injeção, dor de cabeça, fadiga, dor muscular e náusea são os efeitos adversos comuns relatados após a vacinação da vacina Janssen COVID-19, que são autolimitados dentro de um ou dois dias. Na vacinação em massa da Janssen realizada nos EUA, de 8.624 receptores, foram detectados 64 (0,74%) casos de aglomerados de ansiedade associados a taquicardia, hiperventilação, dispneia, dor no peito, parestesia, tontura, hipotensão, dor de cabeça, palidez. Junto com estes, foram relatados 17 (0,20%) casos de síncope. Seis casos suspeitos de distúrbio de coagulação foram relatados após a vacinação da vacina Janssen COVID-19 entre sete milhões de receptores, com a causa ainda sob investigação.
3.2.3. Vacina Gamaleya-Sputnik V contra COVID-19
Os efeitos colaterais comuns pós-vacinação incluem síndrome semelhante à gripe caracterizada por calafrios, febre, artralgia, mialgia, astenia, desconforto geral, dor de cabeça e reações locais como sensibilidade no local da injeção, hiperemia e inchaço. Os EAPV foram mais comuns em pessoas com menos de 55 anos (72,8% vs. 32%; risco de perigo = 2,66) e no sexo feminino (65,4% vs. 50%; risco de perigo = 1,38). O EAPV pareceu ser mais intenso com a segunda dose em comparação com a primeira. Nenhum evento adverso grave foi relatado na fase I/II do estudo de segurança e imunogenicidade do Sputnik V.
3.3. Vacinas Inativadas
Verocell, CoronaVac e Covaxin são as vacinas inativadas que estão sendo implementadas em vários países. Segundo estudo realizado na China, a prevalência de efeitos adversos em profissionais de saúde pós-vacinação foi de 15,6% e 14,6% após a primeira e segunda dose, respectivamente. O mais comum é a dor no local da injeção, seguida de fadiga, dores musculares e dor de cabeça. Também foram relatados dois casos de esclerose múltipla e êmese de Grau III após a administração da vacina, sendo que ambos exigiram hospitalização.
3.3.1. Vacina Sinopharm-Verocell COVID-19
Os EAPV locais mais comuns são dor no local da injeção, enquanto os EAPV sistêmicos são dor de cabeça, febre, fadiga, mialgia, artralgia, tosse, dispneia, náusea, diarreia e prurido. Aryal et al. do Nepal descreveram EAPV leves a moderados com a vacina Sinopharm-Verocell COVID-19. Os EAPV foram mais comuns após a toma da primeira dose da vacina em comparação com a segunda dose. Nenhum evento adverso grave foi relatado.
3.3.2. Vacina Sinovac-CoronaVac COVID-19
Um estudo de Riad et al. relataram os efeitos adversos mais comuns pós-vacinação como dor no local da injeção, fadiga, dor de cabeça, mialgia e artralgia, com maior incidência de sintomas em mulheres em p <0,001. Alguns dos EAPV observados com a vacina foram um caso de reação de hipersensibilidade grave com urticária 48 horas após a primeira dose e três casos de tireoidite subaguda pós-imunização.
3.3.3. Vacina Covaxin COVID-19
Após a administração de Covaxin, os efeitos adversos mais comuns relatados são dor no local da injeção, dor de cabeça, fadiga, febre, náusea e vômito. Nenhum efeito adverso grave foi relatado até agora.
4. Comparação de EAPV de vacinas contra a COVID-19 disponíveis
4.1. Vacinas Pfizer vs. Moderna COVID-19
Um estudo comparativo entre as vacinas Pfizer-BioNTech e Moderna COVID-19 concluiu que ambas foram responsáveis por causar efeitos adversos. No entanto, a vacina Moderna provavelmente causaria mais efeitos adversos, como inchaço facial e paralisia de Bell, especialmente após a segunda dose. Em outro relatório do Vaccine Adverse Event Reporting System (VAERS), a incidência de reações anafiláticas na vacina Moderna e na vacina Pfizer-BioNTech foi de 3/1.000.000 e 5/1.000.000, respectivamente.
4.2. Vacinas Pfizer-BioNTech vs. Oxford-AstraZeneca
Num estudo entre profissionais de saúde na Coreia do Sul, a taxa global de reações adversas foi de 93% no grupo Pfizer-BioNTech e 80% no grupo Oxford-AstraZeneca ( p < 0,001). As reações sistêmicas como febre, calafrios, dores musculares, dores nas articulações, dores de cabeça, tonturas e fadiga foram maiores em 30% ou mais no grupo Oxford-AstraZeneca em comparação com o grupo Pfizer-BioNTech. Da mesma forma, manifestações neurológicas e reações alérgicas foram significativamente mais comuns no grupo Oxford-AstraZeneca ( p <0,001). A incidência de anafilaxia rara foi associada a 0,63% dos receptores das vacinas Pfizer-BioNTech COVID-19, enquanto a da vacina Oxford AstraZeneca COVID-19 foi de 0,3%, sendo a maioria pertencente à anemia hemolítica.
4.3. Vacinas Pfizer-BioNTech vs. Moderna vs. Oxford-AstraZeneca
No estudo da Public Health Ontario, Canadá, foram observados 5.140 (0,045%) EAPV de um total de 11.212.134 vacinados. Dentre esses receptores, 207 (0,002%) tiveram EAPV graves; 102 (49,28%) de 207 eram receptores da vacina Pfizer-BioNTech COVID-19, 31 (18,84%) eram receptores da Moderna e os 74 restantes (35,75%) eram da coorte Oxford-AstraZeneca. Os efeitos locais e sistêmicos parecem ser mais prevalentes nas vacinas de mRNA (84,2%, 54,9%) e de vetor de adenovírus (88%, 86%) em comparação com vacinas inativadas (12% -18%, 4% -18%).
5. EAAV baseado em sistema
5.1. EAPV relacionados a complicações neurológicas
Dor de cabeça, tontura, parestesia e espasmos musculares são EAPV neurológicos menores associados à vacinação contra COVID-19. No entanto, casos menores de tremores, diplopia, zumbido, disfonia, convulsões e reativação do Herpes zoster também foram evidentes. De acordo com o VAERS do CDC, 17 casos de acidente vascular cerebral, 32 casos de síndrome de Guillain-Barré, 190 casos de paralisia facial, 6 casos de encefalomielite disseminada e 9 casos de mielite transversa foram relatados após Pfizer-BioNTech, Moderna e Johnson and Johnson’s COVID -19 vacinação.
Um estudo realizado no México por Garcia-Grimshaw et al. descobriram que, de todos os 6.536 EAPV, 4.258 (65,1%) estavam relacionados a manifestações neurológicas leves, como dor de cabeça, sintomas sensoriais transitórios e fraqueza, enquanto 17 (0,26%) casos apresentaram EAPV relacionados a eventos adversos neurológicos graves. O estudo concluiu que os benefícios da vacina superam o risco e é por isso que ela foi considerada segura. Houve um caso relatado de mielite na Índia associado à vacina Oxford-AstraZeneca Covishield em um homem de 36 anos no 8º dia após a vacinação. Da mesma forma, três casos (1,71%) de mielite transversa (de 175 eventos adversos graves) foram relatados após a vacinação Oxford-AstraZeneca Covishield, dos quais um ocorre após a segunda dose da vacina.
Vários casos de paralisia do nervo facial foram relatados após a vacinação Pfizer-BioNTech, semelhante ao observado na imunização contra gripe, hepatite B, poliomielite e DPT. Isto é provavelmente causado por adjuvantes aditivos que provocam uma resposta imunomoduladora. Globalmente, a avaliação dos resultados preliminares de várias vacinas contra a COVID-19 mostrou que os efeitos neurológicos devidos à vacina são raros. No entanto, a vacina precisa de monitoramento de longo prazo para compreender completamente se a vacina desencadeia algum problema neurológico.
5.2. EAPV relacionados a complicações cardiovasculares e hematológicas
As vacinas Oxford-AstraZeneca COVID-19 mostraram alguns casos de distúrbios de coagulação sanguínea. Um homem de 69 anos queixou-se de hematomas avermelhados no pulso após a primeira dose da vacina Pfizer-BioNTech COVID-19. Os laudos laboratoriais mostraram prolongamento do tempo de tromboplastina parcial ativada e presença de inibidor do fator VIII. Poucos relatórios estão disponíveis de que a Hemofilia A Adquirida (AHA) seja plausível com o uso de vacinas em geral ou mesmo com vacinas COVID-19.
Da mesma forma, um único caso (0,0023%) de arritmia ventricular paroxística foi identificado entre os 43.252 participantes de um ensaio que receberam uma dose única da vacina Pfizer-BioNTech COVID-19. Palpitações (35, 8,1%), alterações na pressão arterial (8, 1,85%), dor no peito (8, 1,85%) e síncope (4, 0,93%) são efeitos cardiovasculares comuns observados entre os receptores de Moderna.
Uma mulher de 82 anos apareceu com uma erupção cutânea petequial nas extremidades inferiores 10 horas após o relato da vacinação CoronaVac. Da mesma forma, um jovem de 22 anos, aparentemente saudável, apresentou petéquias generalizadas e sangramento gengival após receber a vacina Pfizer-BioNTech contra a COVID-19. O teste de laboratório mostrou uma contagem de plaquetas de 2 X 10 9 /L, que foi diagnosticada como trombocitopenia grave. Vinte casos de trombocitopenia foram hospitalizados após a vacinação Moderna e Pfizer; dos quais, 17 não tinham histórico prévio de distúrbio hemorrágico, conforme relatado pelo CDC, FDA, Departamento de Saúde e Serviços Humanos (HHS), VAERS. A incidência de trombocitopenia imune pró-trombótica induzida por vacina varia de 1/26.000 a 1/127.000 doses da vacina ChAdOx1 nCoV-19 AstraZeneca/Covishield.
Foi relatado um caso de trombose do seio venoso central associada à trombocitopenia em um homem caucasiano de 50 anos, 10 dias após tomar a primeira dose da vacina Oxford-AstraZeneca. Como a própria infecção por COVID-19 está associada à hipercoagulabilidade, tais condições de tromboembolismo não podem ser negligenciadas. Um evento relatado de dor aguda na panturrilha direita após 48 horas da segunda dose da vacinação Pfizer-BioNTech COVID-19 estava disponível. O Doppler colorido revelou trombose venosa profunda que se estende da veia fibular até a veia poplítea no paciente.
Vários países europeus como Dinamarca, Áustria, Noruega e Itália suspenderam o uso da vacina Oxford AstraZeneca COVID-19 a partir de 11 de março de 2021, pois foram observadas trombose múltipla e embolia pulmonar após a primeira dose da vacina. Entre 54.571 reações adversas pós-vacinação contra a COVID-19 da Oxford AstraZeneca na base de dados EudraVigilance, 28 destas reações foram associadas a efeitos adversos trombóticos, das quais três mortes foram relacionadas com embolia pulmonar e uma com trombose. A incidência de tais eventos parecia ser quase o dobro nas mulheres. Além disso, 11 pacientes que tomaram a vacina AstraZeneca COVID-19 da Alemanha e da Áustria apresentaram um ou mais eventos trombóticos: 9 tiveram trombose venosa cerebral, 3 tiveram trombose venosa esplâncnica, 3 tiveram embolia pulmonar e 4 tiveram outras tromboses. Seis desses pacientes morreram e cinco tiveram coagulação intravascular disseminada. O mecanismo exato desta incidência significativa em mulheres não é bem compreendido, mas foi postulado que altos níveis de estradiol estão associados a eventos trombóticos. Enquanto isso, o risco de trombose venosa cerebral é 8 vezes maior na população com histórico de COVID-19 em comparação com os receptores da vacina Oxford Astrazeneca COVID-19.
O Centro Russo Gamaleya declarou: “uma análise abrangente de eventos adversos durante os ensaios clínicos e durante as vacinações em massa com a vacina Sputnik V não mostrou casos de trombose do seio venoso cerebral”. No entanto, a ocorrência de púrpura trombocitopênica imune (PTI) é de 3,3 por 1.00.000 anualmente. Os casos de PTI após a vacina também podem ser coincidentes. Uma riqueza de estudos demonstrou a associação entre ITP e vacinas contra influenza, portanto este aspecto não pode ser completamente ignorado.
De acordo com o Vigibase, foram notificados até agora 214 relatos de miocardite relacionada à vacina COVID-19. A miocardite foi observada mais em homens, com idade mediana de 35 anos, numa mediana de 3 dias após tomar a última dose da vacina Pfizer ou Moderna. Estavam disponíveis dados suficientes para apoiar a evidência de que 23 casos eram definitivos, 16 eram prováveis e 46 eram possíveis miocardite associada à vacina.
Uma análise conjunta de estudos de casos e séries de casos mostrou que 15 pacientes apresentaram miocardite após a vacinação contra COVID-19. Mais de 90% desses pacientes eram do sexo masculino e tinham idade média de 28 anos. Sessenta por cento dos casos estavam associados à vacina Pfizer-BioNTech, 33% à Moderna e 7% à vacina Jansen. Todos os casos relacionados à vacina Moderna ocorreram após a segunda dose da vacina, enquanto 66,7% dos casos pós-vacinação da Pfizer foram observados após a segunda dose. Da análise geral, os pontos finais são os seguintes:
- Maioritariamente saudáveis, os homens jovens são afetados após a segunda dose da vacina
- O EAPV está principalmente associado à vacina de mRNA
- Todos os casos retornaram à boa saúde sem perda da função cardíaca
5.3. EAPV Associados às Manifestações Orofaciais
Foi realizado um estudo para estudar os efeitos adversos orofaciais em receptores das vacinas Pfizer-BioNTech e Moderna COVID-19 na América do Norte (EUA e Canadá) e na Europa (Reino Unido e UE). Foi observada heterogeneidade nos efeitos adversos orofaciais entre os receptores de vacina norte-americanos e europeus. O inchaço dos lábios, face ou língua associado à anafilaxia era comum entre os norte-americanos, enquanto a paralisia facial periférica aguda (paralisia de Bell) era mais comum entre os europeus. A incidência de paralisia facial aguda foi maior em pessoas com histórico de injeção de preenchimentos dermatológicos .
5.4. EAPV Associados a Manifestações Dermatológicas
Há relatos de efeitos adversos cutâneos semelhantes à pustulose exantemática generalizada aguda e reação medicamentosa com eosinofilia e sintomas sistêmicos (AGEP-DRESS) sobreposição e erupções morbiliformes, urticariformes, petequiais, variceliformes, vasculopatias e semelhantes a frieiras após as vacinas Janssen COVID-19. Por outro lado, um homem de 60 anos, caso conhecido de hipertensão e diabetes mellitus tipo II, apresentou lesões cheias de líquido na coxa quatro dias após a vacina Covaxin COVID-19, que mais tarde foi diagnosticada como herpes zóster. Uma apresentação clínica semelhante foi relatada em um homem de 78 anos com histórico de múltiplas comorbidades cardiovasculares e câncer de bexiga. Ele foi consultado por lesões eritematosas, dolorosas e pruriginosas no peito, 5 dias após tomar a vacina inativada COVID-19, que também foi diagnosticada como herpes zoster.
Uma erupção dermatomal herpetiforme unilateral, gravemente dolorosa, foi observada em um homem de 77 anos, dois dias após receber a primeira dose da vacina Moderna COVID-19. Da mesma forma, outro caso de erupções cutâneas dolorosas, eritematosas e agrupadas foi observado em um homem de 65 anos, após a segunda dose da vacina da Pfizer, que tinha histórico de episódio de herpes zoster há 35 anos. Vinte desses casos de herpes foram relatados em Las Vegas entre os receptores das vacinas Pfizer-BioNTech e Moderna.
De acordo com o FDA, a vacina Moderna COVID-19 é capaz de causar reações como inchaço facial e labial em pacientes com histórico de preenchimentos dérmicos. Foram relatados dois casos de receptores que desenvolveram lesões acrais semelhantes a frieiras sete dias após a vacinação com CoronaVac .
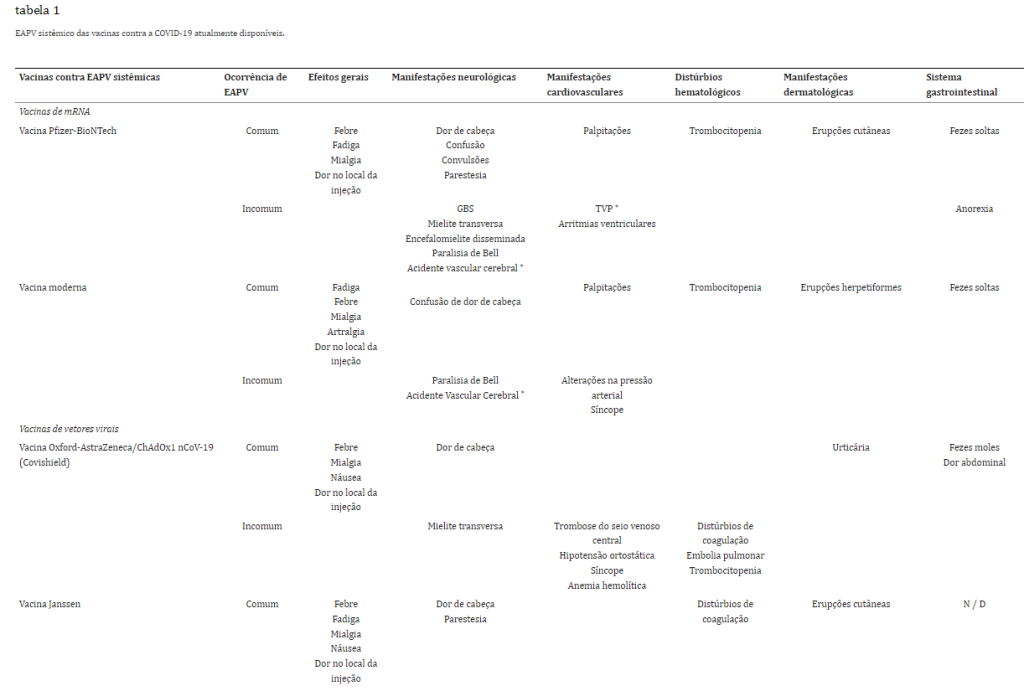
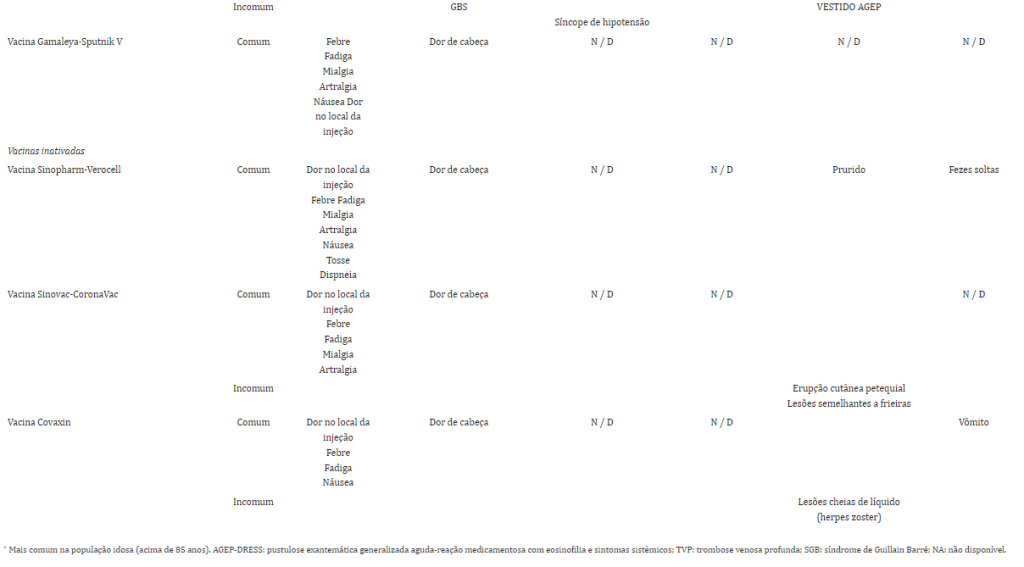
Para efeitos de melhor compreensão dos EAPV das vacinas contra a COVID-19 baseados no sistema, os efeitos adversos estão resumidos em tabela 1.
6. EAPV em Populações Especiais
6.1. EAPV na gravidez após vacinação contra COVID-19
Alguns estudos não apenas excluíram mulheres grávidas dos estudos de imunização, mas também as aconselharam a optar pela contracepção durante semanas a meses a partir do dia da imunização. Inicialmente, as mães grávidas e lactantes foram excluídas do estudo de segurança das vacinas contra a COVID-19. Portanto, o FDA dos EUA e o Comitê Consultivo sobre Práticas de Imunização declararam que as mulheres grávidas e lactantes tiveram a opção aberta de tomar vacinas.
Recentemente, o Royal College of Obstetricians and Gynecologists (RCOG) declarou que os efeitos adversos menores após a vacinação são semelhantes em populações grávidas e não grávidas. No entanto, as mulheres grávidas apresentaram maior frequência de náuseas e vômitos após a segunda dose das vacinas Pfizer-BioNTech e Moderna COVID-19. Da mesma forma, o Colégio Americano de Obstetras e Ginecologistas (ACOG) recomenda vacinas COVID-19 para a população grávida. De acordo com o registro de gravidez segura do CDC V, entre 1.815 participantes grávidas inscritas até 19 de fevereiro de 2021 no programa de vacinação, 232 nascidos vivos nasceram em 275 gestações concluídas. Outros casos incluíram aborto espontâneo (grave), nado-morto e gravidez ectópica.
Com dados limitados até ao momento, não existem provas suficientes para determinar se as vacinas contra a COVID-19 têm uma ação benéfica ou prejudicial em mulheres grávidas. Considerando a relação risco-benefício, diferentes organismos profissionais, como o RCOG e o ACOG, recomendam a utilização de vacinas contra a COVID-19.
6.2. EAPV em idosos após vacinação contra COVID-19
A importância da vacinação contra a COVID-19 nos idosos é vital, uma vez que o risco de doença grave causada pela COVID-19 aumenta com a idade. Assim, o CDC recomenda a vacinação contra COVID-19 entre a população idosa. A proporção de efeitos secundários ligeiros nos idosos foi semelhante à de outras populações adultas. O processo de aprendizagem sobre a eficácia das vacinas COVID-19 em pessoas com sistema imunológico enfraquecido ainda está em andamento.
7. Considerações Especiais
7.1. EAPV associados a excipientes e formulações
As reações alérgicas podem ser provocadas por ingredientes ativos (um componente microbiano ou viral) ou por excipientes da vacina. Traços de RNA modificados e truncados podem estar presentes nas vacinas Pfizer-BioNTech COVID-19, e essas proteínas aberrantes têm uma chance mínima de provocar reações alérgicas. A vacina Sputnik V COVID-19 está disponível em duas formas: congelada e liofilizada, sendo que a congelada apresenta alta incidência de hipertermia, dor de cabeça e dores musculares/articulares. Apesar disso, não há evidências de quaisquer eventos adversos graves. O constituinte ativo da vacina nem sempre é responsável por provocar reações adversas. Por exemplo, descobriu-se que o polietilenoglicol (PEG), um dos excipientes das vacinas Pfizer-BioNTech e Moderna COVID-19, induziu reações alérgicas mediadas por IgE. Embora as vacinas Oxford AstraZeneca e Janssen COVID-19 contenham polissorbato 80, não foram observadas reações alérgicas a estas vacinas. Pessoas alérgicas ao PEG também podem apresentar reatividade cruzada aos análogos do PEG (por exemplo, polissorbato), que devem ser sistematicamente identificados para evitar as chances de possíveis reações alérgicas. Pacientes sensíveis ao látex podem apresentar reações anafiláticas. Assim, mesmo os êmbolos das seringas e as rolhas dos frascos podem desencadear tais reações.
7.2. EASI após vacinas contra a COVID-19
Do estudo realizado em oito países, a incidência de AVC não hemorrágico, enfarte agudo do miocárdio e trombose venosa profunda foram comuns em pessoas com mais de 85 anos de idade. A incidência de infarto agudo do miocárdio variou de 1/10 a 1/100.
7.3. EAPV associados à mortalidade
Dos 40.000 pacientes idosos, 30 pacientes muito frágeis faleceram após a vacinação da Pfizer-BioNTech na Noruega. Esta informação questiona a segurança da vacina Pfizer-BioNTech COVID-19 em idosos e pacientes gravemente enfermos. Quatro mortes que atendem à definição de vigilância provincial foram relatadas após a vacinação em Ontário até 12 de junho de 2021. No entanto, apenas uma morte foi relatada devido à trombocitopenia trombótica imune induzida pela vacina (VITT) e à síndrome de trombose com trombocitopenia (TTS). Os casos restantes foram declarados como não relacionados à vacina. Um homem de 68 anos que morreu após anafilaxia grave foi confirmado como a primeira mortalidade pós-vacinação ChAdOx1 nCoV-19 (Covishield) pelas autoridades governamentais da Índia.
8. Abordagem aos EAPV das vacinas contra a COVID-19
A Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) declarou que “qualquer pessoa com histórico de anafilaxia a uma vacina, medicamento ou alimento não deve receber a vacina Pfizer/BioNTech”. No entanto, em 30 de dezembro de 2020, a MHRA revisou sua declaração de que as pessoas que apresentavam tais reações nunca foram impedidas de receber a vacina. A avaliação alergológica adequada ajuda a minimizar quaisquer reações de hipersensibilidade imediata. Portanto, a abordagem sensata seria perguntar se os receptores da vacina têm algum histórico prévio de alergia a alimentos, medicamentos ou vacinas. Havendo histórico positivo, as pessoas suscetíveis devem ser acompanhadas por especialista, para que a vacinação possa ser realizada em ambiente bem preparado. Procedimentos expandidos de testes cutâneos (teste cutâneo de picada e intradérmico) com diferentes diluições de PEG para descartar alergia ao PEG são outra maneira de evitar possível anafilaxia. Pacientes com testes cutâneos negativos devem ser mantidos sob observação por 15 minutos após a vacinação, enquanto aqueles com teste positivo podem necessitar de 30 minutos de observação para avaliar quaisquer eventos adversos.
Em pessoas que apresentam reações alérgicas ao PEG presente nas vacinas Pfizer-BioNTech e Moderna contra a COVID-19, deve ser testada a alergenicidade cruzada a outros análogos do PEG. Se for negativo, a vacina Oxford AstraZeneca COVID-19 pode ser considerada uma alternativa. No entanto, a abordagem mais segura seria o uso de estabilizadores neutros, como a polivinilpirrolidona ou seus derivados, que apresentam um excelente histórico de segurança. Os médicos de emergência devem considerar a PTI devido à vacinação entre pessoas que apresentam manifestações hemorrágicas. Enquanto isso, os dermatologistas podem participar ativamente na identificação de manifestações dermatológicas pós-vacinação e contribuir para o rastreamento de possíveis reações adversas.
Devido ao rápido desenvolvimento das vacinas contra a COVID-19, o medo da sua segurança entre os profissionais de saúde e o público levou à hesitação em vacinar. O medo das vacinas contra a COVID-19 e a hesitação vacinal que se segue podem ter um impacto negativo nas imunizações regulares. A comunicação aberta e a sensibilização do público sobre as vacinas contra a COVID-19 devem ser mantidas para minimizar a relutância pública e melhorar a aceitação da vacina a nível mundial.
9. Conclusão
Indivíduos alérgicos não podem ser excluídos da vacinação. Como os EAPV com casos graves de mortalidade são muito raros, a vacinação deve ser incentivada, uma vez que ajuda a prevenir uma doença potencialmente mortal. Além disso, os profissionais de saúde devem esclarecer os equívocos sobre as vacinas contra a COVID-19 entre os beneficiários. Se for observado qualquer evento infeliz de anafilaxia, o paciente deve ser transferido para receber cuidados médicos apropriados, enquanto os médicos devem estar vigilantes para reconhecer, gerenciar e relatar o mesmo.
EVENTOS ADVERSOS APÓS IMUNIZAÇÃO COM VACINAS COVID-19 UMA REVISÃO NARRATIVA