Além de serem pró-amiloidogênicos, os macrófagos podem estar aumentando significativamente as propriedades amiloidogênicas da proteína Spike.
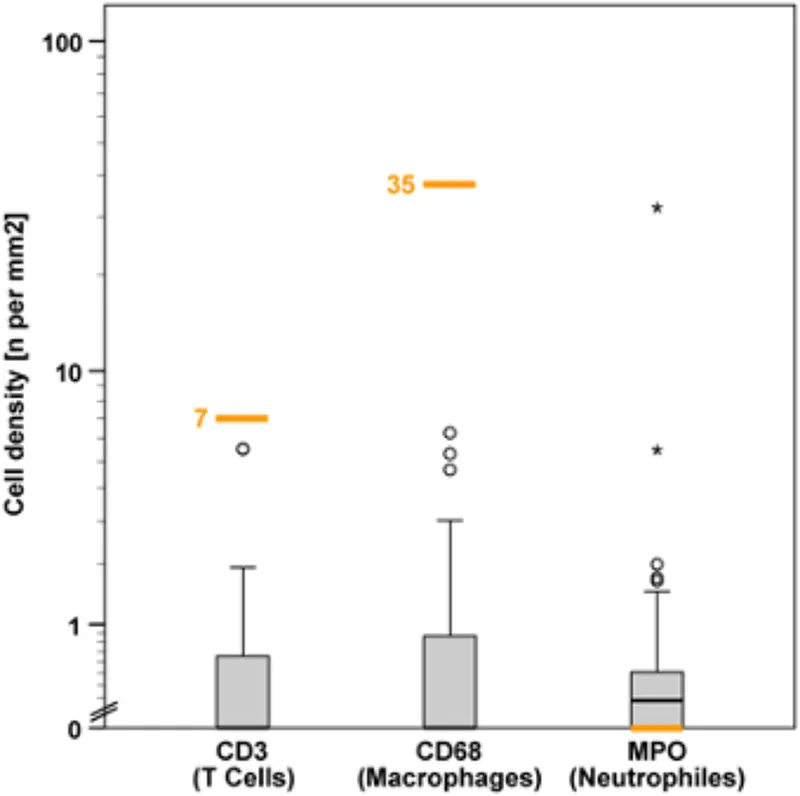
Valores de densidade de células inflamatórias no miocárdio em pacientes com amiloidose cardíaca. Representação gráfica da distribuição dos valores de densidade de linfócitos T (células CD3-positivas), macrófagos (células CD-68-positivas) e neutrófilos (células MPO-positivas) em um eixo logarítmico Y, com os valores limiares correspondentes marcados (linha laranja), que representam os limites para inflamação (números laranja) (Dominguez et al., 2016). O valor limiar para neutrófilos foi representado como 0. Os valores representados individualmente como círculos ou asteriscos denotam valores discrepantes ou extremos.
Meu estudo sobre o envolvimento da Proteína Spike na indução de uma doença crônica de ativação de macrófagos continua. É quase certo que, após a COVID e após a exposição à Proteína Spike, os macrófagos ativados resultantes estejam induzindo amiloidose. Isso independe da capacidade da Proteína Spike de induzir amiloidose por si só. Macrófagos ativados e Proteínas Spike “trabalhando juntos”, no entanto, são, de fato, um assunto bastante sério.
Agora está bem estabelecido que a proteína Spike e outras proteínas do SARS-CoV-2 são proteínas amiloidogênicas.
Em seguida, estudamos a agregação in vitro de proteínas e regiões proteicas do SARS-CoV e SARS-CoV-2 com propensão prevista à agregação, incluindo o peptídeo da sequência sinal e os peptídeos de fusão 1 e 2 da proteína spike, um peptídeo da proteína NSP6 e as proteínas ORF10 e NSP11. Nossos resultados mostram que esses peptídeos e proteínas podem formar agregados amiloides.
Proteínas amiloidogênicas nos proteomas SARS-CoV e SARS-CoV-2
https://www.nature.com/articles/s41467-023-36234-4
E sabe-se que a amiloidose está ocorrendo após a COVID e após a exposição à proteína Spike.
Embora a COVID-19 seja reconhecida principalmente como uma doença respiratória, desde então tem sido observada uma série de manifestações extrapulmonares, muitas das quais são observadas em pacientes com amiloidose. Estas incluem características de estresse oxidativo, inflamação crônica e riscos trombóticos. É bem sabido que doenças virais têm sido associadas ao desencadeamento de condições autoimunes, das quais a amiloidose não é exceção. Nos últimos meses, foram publicados relatos de novos casos e recidivas da doença após infecção e vacinação por COVID-19.
Infecção e vacinação contra COVID-19 e sua relação com a amiloidose: o que sabemos atualmente?
https://pmc.ncbi.nlm.nih.gov/articles/PMC10383215/
Agora, é importante entender que os macrófagos M1 contribuem para a amiloidose (fibrilogênese).
A amiloidose AA pertence ao grupo de doenças amiloides que podem ocorrer após condições inflamatórias crônicas de várias origens. A doença é caracterizada pela deposição de fibrilas amiloides insolúveis formadas pela amiloide A1 sérica (SAA1), levando eventualmente à falência de órgãos. Os macrófagos estão intimamente envolvidos na fibrilogênese, bem como na depuração de fibrilas amiloides. In vivo, os macrófagos podem ocorrer como macrófagos clássicos (M1) ou alternativamente ativados (M2). Investigamos aqui como a SAA1 pode afetar o fenótipo e a função dos macrófagos. A análise de microarranjos genéticos revelou a regulação positiva de 64 genes associados a M1 pela SAA1. A polarização semelhante à de M1 foi confirmada pela expressão do marcador M1 MARCO, ativação do fator de transcrição NF-κB e secreção das citocinas M1 TNF-α, IL-6 e MCP-1. Além disso, demonstramos aqui que macrófagos polarizados em M1 apresentam atividade fibrilogênica aumentada em relação à SAA1. Com base em nossos dados, propomos a reconsideração dos modelos de amiloidose celular atualmente utilizados em direção a um modelo in vitro empregando macrófagos polarizados em M1.
A amiloide A1 sérica induz macrófagos classicamente ativados: um papel para a formação aprimorada de fibrilas
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.691155/full
Por que isso é importante? Porque, assim como o amiloide A1 sérico, a proteína Spike também induz macrófagos M1 via TLR4.
O TLR4 é um importante receptor imune inato que reconhece LPS bacterianos, proteínas virais e outros padrões moleculares associados a patógenos (PAMPs). Ele é expresso em células residentes em tecidos e imunes. Anteriormente, propusemos um modelo no qual a ativação do TLR4 pelo SARS-CoV-2, por meio de seu domínio S1 da glicoproteína spike, aumenta a expressão da ECA2, as cargas virais e a hiperinflamação na doença COVID-19 [1]. Aqui, testamos essa hipótese in vitro e demonstramos que o domínio S1 da spike do SARS-CoV-2 é um agonista do TLR4 em células de ratos e humanas e induz um fenótipo pró-inflamatório de macrófagos M1 em macrófagos derivados de monócitos THP-1 humanos.
A glicoproteína Spike S1 do SARS-CoV-2 é um agonista do TLR4, aumenta a expressão da ECA2 e induz a polarização pró-inflamatória dos macrófagos M1.
https://www.biorxiv.org/content/10.1101/2021.08.11.455921v1.full.pdf
Portanto, a Proteína Spike não só possui propriedades amiloidogênicas, como também induz os macrófagos a se polarizarem para um estado M1 pró-inflamatório, o que aumenta a formação de fibrilas. Isso pode ajudar a explicar grande parte da amiloidose que está sendo diagnosticada de forma desenfreada e também pode ser um fator significativo na detecção de coágulos fibrosos após a COVID e após a exposição à Proteína Spike.
Fonte: https://wmcresearch.substack.com/p/macrophages-and-post-covidspike-protein