Matrizes de sensores ativos de grafeno para mapeamento de longo prazo e sem fio da atividade cerebral epicórtica de ampla banda de frequência
Abstrato
Sensores ativos de grafeno demonstraram capacidades promissoras para a detecção de sinais eletrofisiológicos no cérebro. Suas propriedades funcionais, juntamente com sua flexibilidade, bem como sua estabilidade e biocompatibilidade esperadas, os elevaram como um alicerce promissor para interfaces neurais de detecção em larga escala. No entanto, a fim de fornecer ferramentas confiáveis para aplicações em neurociência e engenharia biomédica, a maturidade desta tecnologia deve ser exaustivamente estudada. Aqui, avaliamos o desempenho de conjuntos de sensores de grafeno de 64 canais em termos de homogeneidade, sensibilidade e estabilidade usando um headstage quase comercial sem fio e demonstramos a biocompatibilidade de implantes crônicos de grafeno epicortical. Além disso, para ilustrar o potencial da tecnologia para detectar sinais corticais de bandas de frequência infra-lenta a gama alta, realizamos gravação sem fio de longo prazo como prova de conceito em um roedor de comportamento livre. Nosso trabalho demonstra a maturidade da tecnologia baseada em grafeno, que representa um candidato promissor para interfaces de detecção neural crônicas de banda larga de frequência.
Introdução
Aumentar a largura de banda das interfaces neuroeletrônicas em termos de resolução espacial e sensibilidade em uma ampla faixa de frequência é um desafio importante e contínuo na engenharia neural. Nas últimas décadas, grandes esforços têm sido dedicados ao desenvolvimento de interfaces de detecção neural com alta contagem de sensores em substratos conformes, que são necessários para alta sondas neurais intracranianas biocompatíveis. Nesta linha, os sensores ativos surgiram como um bloco de construção promissor para interfaces neurais de alta largura de banda porque podem ser organizados em uma matriz multiplexada habilitando sondas com alta contagem de sensores. O princípio de detecção de sensores ativos é tipicamente baseado na modulação da condutividade de um canal de transistor, que é acoplado eletricamente ao ambiente biológico através de sua porta, produzindo uma pré-amplificação de sinal local. Embora as tecnologias de detecção ativa apresentem vantagens substanciais sobre os conjuntos de micro-eletrodos convencionais, a sua implementação é atualmente limitada pelas exigentes propriedades do material exigidas. Para obter registros neurais altamente sensíveis e de longo prazo, espera-se que os materiais para detecção ativa apresentem propriedades semicondutoras ou semimetálicas, alta mobilidade elétrica e baixo ruído intrínseco, além de alta estabilidade, fácil integração em substratos flexíveis e biocompatibilidade. Alguns sensores ativos baseados em semicondutores orgânicos e nanomembranas finas de Si exibiram desempenho promissor, com novas arquiteturas de transistores e tecnologias isolantes melhorando seu desempenho em alguns aspectos normalmente restritos, como sua resposta de frequência ou sua estabilidade a longo prazo. Sensores ativos baseados em grafeno são outro candidato promissor para atender a esses requisitos devido à flexibilidade do grafeno, sua alta estabilidade esperada e biocompatibilidade, bem como suas propriedades eletrônicas, incluindo uma alta mobilidade de portadores de carga. Transistores de efeito de campo controlados por solução de grafeno (g-SGFETs) demonstraram uma alta sensibilidade para a detecção de potenciais de campo locais (LFP), além de alto desempenho em operação multiplexada. Além disso, g-SGFETs demonstraram recentemente uma alta sensibilidade para o mapeamento da atividade cerebral infralenta (<0,5 Hz) (ISA) com alta resolução espacial.
A ISA atraiu recentemente cada vez mais atenção devido à sua base neurofisiológica única e à sua relação com redes de estado de repouso e com estados cerebrais. Até o momento, a AIE tem sido tipicamente estudada por meio de eletroencefalografia de banda completa (fb-EEG). No entanto, o aumento da resolução espacial do monitoramento ISA usando eletrodos de tamanho pequeno é, em última análise, limitado pela dependência do ganho do amplificador na impedância dos eletrodos utilizados. Esta dependência leva à perda de sinal-ruído e à distorção do sinal em baixas frequências. Por esse motivo, estudos de ISA com alta resolução espacial têm sido tipicamente restritos a métodos de medição indireta, como ressonância magnética funcional, métodos ópticos ou análise de alterações infra-lentas da potência do sinal em frequências mais altas. Os G-SGFETs, como sensores ativos, transduzem os sinais de potencial eletroquímico no cérebro (Vsig) em sinais de corrente dreno-fonte (Ids) (ver Fig. 1a). A amplitude dos sinais transduzidos é proporcional à transcondutância (gm), definida como a inclinação do Ids–Curvas Vgs divididas por Vds (ver Fig. 1b).gm é proporcional à capacitância da porta por unidade de área (propriedade intensiva) e à relação W/L do transistor, mas não à sua área ativa. A detecção de sinal baseada no mecanismo de efeito de campo permite, portanto, evitar a distorção do sinal e a perda de ganho observada para pequenos sensores passivos na faixa de frequência infra-lenta. Espera-se que esta vantagem seja válida para todas as tecnologias de sensores baseados em FET com características de transferência estáveis, no entanto, a prova experimental só foi demonstrada para g-SGFETs, que apresentam uma inércia química particularmente elevada. As propriedades dos g-SGFETs representam uma mudança qualitativa no estudo da AIS, permitindo explorar o seu papel fisiológico com uma melhor resolução espacial. Porém, para avançar na aplicação real dos arranjos g-SGFET, vários aspectos técnicos ainda precisam ser avaliados minuciosamente.
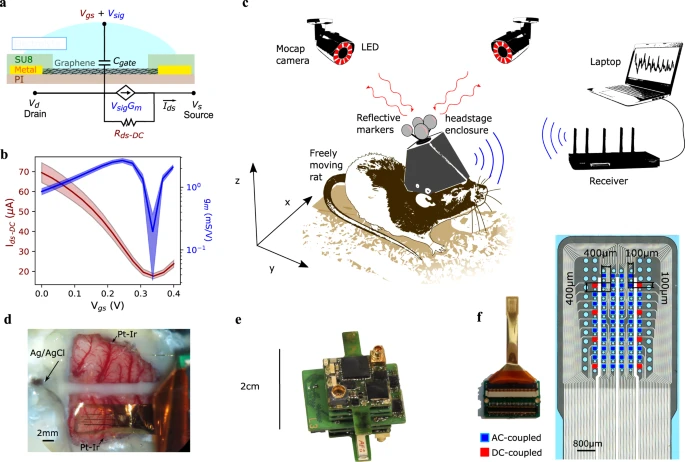
1: Matrizes de sensores ativos de grafeno para monitoramento crônico e sem fio da atividade neural epicórtica de ampla banda de frequência.
um esquema de um g-SGFET e seu circuito equivalente. A transdução de pequenos sinais de tensão para corrente é modelada pela fonte de corrente GmVsig, onde Gm ≡ dIds/dVgs. A corrente DC é modelada pelo elemento Rds. b Características médias de transferência estacionária de 8 g-SGFETs (eixo esquerdo) e gm de 64 g-SGFETs (eixo direito). A área preenchida indica o desvio padrão. c Ilustração do rato com o sistema de gravação sem amarras implantado. O headstage e a moldura impressa em 3D para mantê-lo são cobertos por um invólucro impresso em 3D. Na parte superior são fixados os marcadores de posição do sistema de captura de movimento (Mocap), que refletem a luz de volta para as câmeras Mocap colocadas na sala. Os sinais neurais transduzidos pelos sensores de grafeno são digitalizados e transmitidos sem fio ao receptor de sinal, que é conectado a um computador para gravação do sinal. matriz d g-SGFET colocada no córtex de rato; a posição do eletrodo de referência em contato com o cerebelo e dois eletrodos Pt-Ir em cada lado da matriz g-SGFET estão marcados com setas. e Fotografia do headstage sem fio projetado para esses experimentos. f Fotografia do conjunto SGFET de 64 g montado em um conector personalizado (esquerda) e imagem ampliada da área ativa da sonda (direita). Os quadrados vermelhos indicam os g-SGFETs no array, que estão conectados às entradas do headstage com recursos DC.
Neste artigo, apresentamos um sistema de detecção composto por um arranjo g-SGFET flexível de 64 canais e um headstage sem fio (Fig. 1c – f e informações suplementares S1), que usamos para demonstrar a maturidade desta tecnologia em termos de capacidades de gravação de banda de frequência ampla e de longo prazo em animais em movimento livre de uma perspectiva de sistema. Primeiro, o foco está na avaliação das características in vitro do sistema; incluindo o rendimento e homogeneidade dos sensores de grafeno, seu ruído intrínseco e o impacto do sistema de aquisição de dados (DAQ) na sensibilidade desses dispositivos. Em segundo lugar, foram resolvidos aspectos críticos para a sua aplicação crônica in vivo; incluindo a estabilidade do doping com grafeno, a estabilidade a longo prazo da sensibilidade dos g-SGFETs e sua biocompatibilidade aguda e crônica. Finalmente, ∼24 horas. A combinação de dados comportamentais e eletrofisiológicos tem sido usada para avaliar as capacidades do sistema de gravação sem fio para monitorar a dinâmica cerebral através da alternância imperturbável de estados cerebrais e validar sua sensibilidade à detecção de oscilações de alta frequência associadas a eventos comportamentais esparsos. Como uma ilustração das características únicas da gravação g-SGFET, fornecemos uma primeira demonstração de caso de padrão infra-lento topograficamente específico e invariante do estado cerebral associado a fusos de alta tensão (HVS). Além disso, encontramos mudanças na potência do sinal infra-lento entre o sono de ondas lentas (SWS) e o sono de movimento rápido dos olhos (REM) e identificamos a modulação das oscilações teta e dos fusos do sono pela fase da dinâmica infra-lenta do sinal DC durante o REM e SWS, respectivamente.
Resultados
Homogeneidade e sensibilidade da tecnologia de sensor ativo de grafeno
Para a implementação de conjuntos de sensores ativos de grafeno como uma ferramenta prontamente disponível para pesquisas neurocientíficas, a maturidade da eletrônica de grafeno flexível e em larga escala é crítica. Dois dos principais desafios no desenvolvimento destas tecnologias têm sido tipicamente a produção de grafeno de camada única (SLG) de alta qualidade e a sua transferência para o substrato necessário. O desenvolvimento de métodos em escala de wafer para produzir SLG concentrou muitos esforços e investimentos na última década 50, levando recentemente a progressos importantes no crescimento do grafeno por deposição de vapor químico (CVD). Aqui, mostramos que a qualidade do grafeno de camada única comercialmente disponível, produzido por CVD e transferido em um substrato polimérico flexível (revestido por rotação em um wafer de Si de 4 polegadas) é alto o suficiente para permitir a fabricação de matrizes g-SGFET com um bom desempenho homogêneo tanto em termos de gm quanto de ruído elétrico de baixa frequência.
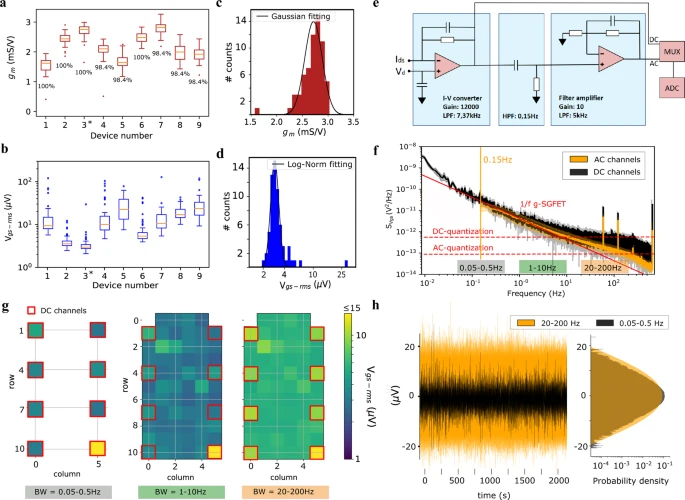
A Figura 2a mostra o boxplot para o gm de nove sondas neurais, cada uma delas contendo 64 g-SGFETs (com um tamanho de 100 × 100 μm2 escolhido para análise de LFP epicortical em mesoescala). Essas sondas foram selecionadas aleatoriamente a partir de três wafers, todas processadas em lotes independentes (ver “Métodos” para detalhes de fabricação). É possível observar uma elevada homogeneidade e rendimento em termos de gm, com 99% dos canais funcionando (definidos como transistores com gm acima de 0,7 vezes a mediana). A mediana medida gm, 1,9 mS/V, é relativamente alta em relação aos FETs de silício flexíveis e comparável com valores típicos de transistores orgânicos devido à alta mobilidade elétrica e capacitância de porta dos g-SGFETs. 2b é mostrado o ruído equivalente na porta (Vgs-rms) dos mesmos dispositivos (ver informação suplementar S2). Vgs-rms é uma importante figura de mérito para avaliar a sensibilidade dos sensores, que é definida como a razão entre o ruído de corrente integrado (Ids-rms) do transistor e sua transcondutância. Embora este parâmetro apresente uma dispersão maior que gm, é possível identificar 3 de 9 sondas com 96% dos g-SGFETs apresentando um Vgs-rms abaixo de 10 µVrms, sugerindo que o ruído medido não está diretamente relacionado ao gm. Na verdade, foi relatado que o ruído de baixa frequência no grafeno se origina de eventos de captura e remoção de carga, o que torna o ruído diretamente proporcional à densidade das armadilhas e, portanto, sensível às impurezas no ambiente do grafeno. As Figuras 2 c, d mostram a distribuição de gm e Vgs-rms, respectivamente, para a sonda nº 3 marcada com um asterisco na Fig 2. A dispersão na transcondutância dos g-SGFETs pode ser levada em consideração na calibração dos sinais neurais, corrigindo a dispersão na amplificação do sinal. Portanto, o fator verdadeiramente limitante em termos de homogeneidade do desempenho dos g-SGFETs é o ruído equivalente na porta. Vgs-rms apresenta uma distribuição log-normal com média de 4,13 μVrms e desvio padrão de 1,14 μVrms (excluindo os outliers mostrados na Fig. 2b). Estes resultados mostram que sondas neurais baseadas em grafeno preparadas usando um processo de fabricação em escala de wafer de 4 polegadas podem ser obtidas com alta homogeneidade e sensibilidade. Além disso, espera-se que o aumento do processo de fabricação para uma escala industrial melhore ainda mais a homogeneidade das características dos g-SGFETs, especialmente em termos do ruído de carga dependente da contaminação.
Fig. 2: Avaliação da sensibilidade do sistema.
um Boxplot de gm para nove sondas selecionadas aleatoriamente de três wafers diferentes produzidos em lotes independentes. É indicado o rendimento em termos de gm acima de 70% da mediana. b Boxplot para Vgs-rms medido na faixa de frequência de 1–10 Hz, traçado para as mesmas sondas neurais avaliadas na parte a. Todas as sondas consistindo em 64 g-SGFETs. As caixas estendem-se dos quartis inferiores aos superiores, com uma linha na mediana. Os bigodes estendem-se 1,5 vezes o intervalo interquartil e os pontos de dados além dos bigodes são indicados por um ponto. c Histograma de gm para os 64 g-SGFETs da sonda nº 3 (rotulado no painel a) e ajuste gaussiano do histograma excluindo os valores discrepantes mostrados no painel a. d Histograma de Vgs-rms para os 64 transistores na sonda nº 3 (ver painel b) e ajuste log-normal do histograma excluindo os valores discrepantes mostrados no painel b. e Circuito equivalente do headstage sem fio. f Densidade espectral de potência (PSD) do ruído dos canais DC (preto) e canais AC (laranja) na sonda nº 3. A dependência 1/f é representada pela linha vermelha sólida. A linha vertical laranja indica o filtro passa-alta de hardware aplicado aos canais AC a 0,15 Hz. O ruído de quantização dos canais DC e AC é indicado pelas linhas vermelhas horizontais tracejadas. g Representação do Vgs-rms para todos os g-SGFETs na sonda #3 mostrado para diferentes larguras de banda; Banda de 0,05-0,5 Hz para os canais DC (esquerda), banda de 1–10 Hz (meio) e 20–200 Hz (direita). A posição dos g-SGFETs na matriz conectada aos canais DC do headstage é indicada pelos quadrados vermelhos. h Representação no domínio do tempo dos espectros de ruído mostrados na parte f e g (canais DC filtrados na banda de 0,05–0,5 Hz e canais AC na banda de 20–200 Hz). O sinal de oito canais está sobreposto.
Design e características do headstage sem fio
Outro aspecto que contribui para a sensibilidade do sistema de gravação é o ruído introduzido pelo headstage no processo de amplificação e digitalização. A amplificação da atividade da ampla banda de frequência requer um sistema acoplado DC, o que implica a digitalização de sinais com grandes deslocamentos DC. Para digitalizar sinais com uma faixa dinâmica tão grande e minimizar o ruído de quantização, um amplificador de transimpedância de dois estágios foi implementado (ver esquema na Fig. 2e). O primeiro estágio converte as correntes Ids dos g-SGFETs em tensão, que contém um sinal de banda de frequência ampla, incluindo os componentes de frequência infralenta de Ids. No segundo estágio de amplificação (ver Fig. 2e), o sinal é filtrado passa-alta para remover o deslocamento DC e preencher a escala completa do conversor analógico-digital (ADC). Para escolher dinamicamente entre um acoplamento DC ou AC para cada canal, foi adicionado um multiplexador para alternar entre a saída do primeiro e do segundo estágio, ver Fig. 2e. Os multiplexadores foram implementados em apenas 8 dos 64 canais para minimizar o consumo de energia e, portanto, o peso e o volume da bateria do headstage sem fio dedicado.
Ter uma transcondutância relativamente alta é importante para pré-amplificar os sinais acima do nível de ruído dos amplificadores de transimpedância. No entanto, sensores ativos normalmente apresentam um ruído intrínseco 1/f, que aumenta com a corrente dreno-fonte. Portanto, Vgs-rms é uma figura de mérito mais adequada para avaliar a sensibilidade de sensores ativos. Para validar que a sensibilidade do sistema de gravação é limitada pelo ruído intrínseco dos sensores ativos, é fundamental avaliar o impacto da eletrônica de amplificação na sensibilidade do sistema em uma ampla faixa de frequência. O nível de ruído para canais DC e AC pode ser avaliado a partir da densidade espectral de potência (PSD) do ruído de tensão equivalente na porta (SVgs (f)), definido como o PSD do ruído atual sobre a transcondutância (ver Fig. 2f). A parte central do espectro, de aproximadamente 0,05 Hz a 10 Hz, é dominada pelo ruído intrínseco 1/f dos transistores de grafeno. Para frequências abaixo de 0,05 Hz, os canais DC mostram um ligeiro aumento acima do ruído 1/f, o que é atribuído à contribuição de fontes de ruído adicionais na cadeia de amplificação, levando a valores Vgs-rms ligeiramente maiores na faixa de 0,005–0,05. Banda Hz (ver informação suplementar S2). Acima de 10 Hz os espectros de ruído apresentam um aumento significativo acima do ruído 1/f, causado pelo ruído de quantização dos amplificadores headstage, que é mais pronunciado nos canais DC. O S Vgs (f) integrado em diferentes bandas de frequência é mostrado na Fig. 2g para todos os canais na sonda neural #3. Os três mapas demonstram a semelhança da sensibilidade do sistema nas diferentes faixas, com apenas um aumento significativo na faixa de 20–200 Hz. Nesta banda, o ruído dos canais DC excede o ruído dos canais AC; no entanto, todos os sensores de grafeno (exceto um outlier) mantêm valores Vgs-rms abaixo de 15 µV. O ruído de digitalização para canais AC pode ser diminuído otimizando ainda mais o ganho do segundo estágio de amplificação. No entanto, espera-se que o ruído intrínseco do amplificador domine para grandes ganhos de amplificação. Para ilustrar melhor a sensibilidade constante ao longo da frequência, Fig 2h mostra a representação no domínio do tempo do sinal de ruído filtrado na banda ISA (0,05–0,5 Hz) e na banda de alta frequência (20–200 Hz). O histograma traçado próximo à representação no domínio do tempo de ambos os sinais mostra sua distribuição de densidade de probabilidade, o que demonstra a similaridade de sua variância, como esperado da integração de um espectro 1/f nessas bandas de frequência. Observe que a amplitude aparentemente menor na representação no domínio do tempo do ruído infra-lento é devida às diferentes escalas de tempo do ruído 1/f em ambas as bandas de frequência, mas não devido a uma variação de sinal diferente.
Estes resultados mostram a alta sensibilidade do sistema em uma ampla faixa de frequência, com Vgs-rms abaixo de 5 μV na faixa de frequência infra-lenta. No projeto do headstage, consideramos o compromisso entre atingir a sensibilidade máxima na faixa de alta frequência e minimizar o consumo de energia do sistema de gravação acoplado a DC com uma contagem de canais relativamente alta. Espera-se que g-SGFETs menores apresentem um ruído intrínseco maior (ver informação suplementar S2), conforme esperado para qualquer sensor ativo ou passivo. Portanto, nossos resultados indicam que a sensibilidade dos g-SGFETs na frequência infra-lenta não é afetada pela eletrônica de amplificação para áreas do sensor abaixo de 100 × 100 μm. Isto contrasta fortemente com a detecção ISA usando eletrodos passivos, para os quais se espera que a perda de ganho e a distorção do sinal aumentem para dimensões menores do sensor. Estes resultados demonstram os limites e a escalabilidade da tecnologia g-SGFET para matrizes de maior densidade com capacidades de detecção ISA.
Estabilidade e sensibilidade do sinal ao longo do tempo
Uma vez avaliado adequadamente o desempenho dos transistores de grafeno e do headstage, a estabilidade dos g-SGFETs em um ambiente crônico in vivo precisa ser avaliada para garantir a confiabilidade do sistema de gravação.
As curvas Ids–Vgs dos g-SGFETs descrevem a relação entre a corrente medida do dreno para a fonte e o potencial eletroquímico na interface grafeno-eletrólito. O mínimo em Ids ocorre em uma tensão de porta específica, chamada de ponto de neutralidade de carga (CNP), que também está relacionado a um mínimo na sensibilidade do dispositivo (ver Fig. 1a). O CNP corresponde às condições de polarização para as quais a energia de Fermi no canal de grafeno é, em média, mais próxima da energia com densidade mínima de estados (ou seja, o ponto de Dirac). O sobrepotencial Vgs necessário para atingir esta energia depende da dopagem do canal de grafeno, bem como no potencial eletroquímico do eletrodo de referência. Portanto, instabilidades em qualquer um destes dois parâmetros produzirão uma mudança nas características de transferência no eixo Vgs. Por sua vez, esta mudança implica que Ids apresentará um desvio e que a sensibilidade dos g-SGFETs poderá variar ao longo do tempo para um sobrepotencial Vgs constante. Ter uma dopagem controlável do g-SGFET e um CNP homogêneo entre os sensores é, portanto, de suma importância para manter uma boa sensibilidade do conjunto de sensores.
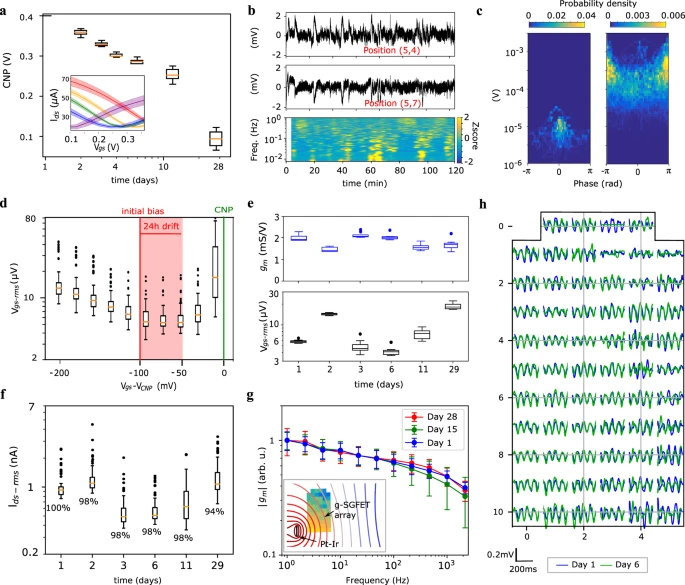
A Figura 3a mostra a evolução das características de transferência ao longo de 4 semanas após a implantação da sonda neural (ver “Métodos” para detalhes de implantação). A mudança observada no CNP é presumivelmente devida a uma combinação de fatores, incluindo dessorção de contaminantes por limpeza eletroquímica da interface grafeno-eletrólito, adsorção de espécies químicas carregadas presentes no ambiente ou alterações no potencial do eletrodo de referência (ver informações suplementares S3). No entanto, a partir destes resultados não é possível distinguir entre todas as diferentes contribuições. A deriva acumulada no CNP medida durante as primeiras 24 horas de gravação atinge aproximadamente 50 mV, com uma taxa de alteração máxima de ∼20 mV/h na primeira hora (ver informação suplementar S3). A Figura 3b mostra o sinal medido em dois canais acoplados a DC (filtrado passa-alta a 1 mHz) durante as primeiras 2 horas de gravação. A figura 3c mostra a relação amplitude-fase entre esses dois canais acoplados a DC na banda de 0,005–0,05 Hz (consulte a seção “Métodos”). O painel esquerdo mostra o acoplamento amplitude-fase medido em PBS, enquanto o painel direito mostra os resultados equivalentes in vivo. Os sinais in vivo exibem flutuações com amplitude muito maior do que os sinais registrados em PBS, descartando o ruído do transistor 1/f e o ruído do headstage como origem dessas oscilações infra-lentas. Além disso, os sinais in vivo registrados na banda de 0,005–0,05 Hz apresentam flutuações na antifase, o que confirma que nem as instabilidades no eletrodo de referência nem a adsorção/dessorção de espécies químicas no grafeno são responsáveis por essas flutuações. Para concluir esta discussão, a Fig. 3d mostra o efeito dos desvios na dopagem de grafeno no Vgs-rms dos sensores de grafeno. Estes resultados demonstram que a sua sensibilidade não muda significativamente devido aos desvios acumulados até 24 horas se o viés inicial for selecionado corretamente. Portanto, o rastreamento diário do CNP e o reajuste do superpotencial Vgs de volta aos valores ideais são suficientes para manter uma sensibilidade constante durante o monitoramento de longo prazo da dinâmica cerebral.
Figura 3: estabilidade do g-SGFET in vivo.
um CNP versus tempo durante 4 semanas. A inserção mostra as curvas Ids–Vgs. Média e desvio padrão para n = 8 g-SGFETs (1 outlier excluído). b Sinal de dois canais acoplados em CC. Posições indicadas correspondentes ao mapa no painel h. O espectrograma do canal (5,7) é mostrado (parte inferior). c A relação fase-amplitude entre os canais no painel b, para o ruído medido no béquer (esquerda) e para os sinais medidos in vivo (direita). d Boxplot de Vgs-rmsvs. mudanças no gate efetivo (Vgs – VCNP) dos 64 g-SGFETs. A área colorida indica a deriva medida no CNP referida a um eletrodo Ag/AgCl durante as primeiras 24 horas de gravação. O viés inicial e o CNP são indicados pelas linhas verticais vermelhas e verdes, respectivamente. e gm (parte superior) e Vgs-rms (parte inferior) medidos ao longo de 4 semanas após a implantação; gm foi obtido a partir das curvas Ids – Vgs dos canais acoplados a DC (n = 8 g-SGFETs, 1 outlier excluído). f Ruído atual durante 4 semanas após a implantação (n = 64 g-SGFETs). Os valores numéricos indicam o rendimento dos dispositivos de trabalho (ver informação suplementar S4). As caixas nos painéis a e d–f estendem-se dos quartis inferiores aos superiores, com uma linha na mediana. Os bigodes estendem-se 1,5 vezes o intervalo interquartil e os pontos de dados além dos bigodes são indicados por um ponto. g Média e desvio padrão da transcondutância dependente da frequência (|gm| (f)) mostrada para diferentes dias após a implantação (n = 10 g-SGFETs). A inserção mostra a posição aproximada do eletrodo Pt-Ir próximo ao arranjo, as linhas de contorno equipotenciais simuladas em um plano condutor e a amplitude relativa do sinal medida por cada um dos g-SGFETs no arranjo (ver informações suplementares S5). h Sinais medidos por todos os g-SGFETs na matriz durante um estado de atividade teta aumentada no dia 1 e no dia 6 após a implantação.
Além das mudanças na dopagem do grafeno, a transcondutância e o ruído dos g-SGFETs podem variar ao longo do tempo devido, por exemplo, à criação de defeitos na rede do grafeno. O grafeno puro mostrou excelente estabilidade química devido à sua hibridização sp2. No entanto, ligações pendentes nas bordas, limites de grãos, vagas atômicas ou reconstruções na rede atômica aumentam a reatividade do grafeno, o que pode levar à criação de defeitos ao longo do tempo. Além disso, pode haver causas mecânicas de degradação do desempenho, como o desprendimento do grafeno do substrato ou a tensão induzida por flexão na rede do grafeno e nos contatos metal-grafeno. Outra possível causa da degradação da sensibilidade poderia ser o encapsulamento do dispositivo por tecido cicatricial glial. Esta camada de tecido pode ser modelada como uma impedância elétrica em série com a interface grafeno-eletrólito, o que pode eventualmente levar a uma resposta de frequência degradada dos g-SGFETs.
Para rastrear alterações na sensibilidade ao longo do tempo em um implante crônico, o gm extraído das curvas Ids–Vgs e o Vgs-rms foram medidos periodicamente para os 8 canais acoplados a DC durante 4 semanas. A Figura 3e mostra que gm permaneceu aproximadamente constante, sugerindo que não há grande criação de defeitos no canal de grafeno no ambiente in vivo. Da mesma forma, o Vgs -rms apresenta apenas um ligeiro aumento nos últimos dias. A Figura 3f mostra o ruído atual (Ids-rms) para todos os 64 canais medidos a 200 Hz durante 4 semanas. Nesta frequência, é possível estimar alterações na sensibilidade do sistema de gravação devido à baixa potência média dos sinais neurais de alta frequência (ver informação suplementar S4). Os valores numéricos exibidos na Fig. 3f indicam a porcentagem de g-SGFETs funcionando (ver informação suplementar S4). A resposta de frequência da transcondutância (gm (f)) também foi medido in vivo durante 4 semanas após a implantação. Para este propósito, dois eletrodos Pt-Ir foram implantados em ambos os lados do arranjo g-SGFET (ver inserção na Fig. 3g) e sinais de tom puro de amplitude de 1 µA de diferentes frequências foram aplicados usando uma fonte de corrente. A Figura 3g mostra a magnitude de gm (f) para diferentes dias após a implantação da sonda neural normalizada pela magnitude média a 1 Hz; a fase de gm (f) é mostrada na informação suplementar S5. A inclinação aproximadamente constante (em uma escala log-log) segue uma atenuação de ordem fracionária (ou seja, aproximadamente ∝ 1/ f 0,1), que foi recentemente atribuído à resposta capacitiva não ideal da interface grafeno-eletrólito. Um método de calibração para corrigir tal variação de transcondutância também foi proposto. A evolução da resposta em frequência não apresenta grandes alterações na inclinação da atenuação gm, indicando que não há aumento significativo da impedância elétrica em série com a interface grafeno-eletrólito devido ao encapsulamento do dispositivo. Para concluir, Fig. 3g mostra a atividade neural registrada em um estado de aumento da potência teta no dia 1 e no dia 6 após a implantação, ilustrando a boa homogeneidade e estabilidade do desempenho dos g-SGFETs. Estudos futuros poderiam abordar com maior detalhe, através do estudo de uma grande coorte de animais, a estabilidade do sinal biológico ao longo do tempo, um aspecto crítico na pesquisa em eletrofisiologia e para o desempenho a longo prazo das interfaces cérebro-computador. Além disso, os polímeros utilizados como substrato e camadas de passivação poderiam ser modificados para reduzir a absorção de umidade e deslocar o plano neutro do dispositivo na posição do canal de grafeno (ver seção “Métodos”). No entanto, os resultados apresentados nesta seção revelam um desempenho promissoramente estável ao longo do tempo, o que estabelece um limite inferior para a estabilidade dos g-SGFETs em um ambiente de implante crônico. Além disso, do ponto de vista do sistema, mostramos que os arranjos g-SGFET podem medir sinais biológicos muito lentos (filtrados passa-alta acima de 1 mHz).
Biocompatibilidade de dispositivos de grafeno após implantação subaguda e crônica
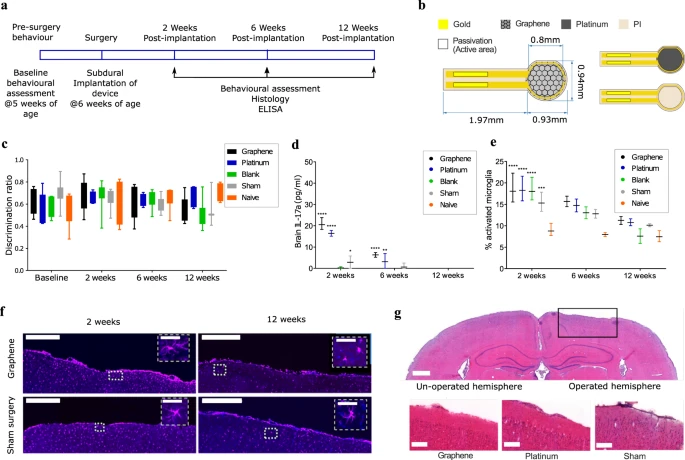
A fim de avaliar a aplicabilidade dos arranjos g-SGFET para o monitoramento de longo prazo da atividade cerebral sob comportamento natural, também investigamos a biocompatibilidade de dispositivos epicorticais baseados em grafeno. Para tanto, os animais foram implantados com um dos três dispositivos no córtex parietal do cérebro, ou foram submetidos à cirurgia completa sem a implantação de qualquer dispositivo (controle simulado). Uma coorte de animais ingênuos que não tiveram intervenção foi utilizada como controle. Três momentos foram escolhidos para avaliar a resposta do tecido: 2 semanas, 6 semanas e 12 semanas após a implantação (Fig. 4a). Dispositivos não funcionais foram projetados sob medida com uma área superficial ampliada de grafeno CVD, a fim de maximizar a exposição do material ao tecido cerebral (ver Fig. 4b para dimensões do dispositivo). Os experimentos foram desenhados seguindo as orientações da norma ISO 10993, que detalha a avaliação biológica de dispositivos médicos. A esterilização por óxido de etileno foi aplicada antes da implantação. Após a implantação, foram investigadas a resposta imuno-histoquímica do tecido e os potenciais efeitos no comportamento.
Figura 4: Teste de biocompatibilidade de g-SGFET não funcional versus dispositivos de controle.
a O cronograma descreve os procedimentos realizados nos animais durante o estudo de biocompatibilidade. b Esquema do protótipo g-SGFET de alta área superficial desenvolvido para testes de biocompatibilidade in vivo. c Taxa de discriminação do teste NOR em diferentes dias após a implantação (ver seção “Métodos”). Para todos os cinco grupos testados, a taxa de discriminação foi superior a 0,5 em todos os momentos. Avaliado para n = 7 animais por grupo em todos os momentos, exceto 12 semanas que tiveram n = 3 (simulação), n = 4 (platina e ingênuo) e n = 7 (em branco). As caixas do quartil inferior ao superior, enquanto os bigodes representam valores mínimos e máximos. d Marcador inflamatório IL-17a no tecido cerebral para todos os grupos e momentos. Avaliado para n = 4 animais após 2 e 12 semanas, e n = 3 animais às 12 semanas. E estado de ativação microglial, expresso como porcentagem da presença microglial total no local ao redor dos eletrodos. n = 3 animais às 2 e 12 semanas, n = 2 animais (ou 3 para o hemisfério contralateral) às 6 semanas. As barras nos painéis d e e indicam a média e o intervalo do ponto de dados. f Coloração imunofluorescente Iba-1 para avaliar o status de ativação da microglia no local cirúrgico obtido a partir de 40 seções por animal. Barra de escala é igual a 500 μm (50 μm nas inserções). g A coloração com hematoxilina e eosina 2 semanas após a implantação mostra que não há danos estruturais nas camadas corticais diretamente no local de implantação do dispositivo. Quarenta seções de 25 µm por animal foram fotografadas. Barra de escala é igual a 1 mm (parte superior) e 200 µm (parte inferior). Nos painéis d e e, teste ANOVA bidirecional com comparação múltipla de Dunnett com o controle ingênuo dentro de cada ponto de tempo com n = 3 ou maior: *, **, *** e **** indicam p = 0,015, p = 0,007, p = 0,0016 e p < 0,0001, respectivamente.
O comportamento foi avaliado por meio do teste de reconhecimento de novos objetos (NOR), utilizado para avaliar comprometimento da cognição e da memória. Não foram encontradas diferenças significativas na taxa de discriminação em animais implantados com qualquer dispositivo em qualquer um dos momentos (Fig. 4c). A resposta inflamatória do tecido foi avaliada utilizando duas técnicas principais: ELISA de sangue ou tecido cerebral para um painel de citocinas inflamatórias e análise imuno-histoquímica do tecido cerebral para células associadas à inflamação. O ELISA foi realizado para quatro citocinas: interleucina-6 (IL-6), interleucina-17a (IL-17a), interferon gama (IFN-γ) e fator de necrose tumoral alfa (TNF-a). No soro sanguíneo, não houve diferenças significativas entre nenhum dos materiais em nenhum momento (ver Fig. S6). Para a expressão de citocinas no tecido cerebral, foram encontrados níveis significativamente mais elevados de todas as quatro citocinas em dispositivos de grafeno e platina no período de 2 semanas, quando comparados com o controle do hemisfério contralateral. Embora a libertação destes fatores se destine tipicamente a prevenir danos adicionais ao tecido do SNC, a expressão prolongada pode ser prejudicial. Às 6 semanas após a implantação, ainda havia uma elevação significativa de IL17a e IFN-γ para dispositivos de grafeno e platina versus expressão de controle, e na semana 12, não houve expressão significativa de qualquer citocina para qualquer grupo de tratamento (Fig. 4d e Figura S7). Esses achados demonstram que a resposta tecidual adversa ao grafeno é de natureza transitória, comparável ao padrão clínico atual e específica para o local de implantação, sem complicações sistêmicas observadas.
Para confirmar os dados do ELISA, também foi realizada a contagem manual do estado de ativação das células microgliais para avaliar o estado inflamatório no cérebro. As células microgliais estão sempre presentes no cérebro, mas sua morfologia serve como um indicador do estado inflamatório no cérebro. A expressão da microglia ativada aumentou tanto nas 2 semanas como nas 6 semanas após a implantação, e esta ativação esteve presente a um nível significativo às 2 semanas após a implantação em todos os quatro grupos de tratamento quando comparado com o hemisfério contralateral. No entanto, semelhante ao ELISA, a ativação da microglia retornou aos níveis basais em 12 semanas, indicando nenhuma reação inflamatória prolongada aos dispositivos (Fig. 4e, f e Fig. S8). Também foi realizada a contagem de células TUNEL, para avaliar qualquer morte celular no tecido em decorrência da implantação dos dispositivos. Duas semanas após a implantação, houve um aumento significativo no número de células positivas para TUNEL tanto para os grupos de grafeno quanto para cirurgia simulada. No entanto, às 6 semanas não houve evidência de morte celular, o que também foi verdade às 12 semanas (Fig. S9). Finalmente, não houve alterações morfológicas óbvias observadas com coloração com hematoxilina e eosina. Houve um aparecimento de córtex afundado em alguns cérebros, no entanto, isto foi devido à fixação de perfusão com a janela de vidro no lugar, e não houve efeito na espessura das camadas corticais abaixo do local de implantação, como mostrado na Fig 4g.
Globalmente, tanto a expressão de citocinas como a análise histológica da área cerebral no local de implantação mostraram uma reação aguda à implantação de dispositivos. No entanto, isto não era específico dos dispositivos de grafeno, embora uma área superficial ampliada de grafeno tenha sido usada para maximizar a resposta específica do material. Às 6 semanas, a reação mostrou sinais claros de melhora e, às 12 semanas, não houve reação detectável aos dispositivos usando qualquer técnica. Os dispositivos de grafeno e Pt mostraram um nível semelhante de ativação da microglia em comparação com os dispositivos “em branco”, enquanto o último mostra uma presença muito menor de marcadores inflamatórios do que o grafeno ou a Pt. Estes resultados sugerem que a ativação da microglia está mais fortemente associada ao procedimento cirúrgico e à inserção da sonda, enquanto a inflamação é afetada principalmente pelo material do dispositivo. Desta forma, espera-se que conjuntos de sensores funcionais, que apresentam uma área de grafeno muito menor, causem uma inflamação mais próxima daquela causada por dispositivos “em branco”. Além disso, de acordo com o teste NOR, os dispositivos de grafeno não afetaram significativamente o comportamento animal nem nos momentos agudos nem crônicos. Com base nesses resultados, os dispositivos à base de grafeno apresentaram biocompatibilidade adequada para implantação crônica, comparável aos dispositivos equivalentes à base de platina.
Monitoramento de longo prazo da atividade cerebral epicórtica de banda larga de frequência durante o comportamento natural
Durante a avaliação longitudinal in vivo da sensibilidade do g-SGFET, registramos a atividade cerebral epicórtica em um rato que se comportava livremente por até 24 horas. Durante todo o período de gravação, o movimento 3D do animal foi rastreado com um sistema de captura de movimento (Mocap) (ver seção “Métodos” e Fig. 5a). A gravação conjuntiva do movimento animal e dos sinais epicorticais de banda larga de frequência foi usada para classificar os estados cerebrais e comportamentais durante o período de gravação. Por sua vez, esta classificação foi utilizada para apoiar dois propósitos principais. Primeiro, validar a capacidade do sistema de gravação sem fio baseado em grafeno de realizar gravações estáveis de longo prazo em ratos em movimento livre em vários estados cerebrais e testar sua adequação para estudar a dinâmica LFP epicortical infra-lenta. Segundo, avaliar a sensibilidade do g-SGFET na faixa de alta frequência da dinâmica LFP relacionada ao comportamento espontâneo. A análise das relações entre a atividade cerebral epicórtica e o comportamento de movimento livre foi realizada em escalas de tempo possibilitadas pelo sistema de gravação sem fio. Esta capacidade é crítica para o estudo de eventos comportamentais de ocorrência esparsa, bem como padrões ISA sobre estados cerebrais distintos.
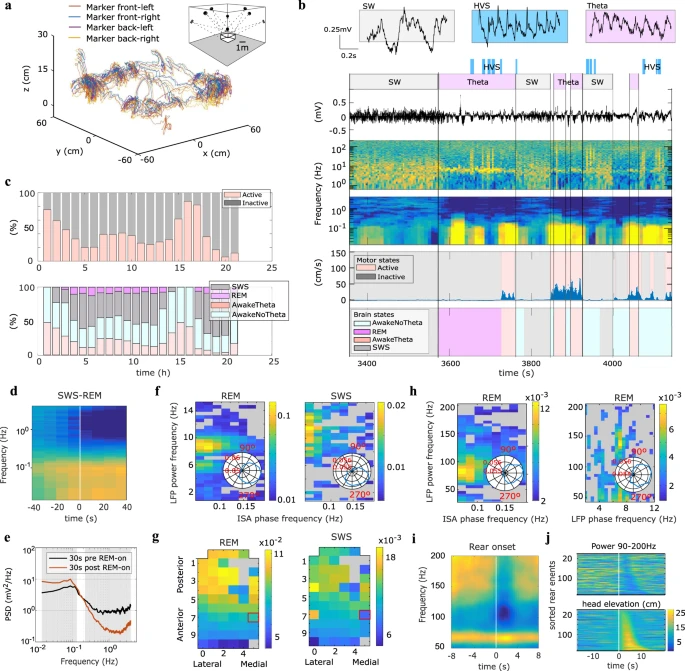
5: Correlatos de infra-lento a gama alta de sono e estados comportamentais.
a trajetórias 3D da posição da cabeça do rato. A inserção mostra um esquema da posição do Mocap. b O espectrograma e o sinal LFP bruto de um canal ilustrativo são exibidos para estados cerebrais distintos (parte superior); onda lenta (SW), fusos de alta tensão (HVS) e Theta. A velocidade do movimento é exibida juntamente com a classificação do estado motor (meio) e dos estados cerebrais (parte inferior). c Superior: porcentagem de tempo no estado ativo vs. inativo (interrupções para troca de bateria não incluídas). Abaixo: porcentagem de tempo que o rato esteve em cada estado cerebral principal. d Espectrograma médio de 0,015–4 Hz para um canal DC acionado no início dos episódios REM (n = 44). e PSD mediana entre episódios de transição SWS-REM (n = 44) por períodos de 30 s antes e depois do início do REM. A área sombreada marca os compartimentos de frequência com diferença significativa (p < 0,05, teste de permutação). f Força de modulação codificada por cores da potência LFP na faixa de frequência lenta (eixo y) para um canal pela fase de ISA na faixa de 0,05–0,2 Hz derivada de um canal DC (ver painel g) durante o sono REM (esquerda) e Estados SWS (à direita). A cor cinza indica modulação não significativa. As inserções mostram um gráfico circular da potência LFP na banda teta/fuso em função da fase ISA. g Mapas topográficos codificados por cores da modulação de fase ISA da potência LFP na banda teta durante REM (esquerda) e banda do fuso durante SWS (direita). Fase ISA derivada do canal DC marcado com um quadrado vermelho. h Força de modulação codificada por cores da potência LFP na faixa de frequência gama (eixo y) para um canal pela fase de ISA na faixa de 0,05–0,2 Hz derivada de um canal DC (esquerda) e pela fase de LFP no lento ritmo da faixa de frequência (direita) durante o REM. Inserção, gráfico circular da potência gama LFP em relação à respectiva fase (ISA ou teta). i Espectrograma médio para faixa de alta frequência de LFP no canal posterior acionado no início traseiro (n = 162). j Elevação da cabeça (parte inferior) e alta potência gama (topo, mesmo canal que em i) codificados por cores e centrados no início da criação mostrados para todos os eventos classificados pela duração do evento traseiro.
Os estados cerebrais foram classificados através de uma combinação de características espectrais no sinal LFP epicortical e dados motores. Desta forma distinguimos as seguintes classes: sono de ondas lentas (SWS), sono REM (REM), Awake Theta (AwT) e Awake Non-Theta (AwNT). A Figura 5b ilustra os critérios para classificação dos estados cerebrais, descritos detalhadamente na seção “Métodos”. Primeiro, foram identificados estados de onda lenta (SW), mostrando aumento de potência na banda de 1–25 Hz, e estados Teta (ver Fig. 5b). O comportamento do animal foi então classificado em períodos ativos ou inativos a partir dos dados de rastreamento de movimento (ver Fig. 5b e seção “Métodos”). Durante o comportamento motor inativo, os estados SW foram classificados como SWS, exceto na proximidade direta de eventos HVS, enquanto os estados Theta foram categorizados como REM se diretamente precedidos por SWS. Por outro lado, os estados Theta que ocorrem durante o comportamento ativo foram classificados como AwT e os estados SW como AwNT. Finalmente, os períodos não atribuídos aos estados Theta ou SW foram classificados como AwNT independentemente do comportamento do animal. Durante a maioria das horas de gravação, todos os quatro estados de sono/vigília foram expressos pelo menos uma vez, de acordo com a natureza polifásica do sono dos ratos. Sua proeminência relativa, no entanto, variou substancialmente ao longo do dia de gravação, paralelamente às mudanças observadas nos estados motores (Fig. 5c), em consonância com a ritmicidade circadiana.
A classificação dos estados cerebrais é normalmente baseada nas bandas de frequência delta, alfa-beta e teta (consulte a seção “Métodos”), refletindo a dinâmica da rede específica do estado em escala de tempo rápido. No entanto, algumas pesquisas recentes destacaram o papel da dinâmica infralenta na regulação dos subestados cerebrais, através da modulação de bandas de frequência LFP mais altas durante o sono e coordenação dinâmica e segregação do estado de repouso. Estes resultados mostram a importância potencial do ISA para uma classificação e estudo completo dos estados cerebrais. O sistema de gravação baseado em grafeno aqui apresentado representa uma ferramenta ideal para o estudo de sinais ISA corticais com alta precisão e resolução espacial em animais que se comportam livremente. O espectrograma na Fig. 5b ilustra mudanças na potência espectral para frequências entre 0,015 e 4 Hz durante a transição entre SWS e REM. É possível observar um claro aumento na potência da banda ISA após a transição de SWS para REM, mesmo no nível de teste único (ver Fig. 5b). Aproveitando as capacidades de gravação de longo prazo do nosso sistema, pudemos amostrar 44 dessas transições de estado SWS-REM de ocorrência esparsa (duração REM superior a 40 s) dentro de um período de 24 horas. Além disso, o mapeamento espacial do ISA habilitado pela tecnologia g-SGFET permite resolver a modulação topográfica específica da região do ISA na transição de estado SWS-REM (ver informações de apoio S12). Curiosamente, a potência da banda delta, associada a oscilações lentas, e a potência infralenta mostraram mudanças em direções opostas entre o sono SWS e o sono REM. Embora a potência da banda delta diminua de SWS para REM, associada ao estado cortical dessincronizado, a potência infra-lenta aumenta no REM (ver Figs. 5d, e e Fig. S12 e análise estatística em “Métodos”).
A fim de ilustrar ainda mais a ampla sensibilidade da banda de frequência do sistema de gravação, quantificamos a força da modulação da potência LFP na faixa de frequência lenta (1–15 Hz) pela fase da atividade ISA durante REM e SWS. Curiosamente, a fase ISA modulou significativamente a potência teta (8–9 Hz) durante o sono REM (Fig. 5f-esquerda) e a potência da banda do fuso (9–13 Hz) durante o SWS (Fig. 5f-direita). A força da modulação da fase ISA foi dez vezes maior durante o REM em comparação com o SWS, e a fase ISA de potência máxima do LFP diferiu entre os estados estando próximo do pico (~340°) no REM e fase ascendente (~300°) no SWS. Aproveitando a cobertura de uma seção significativa do manto cortical dorsal por nossa matriz, avaliamos a extensão espacial da modulação da fase ISA da potência LFP através do córtex, com a potência teta durante o REM e a potência do fuso durante o SWS mostrando modulação mais forte na parte posterior da matriz (Fig. 5g). Enquanto as oscilações teta medidas na superfície cortical são geradas pela condução de volume de múltiplos geradores de corrente rítmica teta dos circuitos entorrino-hipocampal, os fusos do sono são gerados por correntes rítmicas de projeções tálamo-corticais para camadas corticais granulares. O fato de que a potência do teta do hipocampo e da banda do fuso cortical é modulada pela fase do ISA derivado da superfície cortical provavelmente reflete a dinâmica infra-lenta global que co-modula os circuitos límbico e cortical. Enquanto o perfil topográfico do poder teta (Fig. 5g) a modulação pela fase ISA é consistente com a localização anatômica dos geradores de corrente teta subjacentes do hipocampo, uma modulação mais forte da potência do fuso nas áreas corticais posteriores pode refletir subcircuitos tálamo-corticais anatômicos que são mais fortemente co-modulados pela dinâmica ISA do que derivados do sinal DC epicortical. Finalmente, testamos se o SNR dos g-SGFETs é suficiente para detectar flutuações na dinâmica LFP de alta frequência em diferentes escalas de tempo e, para este fim, quantificamos a força da modulação da potência gama de ampla faixa (30-200 Hz) tanto pela fase ISA quanto pela fase do ritmo teta durante o sono REM. A potência gama na faixa de 60-120 Hz foi modulada pela fase ISA atingindo potência máxima no pico do ISA (~10°) (Fig. 5h-esquerda) e, consistentemente com o trabalho publicado baseado em registros intracranianos, a alta potência gama (120–150 Hz) foi modulada pela fase teta (Fig. 5h-direita).
Tendo estabelecido que podemos registrar sinais epicorticais seletivos de estado com g-SGFETs em uma série de estados cerebrais/motores, posteriormente demonstramos a aplicabilidade da técnica para vincular comportamento e fisiologia cortical. Para este fim, focamos em um comportamento espontâneo específico e de ocorrência esparsa, empinado nos membros posteriores. A criação é um comportamento exploratório em roedores, que é sensível ao contexto e ao estresse, foi hipotetizado que apoia a amostragem de pontos de referência distais para a construção de um modelo cognitivo do ambiente circundante e está implicado na modulação das interações córtico-hipocampais nas frequências teta e gama. Em geral, devido à ocorrência esporádica e espontânea de eventos de criação, a sua fisiologia neural tem sido menos amplamente investigada com métodos de gravação convencionais em comparação com ações motoras treinadas específicas para tarefas. Tecnologias que combinam estabilidade de gravação de longo prazo, alta resolução espacial, metodologia sem fio e rastreamento 3D preciso do comportamento animal, como apresentado aqui, abrem a porta para a investigação desta classe de fenômenos com grande nível de detalhe. Portanto, aproveitamos a tecnologia apresentada para coletar um grande número de eventos individuais de criação espontânea durante um período completo de 24 horas. Avaliar a assinatura da criação na banda de atividade epicortical gama é de interesse adicional para o nosso estudo, uma vez que pode ser usada para ilustrar as capacidades dos g-SGFETs na faixa LFP de alta frequência. Para detectar de forma robusta episódios de criação, aproveitamos o rastreamento 3D contínuo, detectando eventos de criação (n = 163) com base na elevação da cabeça acima do solo (ver “Métodos” e informações suplementares S6). Embora os eventos de criação tenham ocorrido durante todo o período de registro, a expressão da atividade de criação foi altamente variável ao longo do dia, assim como com a atividade motora geral, variando de 250 s a 0 s gastos em criação por hora (média 43,8 ± 12,1 s, informação suplementar S10). Além disso, os eventos de criação expressaram variabilidade em termos de altura (média 250,6 ± 2,7 mm, ver Fig. 5j e Fig. S10d) e duração (média 5,7 ± 2,8 s, ver Fig. S10e).
Tendo detectado este conjunto de episódios de criação espontânea, procedemos à análise dos espectros de potência da LFP epicórtica, que mostraram alterações distintas associadas à criação nos sinais cerebrais para faixas de frequência específicas. A criação foi associada à supressão da atividade epicortical de alta frequência (90-200 Hz) (Fig. 5i), que também foi observável no nível de teste único em toda a faixa de alturas traseiras (Fig. 5j) e mais proeminentemente observada em mais canais frontais do nosso array (ver informações suplementares S11). Em forte contraste, tal supressão não foi observada na banda gama entre 60 e 70 Hz (ver Fig. 5i e informação suplementar S11).
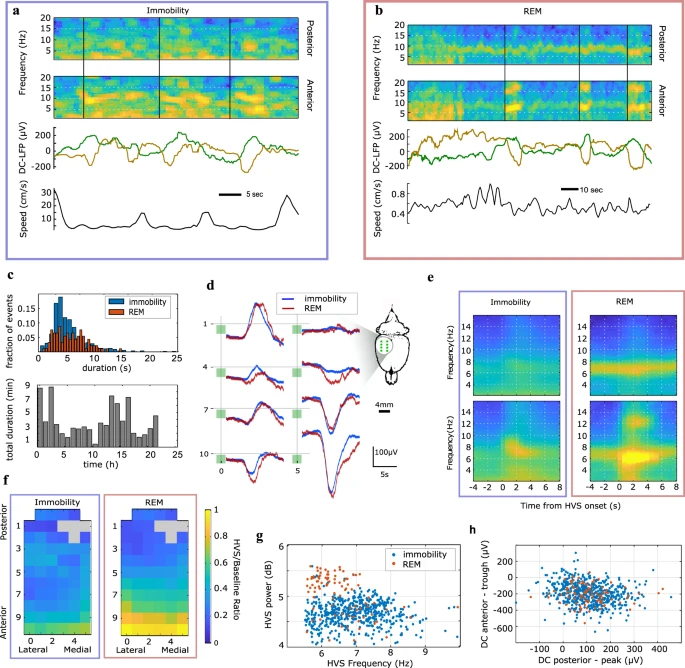
Posteriormente, aproveitamos a capacidade de gravação infra-lenta das matrizes g-SGFET para caracterizar sinais epicorticais AC infra-lentos e espectrais topográficos associados a oscilações raras do fuso de alta tensão (HVS) altamente síncronas, como o mais provável cortical dinâmica associada a grandes correntes infralentas, semelhantes às mostradas durante a atividade epileptiforme em desenvolvimento. Consistente com estudos anteriores, a ocorrência de HVS foi associada principalmente a estados de imobilidade de alerta (IMM) (566 eventos, Fig. 6a), onde o IMM é definido como a interseção entre os estados inativo e acordado. Beneficiando-nos do registro imperturbado de longo prazo permitido pelo nosso sistema, também pudemos amostrar um número significativo de eventos HVS durante o sono REM (92 eventos), onde coexistiram com oscilações teta do hipocampo visíveis nas derivações posteriores (Fig. 6b) . Embora a duração média dos eventos HVS tenha sido comparável na imobilidade e no sono REM (~5 s, Fig. 6c-top), a taxa de eventos HVS detectados variou ao longo do período registrado de 24 horas (Fig. 6c-inferior). Curiosamente, o HVS durante ambos os estados cerebrais foi associado a flutuações infra-lentas transitórias, como visível em exemplos únicos (Fig. 6a, b) e perfis médios (Fig. 6d, e). Especificamente, transientes infra-lentos positivos (fonte suposta) e negativos (sumidouro suposto) em, respectivamente, posições posterior e frontal na matriz coincidiram em duração (mediana 5 s) com dinâmica oscilatória de HVS (Fig. 6c, d, e). Perfis topográficos de potência de pico espectral de HVS foram comparáveis para ambos os estados e mostraram aumento máximo até a linha de base nas derivações frontais sobrepondo o córtex sensório-motor (Fig. 6f). HVSs associados a REM foram, em média, mais lentos e maiores em potência do que aqueles associados à imobilidade (teste de classificação de Wilcoxon, p < 1e-19 para potência e p < 1e-8 para frequência, Fig. 6g). Em contraste, a estrutura espacial e a magnitude das flutuações infra-lentas associadas ao HVS, conforme expresso por flutuações positivas na flutuação posterior e negativa nos canais DC frontais, foram comparáveis para ambos os estados (teste de classificação de Wilcoxon entre IMM e REM, p = 0,5 para magnitude de pico posterior e p = 0,9 para magnitude do vale frontal, Fig. 6h).
Fig. 6: Topografia da dinâmica AC e DC associada a fusos de alta tensão.
a, b exemplos de eventos HVS durante a imobilidade (a) e sono REM (b, inserção mostrando a localização anatômica dos locais de registro DC ECoG). e Espectrogramas AC LFP médios desencadeados no início do HVS durante a imobilidade (esquerda) e sono REM (direita). Os espectrogramas nas posições posterior (superior) e anterior (inferior) do array contrastam o conteúdo espectral associado, respectivamente, às oscilações teta (posterior) e HVS (anterior). Pseudo-cor, potência espectral (a.u.). f Distribuição da magnitude da flutuação DC nas derivações póstero-lateral e frontal-medial para HVS único durante a imobilidade e REM (código de cores como em g).
Embora sejam necessários trabalhos futuros para replicar estas observações num grande grupo de animais, os nossos registros de longo prazo permitiram uma análise quantitativa detalhada de padrões fisiológicos raros e ilustram o poder desta tecnologia. Devido à sua ocorrência e distribuição esparsas e fortemente dependentes do estado em uma ampla faixa de frequência, esses eventos ilustram a classe de fenômenos cujo estudo funcional requer a integração de medições neurais-comportamentais com alta resolução espaço-temporal e grande extensão espaço-temporal em animais livres, conforme possibilitado pelo nosso sistema de eletrofisiologia sem fio.
Discussão
Matrizes de sensores ativos de grafeno representam uma tecnologia emergente em engenharia neural, que demonstrou recentemente um forte potencial para a produção de matrizes de sensores de alta contagem, bem como para detecção neural de banda larga de frequência. Neste artigo apresentamos uma caracterização detalhada de vários aspectos técnicos necessários para sua aplicação real, como a homogeneidade no desempenho dos sensores de grafeno, as especificações exigidas para um headstage dedicado, os limites na sensibilidade dos g-SGFETs ou sua estabilidade crônica e biocompatibilidade in vivo e demonstraram linhas de investigação possibilitadas por suas características técnicas.
Em primeiro lugar, demonstramos o alto rendimento e homogeneidade dos g-SGFETs produzidos em um processo em escala de wafer usando grafeno CVD disponível comercialmente. Esta demonstração representa um marco importante na produção de sondas neurais baseadas em grafeno em escala industrial. Em outra frente, a aplicação de transistores de grafeno para detecção neural também requer o desenvolvimento de equipamentos eletrônicos específicos para polarizar os sensores e converter as correntes medidas do dreno para a fonte em sinais de tensão equivalentes na porta. Neste estudo, apresentamos um headstage sem fio dedicado, que permitiu descrever o impacto do processo de amplificação e digitalização do sinal na sensibilidade do sistema de gravação. Desta maneira, identificamos os desafios no projeto de amplificadores de banda completa, dadas as restrições específicas de energia e peso para aplicações sem fio. Além disso, utilizando um headstage dedicado, demonstramos que a sensibilidade dos sensores ativos de grafeno na banda ISA não é significativamente afetada pelos demais componentes do sistema de aquisição de dados. No entanto, observamos desvios lentos nos sinais medidos in vivo, que foram presumivelmente atribuídos à adsorção de moléculas carregadas no canal de grafeno ou desvios no potencial de referência do eletrodo. Esses desvios foram facilmente eliminados com um filtro passa-alto de 1 mHz; no entanto, experimentos futuros poderiam explorar a funcionalização do canal de grafeno e o uso de eletrodos de referência alternativos para manter um nível de dopagem mais estável.
Além disso, demonstramos a estabilidade dos sensores de grafeno in vivo, caracterizando a sua sensibilidade ao longo de 4 semanas. Para determinar a estabilidade da qualidade do sinal também avaliamos os sinais induzidos pela estimulação bipolar na banda de frequência LFP, demonstrando uma resposta de frequência bastante estável ao longo do tempo. Estes resultados sugerem que a impedância do tecido glial que rodeia o implante não afeta significativamente a sensibilidade dos g-SGFETs in vivo. Para concluir a caracterização da estabilidade do dispositivo, avaliamos a biocompatibilidade dos dispositivos de grafeno ao longo de 12 semanas através de marcadores comportamentais e histológicos. Estes resultados demonstram uma resposta aguda a corpo estranho comparável aos dispositivos à base de platina, que retorna a valores próximos aos dos animais de controle 12 semanas após a implantação.
A validação experimental desta tecnologia abre muitas oportunidades para estudos de eletrofisiologia nos quais é relevante ter acesso a comportamento irrestrito e gravações multicanais com sensibilidade em uma ampla faixa de frequência. Neste estudo, mostramos monitoramento quase contínuo da atividade cerebral em longas sessões de gravação de até 24 horas, o que nos permitiu adquirir grandes amostras de atividade neural em estados comportamentais e cerebrais imperturbados. Em combinação com o rastreamento 3D, a tecnologia sem fio permitiu explorar a relação entre padrões de atividade neural e eventos comportamentais, que ocorrem de forma esparsa ao longo do tempo, com poder estatístico suficiente. Em particular, analisando os sinais LFP epicorticais em relação ao comportamento de criação, observamos modulação diferencial da faixa gama de 60 a 70 Hz e gama alta de 90 a 200 Hz. Embora a atividade de alta frequência entre 90 e 200 Hz tenha sido consistentemente suprimida de maneira topográfica, tal supressão não foi observada para a faixa de 60 a 70 Hz, apontando para uma seletividade comportamental distinta dos mecanismos de circuito subjacentes. A determinação da modulação de potência específica de frequência na faixa gama, mesmo para eventos de criação única, demonstra a alta sensibilidade do sistema no espectro de alta frequência do LFP.
Na faixa de baixa frequência, descobrimos que a potência infra-lenta < 0,2 Hz aumentou significativamente nos locais DC durante os episódios de sono REM em comparação com o SWS e, portanto, mostrou a dependência do estado oposto à potência na banda de oscilação lenta (1–4 Hz). Curiosamente, a dinâmica infra-lenta modulou a potência do ritmo teta e gama durante o REM e com menor força, a potência dos fusos do sono durante o SWS. Embora a modulação da potência LFP nas bandas teta, beta e gama pela fase ISA derivada do sinal BOLD e EEG DC tenha sido demonstrada em humanos e recentemente em ratos anestesiados, o presente resultado é a primeira demonstração de interação entre dinâmica oscilatória fisiologicamente estabelecida, teta, fuso e oscilações gama e ISA derivado de ECoG em roedores em movimento livre. Consistente com o trabalho intracraniano publicado, o volume conduzido teta hipocampal medido na superfície cortical também modulou a potência gama cortical, demonstrando assim que a tecnologia desenvolvida é suficientemente sensível para caracterizar a dinâmica gama conhecida.
Embora a potência da modulação ISA das oscilações do fuso do sono durante o SWS fosse muito menor do que durante o REM, um ritmo tálamo-cortical hipersíncrono relacionado, HVS, foi associado a transientes DC muito maiores. A gravação sem fio de longo prazo permitiu avaliar as características do HVS em uma grande amostra estatística de eventos. A taxa de ocorrência durante diferentes estados cerebrais pode ser determinada ao longo de um período de 24 horas, destacando a sua ocorrência também fora do estado de repouso acordado, no qual são comumente relatados como ocorrendo seletivamente. Especificamente, descobrimos que eles são expressos de forma proeminente durante o sono REM. Tendo estabelecido esta especificidade do estado bimodal, analisamos os eventos de HVS separadamente para a imobilidade em vigília e o sono REM. A análise topográfica da potência de pico do HVS demonstrou que a preponderância cortical sensório-motora para essas oscilações é comparável para esses dois estados. Em contraste, o grande tamanho da amostra de eventos em ambos os estados permitiu identificar uma diferença significativa tanto no conteúdo de frequência quanto na potência do HVS entre esses dois estados cerebrais. Além disso, as capacidades de mapear simultaneamente padrões ISA permitiram determinar a estrutura topográfica distinta de componentes de frequência infra-lenta espacialmente específicos associados ao HVS, mostrando a inversão de fase ao longo do eixo ântero-posterior. É importante ressaltar que essas características do ISA foram conservadas entre o sono REM e a imobilidade acordada,
Trabalhos futuros são necessários para replicar os resultados apresentados em uma grande coorte de animais, acompanhá-los longitudinalmente e relacionar o padrão de superfície aos geradores teta intra-laminar e subcortical, fuso, gama e HVS. Embora tenhamos focado a atenção nos padrões ISA epicorticais, a análise de sua correlação com a dinâmica do ISA através das lâminas corticais poderia fornecer informações importantes sobre a origem e as implicações do ISA. Uma estratégia promissora nessa direção é combinar as matrizes epicorticais aqui apresentadas com sondas de profundidade baseadas em grafeno. Futuras gravações crônicas de sinais LFP profundos e em grande escala através de comportamentos e estados comportamentais em animais que se movem livremente e sem restrições estabelecerão as bases para um novo passo qualitativo na investigação da dinâmica cerebral, desde frequências infra-lentas até frequências muito rápidas das origens da dinâmica ISA no contexto de estados de repouso e redes de modo padrão e suas ligações com dinâmicas cerebrais mais rápidas.
Em resumo, a avaliação completa in vitro e in vivo das capacidades de detecção e gravação a longo prazo dos sensores ativos de grafeno a partir de uma perspectiva de sistema demonstra a maturidade desta tecnologia e apoia a sua aplicação para o estudo de ISA sem sacrificar componentes LFP de alta frequência. Nessa direção, avaliamos com sucesso os padrões ISA durante estados cerebrais distintos e a correlação de oscilações de alta frequência com comportamentos específicos de ocorrência esparsa. Nossos resultados representam um passo importante em direção à ampla implementação de matrizes de sensores ativos de grafeno para pesquisas em neurociências, oferecendo uma tecnologia de detecção estável e biocompatível para mapeamento de longo prazo da atividade cerebral epicórtica de ampla banda de frequência durante o comportamento espontâneo.
Métodos
Fabricação de matrizes g-SGFET
Matrizes de g-SGFETs e dispositivos para biocompatibilidade foram fabricadas em um filme de poliimida de 10 μm de espessura (PI-2611, HD MicroSystems) revestido em um wafer de Si/SiO2 4” e cozido a 350 °C. A poli-imida foi escolhida como substrato devido à sua estabilidade termoxidativa, alta resistência mecânica, propriedades isolantes e resistência química, bem como sua biocompatibilidade esperada e estabilidade previamente relatada para implantes crônicos. Uma primeira camada metálica (10 nm de Ti/100 nm de Au) foi depositada por vapor de feixe de elétrons em um AZ 5412E negativo previamente fotodefinido (Clariant, Alemanha) e depois estruturada por um processo de decolagem. Posteriormente, o grafeno cultivado por deposição química de vapor em Cu foi transferido (processo feito pela Graphenea s.a.). Nos dispositivos de platina para estudos de biocompatibilidade, outra fotolitografia, evaporação e decolagem do metal seguiram a primeira. O grafeno foi então modelado por plasma de oxigênio (50 sccm, 300 W por 1 min) em um ataque iônico reativo (RIE). A resistência fotodefinível utilizada para proteger o grafeno na região do canal foi a HIPR 6512, escolhida para minimizar o nível de contaminação. Após a gravação do grafeno, uma segunda camada metálica foi padronizada nos contatos seguindo o mesmo procedimento da primeira camada. A etapa de levantamento foi seguida por um recozimento em ultra-alto vácuo para melhorar a resistência de contato e eliminar resíduos de resistência do canal de grafeno. Posteriormente, os transistores foram isolados com um fotorresiste epóxi SU-8 fotodefinível de 3 µm de espessura (SU-8 2005 Microchem), mantendo descoberta a área ativa do canal dos transistores. O fotorresistente SU-8 foi escolhido como material isolante por ser fotodefinível e porque seu uso em implantes crônicos já foi relatado anteriormente. O uso de um polímero de passivação fotodefinível é necessário na atual tecnologia de grafeno porque a gravação da camada de passivação também gravaria o canal de grafeno subjacente. O substrato de poli-imida foi estruturado em um processo de ataque iônico reativo usando uma espessa camada fotorresistente positiva para AZ9260 (Clariant) como máscara de ataque. As sondas neurais foram então retiradas do wafer e colocadas em um conector de força de inserção zero para fazer interface com nossa instrumentação eletrônica personalizada. Finalmente, os dispositivos foram enxaguados em etanol para eliminar resíduos de resistência remanescentes no canal de grafeno.
Avaliação do acoplamento fase-amplitude
A inversão de sinal observada entre canais na banda de frequência infralenta (0,005–0,05 Hz) foi avaliada quantitativamente calculando a densidade de probabilidade da amplitude de um sinal em função de sua fase em relação a um segundo sinal. Para estimar a fase entre os dois sinais, a transformada de Hilbert de cada um deles foi calculada usando a biblioteca python scipy e calculada a diferença entre suas fases. Um histograma bidimensional foi então usado para expressar a densidade de probabilidade da amplitude do sinal no espaço amplitude-fase (Fig. 3 c).
Aprovação ética e manejo de animais
As experiências in vivo estiveram de acordo com as diretrizes da União Europeia sobre a proteção dos vertebrados utilizados para experimentação (Diretiva 2010/63/UE do Parlamento Europeu e do Conselho de 22 de setembro de 2010). Experimentos eletrofisiológicos com ratos Long Evans foram realizados de acordo com a Lei Alemã de Proteção de Animais (TierSchG) e foram aprovados pelas autoridades locais (ROB-55.2-2532.Vet_02-16-170). Procedimentos experimentais utilizando ratos Sprague Dawley para avaliação de biocompatibilidade foram realizados de acordo com a Lei de Animais (Procedimentos Científicos) do Reino Unido de 1986 e aprovados pelo Home Office e pelo Animal Ethical Review Group local, Universidade de Manchester. Os ratos foram mantidos em condições padrão (temperatura ambiente 22 ± 2 °C, ciclo claro-escuro de 12:12 h, luzes acesas às 10h), com comida e água disponíveis ad libitum.
Implantação de matrizes de sensores de grafeno para medições eletrofisiológicas
Conforme descrito anteriormente em Garcia-Cortadella et. al., um rato Long Evans adulto, pesando 580 g, foi anestesiado com MMF (Midazolam 2 mg/kg, Medetomidina 0,15 mg/kg, Fentanil 0,005 mg/kg). 1 h depois, indução com MMF Isoflurano foi suplementado a 1% para manter o rato anestesiado e Metamizol foi administrado a 110 mg/kg. A região póstero-dorsal da cabeça foi raspada, a pele desinfetada localmente com iodopovidona e infiltrada subcutaneamente com anestésico local bupivacaína. A pele foi então incisada e o crânio dorsal limpo cuidadosamente por dissecção romba. O crânio seco foi coberto com adesivo de cura UV Optibond (Kerr) e um anel de base impresso em 3D foi ancorado ao crânio com parafusos e cimento Metabond (Parkell).
Craniotomias simétricas com largura máxima de 5 mm foram realizadas bilateralmente, estendendo-se entre +2 mm e -8 mm em relação ao Bregma no eixo ântero-posterior. A dura-máter foi incisada e removida dentro dessas craniotomias. Uma nova craniotomia de 1 × 1 mm foi realizada sobre o cerebelo. Todas as craniotomias foram cobertas com polidimetilsiloxano pré-polimerizado (PDMS) (Sylgard 184, Dow Corning, EUA) com proporção de mistura 1:10 e seladas com Vetbond (Animal Care Products, EUA). As margens da pele ao redor do implante foram suturadas e o implante fechado com uma tampa protetora.
Após 1 semana de recuperação, o arranjo g-SGFET foi implantado sob anestesia com isoflurano (5% de indução e 1% de manutenção). Após abertura parcial e agitação lateral do polímero que cobre o hemisfério direito, o arranjo foi colocado na superfície pial posicionada de modo a cobrir a face posterior do hemisfério direito (ca -7 a -2 mm do bregma). Além disso, dois fios Pt-Ir foram implantados em cada lado do arranjo g-SGFET. Um proximal à matriz, o outro distalmente no hemisfério oposto. A tampa de polímero foi colocada de volta na posição com o cabo flexível do conjunto g-SGFET saindo pela fenda restante. Uma segunda cobertura de PDMS foi utilizada para cobrir tanto o polímero inciso quanto a matriz, ancorada ao crânio com Vetbond e Evoflow (Ivoclar Vivadent, Liechtenstein) e selada com gel de silicone 3-4680 (Dow Corning, EUA). Finalmente, um eletrodo Ag/AgCl foi colocado em contato com o cerebelo como referência para o registro da atividade neural.
Implantação dos dispositivos de grafeno, platina e PI para avaliação de biocompatibilidade
Ratos Sprague Dawley (200-280 g) foram anestesiados usando inalação de isoflurano (normalmente a 3,5% para indução e entre 1,5 e 2,5% para manutenção) em oxigênio a 100%. O topo da cabeça do animal foi raspado e o animal foi posicionado dentro de uma moldura estereotáxica com fixação de dentes e barras auriculares. Os animais foram colocados sobre uma manta aquecida, com um oxímetro de pulso acoplado à pata e uma sonda retal inserida para monitorar a temperatura corporal. O gel líquido Viscotears (Bausch & Lomb, Reino Unido) foi aplicado nos olhos para proteção durante o procedimento. A profundidade da anestesia foi confirmada e mantida durante toda a cirurgia pela ausência de reflexo pedal. Todos os animais experimentais receberam injeção subcutânea de buprenorfina (0,03 mg/kg). A cabeça foi esfregada com iodo e uma grande aba de pele foi removida para expor o crânio, mas não o músculo temporal. O periósteo foi removido com raspador ósseo. A pele ao redor do perímetro do tecido removido foi colada ao osso usando adesivo de tecido Vetbond (3 M, UK). Uma craniotomia (~4 mm x 6 mm) foi realizada utilizando uma microbroca cirúrgica de alta velocidade. Como referência posterior para a craniotomia foi utilizado Lambda, que foi posicionado pelo menos 1 mm lateral à linha média, para evitar o seio sagital. A região de perfuração foi enxaguada regularmente com solução salina para evitar danos causados pelo calor. Uma vez que o osso ao redor da borda da craniotomia estava suficientemente fino, todas as aparas ósseas e outros detritos foram removidos usando ar comprimido e o retalho ósseo foi removido suavemente. A superfície cortical foi mantida úmida com solução de Ringer. Uma agulha fina com a ponta dobrada em um ângulo de 90° foi usada para levantar suavemente a dura-máter da superfície cortical e outra agulha foi usada para criar uma fenda na dura-máter, cuidadosamente posicionada para evitar vasos sanguíneos. Uma bolsa foi criada levantando-se a dura-máter próxima à abertura com uma pinça fina e o dispositivo foi cuidadosamente colocado na superfície cortical. A dura-máter foi então reposicionada para manter o dispositivo no lugar. Uma janela de vidro (UQG Optics, UK) de tamanho apropriado foi posicionada para preencher a craniotomia e fixada com cimento dentário (Superbond C&B, Prestige Dental). Os animais receberam injeção subcutânea de solução salina 0,9% (1 ml) e foram colocados em gaiola de recuperação até o efeito anestésico passar. Uma bolsa foi criada levantando-se a dura-máter próxima à abertura com uma pinça fina e o dispositivo foi cuidadosamente colocado na superfície cortical. A dura-máter foi então reposicionada para manter o dispositivo no lugar. Uma janela de vidro (UQG Optics, UK) de tamanho apropriado foi posicionada para preencher a craniotomia e fixada com cimento dentário (Superbond C&B, Prestige Dental). Os animais receberam injeção subcutânea de solução salina 0,9% (1 ml) e foram colocados em gaiola de recuperação até o efeito anestésico passar. Uma bolsa foi criada levantando-se a dura-máter próxima à abertura com uma pinça fina e o dispositivo foi cuidadosamente colocado na superfície cortical. A dura-máter foi então reposicionada para manter o dispositivo no lugar. Uma janela de vidro (UQG Optics, UK) de tamanho apropriado foi posicionada para preencher a craniotomia e fixada com cimento dentário (Superbond C&B, Prestige Dental). Os animais receberam injeção subcutânea de solução salina 0,9% (1 ml) e foram colocados em gaiola de recuperação até o efeito anestésico passar.
Testes comportamentais para avaliação de biocompatibilidade
Todos os animais tiveram linhas de base comportamentais pré-cirúrgicas tomadas com 5 semanas de idade. Uma semana depois, todos os animais foram distribuídos em um dos cinco grupos; eletrodo de grafeno, eletrodo de platina, eletrodo branco, cirurgia simulada (sem eletrodo implantado) ou ingênua (sem cirurgia). Os animais foram então testados em um ou dois momentos – 2 semanas, 2 e 6 semanas ou 6 e 12 semanas após a cirurgia. Os pontos temporais foram escolhidos de acordo com as definições da ISO 10993; onde a exposição prolongada é classificada como >24 horas, mas <30 dias, e a exposição permanente é definida como >30 dias (ISO 10993-6:2007).
Antes da primeira exposição à NOR, os ratos foram colocados nas arenas vazias no dia anterior ao teste durante 20 min com os seus companheiros de gaiola para fins de aclimatação. As caixas quadradas de Plexiglas (medindo 52 cm por 52 cm na base e 30 cm de altura) tinham piso branco e paredes pretas. Os animais foram aclimatados à arena NOR antes do início dos experimentos, colocando-os na arena por 3 min enquanto não havia objetos dentro da arena. O teste NOR compreende uma tentativa de treinamento e teste, separados por um período entre tentativas. No treino, dois objetos idênticos foram colocados dentro da arena, como duas garrafas do mesmo formato e tamanho. Na sessão de testes, dois novos objetos foram colocados na arena, um objeto idêntico ao da sessão de treinamento e um objeto completamente novo, como uma lata. Para sessões de treinamento, os animais foram colocados na arena e deixados explorar por 3 min, antes de retornarem à gaiola. Os animais foram deixados na gaiola por 30 minutos, antes de serem colocados na arena para a sessão de testes, permanecendo novamente na arena para explorar livremente por 3 minutos. O tempo que o animal passou interagindo com os objetos foi medido tanto nos testes de treinamento quanto nos testes. Num animal saudável, o animal deve passar mais tempo interagindo com o novo objeto durante a sessão de testes. Idealmente, estes testes não devem ser utilizados >3 vezes para qualquer animal e, portanto, os animais no grupo de implantação de 12 semanas foram testados para NOR no início do estudo e depois às 6 e 12 semanas após a implantação. Todos os outros animais foram testados em todos os momentos selecionados disponíveis antes do sacrifício.
Vídeos de testes de NOR foram pontuados manualmente por pesquisadores cegos usando um cronômetro online (//jackrrivers.com/program/). Os animais foram classificados como interagindo com um objeto se seu nariz ou patas tocassem o objeto. A quantidade de tempo gasto interagindo com os dois objetos foi analisada, e uma razão de discriminação foi determinada dividindo o tempo gasto interagindo com o objeto novo pelo tempo gasto interagindo com o objeto conhecido. Uma razão de discriminação >0,5 indicou que um animal tinha preferência pelo objeto novo, um sinal de cognição normal.
Coleta e processamento de tecidos
Às 2 semanas, 6 semanas ou 12 semanas após a implantação dos dispositivos, os animais foram abatidos utilizando um método apropriado para o tipo de análise subsequente. Para histologia, os animais foram submetidos à fixação de perfusão com solução salina heparinizada, seguida de paraformaldeído a 4% (PFA; Sigma-Aldrich, Reino Unido; 441244) em solução salina tamponada com fosfato (Sigma-Aldrich, Reino Unido; D8537). O tecido foi armazenado por no mínimo 24 horas em PFA, transferido para uma solução de sacarose por 48 horas e congelado antes da criosecção de 40 seções a 25 µm por animal. As criosecções foram coradas para um dos três marcadores: (i) molécula adaptadora de ligação de cálcio ionizado 1 (Iba1) para quantificar a população microglial, (ii) coloração terminal de desoxinucleotidil transferase dUTP nick-end labeling (TUNEL) para avaliar a apoptose, ou (iii) hemotixilina e eosina (H&E) para avaliar a morfologia macroscópica do tecido cerebral. As seções de tecido foram bloqueadas em soro de cabra a 5% em PBS com triton-X a 0,1%, antes da incubação com anticorpo primário Iba1 (1:200, 019-19741, Wako) durante a noite. Um anticorpo secundário Alexa 594 anti-coelho de cabra (1: 1000, A11012, Invitrogen) foi utilizado para visualização. Para tecido corado por imunofluorescência, foi realizada uma contracoloração DAPI antes da montagem das lâminas usando o suporte para montagem ProLong Gold (P10144, ThermoFisher).
Para a coloração TUNEL, as instruções do fabricante foram seguidas utilizando um sistema DeadEnd™ Colorimetric TUNEL (G7360, Promega). Após a visualização com diaminobenzidina (DAB) da coloração TUNEL, as lâminas foram contrastadas com verde de metila (solução aquosa a 0,1% p/v, Alfa Aesar). A coloração H&E foi realizada como padrão, usando um tempo de coloração com hematoxilina de 1 min, seguido por um enxágue com ácido acético e um tempo de coloração com eosina de 30 segundos. As lâminas para coloração TUNEL e H&E foram montadas usando agente de montagem DPX (06522, Sigma-Aldrich). Os slides foram visualizados usando o scanner de slides 3D Histec Pannoramic250 e as imagens analisadas usando CaseViewer (versão 2.2, 3DHistech Ltd). As células positivas para TUNEL foram contadas e calculadas a média através da superfície cortical em quarenta secções de 25 µm por hemisfério. As células microgliais foram classificadas individualmente em uma das quatro morfologias; Grau 0 (repouso/ramificado), Grau 1 (desramificação/reramificação), Grau 2 (ativado/amebóide) ou Grau 3 (agrupado e ativado) conforme descrito anteriormente. A ativação foi determinada como uma porcentagem do total de células microgliais, que eram de Grau 3 ou 4.
Para ELISA, os animais foram abatidos pelo aumento da concentração de CO2, antes da realização da punção cardíaca para extração de sangue. O tecido cerebral foi extraído, congelado em nitrogênio líquido e armazenado a -80 °C até uso posterior. O sangue extraído foi coletado em um tubo de coleta de sangue (Vacutainer, Becton Dickson, Reino Unido) e deixado coagular em temperatura ambiente por 15 a 30 minutos. O tubo foi centrifugado a 5.000 RPM por 10 min a 4 °C, e o sobrenadante de soro resultante foi coletado e armazenado a -80 °C até uso posterior. Não havia amostras de soro suficientes para serem analisadas no grupo de controle ingênuo, portanto este grupo foi excluído da análise. O tecido cerebral foi lisado pela adição de nitrogênio líquido e moagem do tecido para criar um pó, ao qual foi adicionado tampão de lise NP-40 (NaCl 150 mM, Tric-Cl 50 mM, substituto Nonidet P40 a 1%, Fluka, pH ajustado para 7,4) contendo inibidor de protease e fosfatase (Halt™ Protease and Phosphatase Inhibitor Cocktail, ThermoFisher Scientific) foi adicionado ao tecido. As amostras foram centrifugadas a 5.000 RPM por 10 min e o sobrenadante armazenado a -80 °C até uso posterior. Foram utilizados kits ELISA para quatro citocinas, IL-17a (437904, Biolegend), IFN-γ (439007, Biolegend), TNF-α (438204, Biolegend) e IL-6 (437107, Biolegend). As instruções do fabricante foram seguidas para todos os quatro kits.
Captura de movimento e classificação de estados comportamentais
O rato foi registrado por até 24 horas durante comportamento espontâneo em uma arena de gravação de 100 × 100 cm à qual estava pré-habituado. Durante a sessão de gravação teve acesso ad libitum a comida e água. A bateria do sistema sem fio foi trocada uma vez a cada 6 horas. Um sistema de captura de movimento (Mocap) (Optitrack) utilizando marcadores reflexivos passivos e 8 câmeras foi utilizado para rastrear o movimento da cabeça do animal no espaço tridimensional. Quatro marcadores reflexivos foram ancorados na tampa protetora e sua posição foi calculada para inferir a posição em 3D e a orientação da cabeça. A velocidade instantânea em 3D foi calculada como derivada do tempo do módulo das coordenadas espaciais. O software Motive 2.2 foi utilizado para a análise dos dados do Mocap.
Para a classificação do comportamento como ativo ou inativo, os períodos em que a velocidade de avanço excedeu 100 mm/s foram rotulados como ativos. Em uma segunda etapa, os períodos ativos inferiores a 5 segundos foram ignorados, enquanto os intervalos nos períodos ativos inferiores a 5 s foram concatenados com o estado ativo vizinho. Os pontos de tempo que não se enquadravam nesta definição de ativos foram rotulados como inativos. A proporção de períodos ativos e inativos variou substancialmente ao longo do período total de registro (entre 6,6% e 88,0% ativos por hora, média de 40,2% ± 4,7% ativos por hora).
Os eventos traseiros foram definidos como pequenas elevações da cabeça a alturas que exigem que o animal fique em pé sobre os membros posteriores. Após a inspeção visual das elevações z ao longo das gravações, foi determinado um limite de elevação de 200 mm do solo para separar efetivamente os inícios/deslocamentos de elevação pontuados das variações contínuas de altura nas posições z mais baixas (ver informações suplementares S10). Embora os estados ativo e inativo tenham sido definidos como mutuamente exclusivos, os eventos traseiros foram considerados um substrato do estado motor ativo.
Processamento e análise de sinais neurais
O headstage sem fio foi controlado usando o software Multi Channel Experimenter 2.12.1 e os dados gravados foram convertidos para o formato HDF5 usando o Multi Channel Data Manager 1.13.1. Os dados neurais foram calibrados de acordo com a transcondutância de g-SGFETs usando scripts Python 2.7 e exportados para o software Neuroscope para exploração de dados (ver declaração de disponibilidade de dados e código). A análise dos sinais neurais foi realizada usando scripts Matlab 2016b (ver declaração de disponibilidade de código).
Classificação dos estados cerebrais
Dois canais da matriz epicortical foram escolhidos para a separação dos estados cerebrais. Um canal foi selecionado da área posterior da matriz, supostamente sobrepondo-se à formação do hipocampo e exibindo oscilações teta proeminentes. Um segundo canal foi selecionado na área frontal, gravando na região e vizinhança do córtex somatossensorial, onde os fusos de alta voltagem são expressos de forma mais proeminente. Os espectros de potência foram calculados em sinais LFP esbranquiçados na faixa de 1 a 200 Hz usando métodos multitaper usando janelas de 4 s em passos deslizantes de 0,5 s. Primeiro, os estados de onda lenta (SW) foram identificados como períodos em que o escore z da potência somada do delta (1–4 Hz), faixas alfa-beta (10–25 Hz) excedeu -0,1. Gaps menores que 5 s foram concatenados com períodos vizinhos.
Os estados SW coincidentes com o estado motor inativo e a distância temporal > 10 s do último evento anterior do fuso de alta tensão (HVS) foram definidos como sono de ondas lentas (SWS). Seguindo a literatura anterior, assumimos incompatibilidade entre HVS e sono profundo de ondas lentas em ratos Long Evans não anestesiados. Os HVS têm frequência próxima às oscilações teta, mas diferem marcadamente na expressão de múltiplos harmônicos superiores devido ao seu formato de onda fortemente não senoidal. Devido a este fato, a potência espectral na banda de frequência de 20 a 50 Hz no canal de referência HVS foi utilizada para detectar seletivamente episódios de HVS e distingui-los da atividade teta. A média dos espectros de potência multitaper de 20 a 50 Hz foi calculada e posteriormente pontuada com z. Períodos com valores z de pontuação superiores a 0,7 foram rotulados como HVS. Períodos candidatos de HVS menores que 1 s foram ignorados para minimizar falsos positivos de transientes ocasionais de ondas únicas e agudas de natureza fisiológica indeterminada. Perfis espectrais dos eventos individuais de HVS foram classificados post-hoc para remover a contaminação por artefatos. O início e o deslocamento da potência de pico, frequência instantânea e potência do primeiro pico espectral foram extraídos de cada evento.
Os estados teta foram definidos com base na relação entre a potência nas faixas teta (5–9,5 Hz) e delta (2–4 Hz) no canal de referência teta. Lacunas menores que 10 s foram concatenadas com períodos Teta vizinhos. Theta coincidindo com um estado motor inativo foi denominado Theta inativo. Todos os períodos Teta Inativos que foram precedidos por um estado SW dentro de 1 segundo e que duraram mais de 5 segundos foram considerados sono REM. Todos os períodos Theta restantes foram considerados Theta Acordado. Finalmente, todos os períodos que não eram nem SWS nem REM nem Theta Acordado foram definidos como Não-theta Acordado. Deve-se notar que a existência de microestados de baixa amplitude durante o sono NREM foi descrita anteriormente. Resta determinar até que ponto um subconjunto de períodos com baixa amplitude na faixa SW atribuído a Não-theta Acordado neste estudo mapeia estados definidos como microestados de sono de baixa atividade por Miyawaki e colegas.
Todos os estados foram considerados mutuamente exclusivos, com exceção do HVS, que foi considerado um evento que ocorreu durante, mas não interrompeu, os estados de fundo em curso. Portanto, para cada episódio de HVS, os estados cerebrais imediatamente anteriores e seguintes foram mesclados se pertencessem ao mesmo estado. Toda a análise espectral foi realizada usando a implementação personalizada do Matlab de estimativa multitaper. A análise do desempenho do g-SGFET foi feita em Python. A análise da dinâmica cerebral ISA limitou-se à imobilidade e ao sono REM, para os quais a influência potencial dos artefatos de movimento nas flutuações infra-lentas poderia ser descartada.
Análise estatística
Para a avaliação do rendimento e homogeneidade do desempenho dos g-SGFETs, 9 sondas neurais com 64 g-SGFETs cada foram caracterizadas in vitro. Esses dados são plotados nos boxplots da Fig. 2, as caixas se estendem do quartil inferior ao superior, com uma linha na mediana. Os bigodes estendem-se 1,5 vezes o intervalo interquartil e os pontos de dados além dos bigodes são indicados por um ponto. A avaliação longitudinal da estabilidade dos g-SGFETs in vivo foi realizada com um conjunto de 64 canais implantado no córtex de um rato. Os boxplots mostrados na Fig. 3 são definidos como aqueles na Fig. 2. Nos painéis a e e da Fig. 3, a amostra estatística são todos 8 g-SGFET conectados aos canais acoplados a DC do headstage. Painéis d e f da Fig. 3 correspondem a todos os 64 g-SGFETs da matriz. Finalmente, o painel g mostra a resposta normalizada dos 10 g-SGFETs nas posições sob o campo elétrico induzido mais alto durante a estimulação bipolar.
Para avaliação de biocompatibilidade, três tipos de dispositivos; platina, grafeno e poli-imida (em branco) foram fabricados. Os ratos de cada um desses grupos foram implantados com um dos três tipos de dispositivos no córtex parietal do cérebro. Um quarto grupo de animais realizou a cirurgia completa sem a implantação de qualquer dispositivo (controle simulado) e um quinto grupo (ingênuo) não realizou cirurgia. Para o teste NOR, o número de ratos utilizados foi n = 7 para todos os grupos em todos os momentos, exceto 12 semanas, que teve n = 3–7 dependendo do grupo. Para detecção de citocinas no tecido cerebral, o número de ratos foi n = 4 às 2 e 6 semanas, e n = 3 às 12 semanas após a implantação. Para ativação microglial o número de ratos foi n = 3 às 2 e 12 semanas e n = 2 às 6 semanas (ou 3 para o hemisfério contralateral). Em todos os casos, o hemisfério contralateral também foi avaliado como controle. Os dados onde n = 3 ou superior foram analisados utilizando uma ANOVA bidirecional para comparar todos os momentos e intervenções. As comparações múltiplas de Dunnett foram então realizadas em cada momento comparando cada intervenção cirúrgica com o controle. * p < 0,05, ** p < 0,005, *** p < 0,001, **** p < 0,0001 são indicados para cada intervenção cirúrgica na Fig 4.
A medição da modulação da atividade gama durante a criação foi avaliada para 163 eventos de criação medidos no decorrer de um registro de 24 horas em um rato. HVS também foram medidos durante a mesma gravação de 24 horas. Quinhentos e sessenta e seis eventos foram detectados durante a imobilidade e 92 eventos durante o sono REM. As diferenças no conteúdo espectral do HVS durante estados distintos (IMM e REM) foram avaliadas por um teste de ranksum de Wilcoxon (os valores de p estão indicados no texto principal). Os dados eletrofisiológicos apresentados correspondem a um rato. A grande amostra estatística de eventos permite ilustrar as capacidades da tecnologia baseada em grafeno, no entanto, a interpretação destes resultados deve estar sujeita à variabilidade entre medições e animais.
A modulação da potência ISA pelo estado REM vs. SWS foi avaliada de duas maneiras: primeiro, para o período diretamente próximo à transição de estado (-30 a 30 s próximo ao início do REM). Em segundo lugar, avaliamos o poder do ISA em ambos os estados durante toda a sua duração, não apenas na transição SWS-REM. A comparação de potência ISA entre os estados REM vs. SWS foi restrita aos 44 episódios REM com duração superior a 40 s (ver Informação Suplementar S12B). Para testar as mudanças específicas de frequência ao longo da transição de estado, comparamos as distribuições da potência espectral mediana entre os testes para os 30 s pré vs. pós-transição SWS-REM para cada compartimento de frequência. A significância foi avaliada pelo teste de permutação para cada compartimento de frequência (n = 1000 permutações, ver Fig. 5d para exemplo de canal e informações suplementares S12C para todos os canais DC em funcionamento). O aumento do ISA e a diminuição simultânea da potência de 1–4 Hz durante a transição SWS-REM é significativo após o teste de permutação (n = 1000 permutações) em todos os canais DC, exceto um canal excluído, o mesmo que para avaliação longitudinal na Fig 3a, e, devido a sinal-ruído fraco (Informação Suplementar S12C). Em segundo lugar, testamos diferenças estatísticas entre distribuições da potência integrada na banda ISA (0,01–0,1 Hz) nos estados SWS e REM usando o teste de soma de classificação de Wilcoxon (ver Fig. 5e, resultados de teste para cada canal em Informações Suplementares S12D).
A modulação da potência LFP pela fase ISA e LFP derivada do sinal DC foi quantificada usando o comprimento resultante ponderado pela potência de frequência rápida instantânea dos vetores de fase de frequência lenta instantânea normalizados pela potência LFP média na respectiva banda 72 para a qual a magnitude reflete a força de Modulação de potência LFP para uma fase preferida do ISA ou LFP. A fase ISA e LFP e a potência LFP foram calculadas como ângulo e valor absoluto do sinal analítico dos respectivos sinais dos canais AC e DC que foram filtrados passa-faixa, com largura de banda de 0,04 e 0,4 Hz, respectivamente. A significância da modulação foi testada com base em 1000 pares substitutos de fase-potência, deslocados aleatoriamente entre si em até 100 s. O valor P empírico resultante foi corrigido seguindo o procedimento de controle de taxa de descoberta falsa na taxa de erro de 0,001. Para construir mapas topográficos da modulação da banda de potência teta e do fuso, usamos a força média de modulação para a banda de potência LFP 8–9 Hz (teta) e 10–14 Hz (banda do fuso), e a frequência de fase ISA de 0,05-0,1 Hz calculada para cada canal AC (alimentação LFP) e um canal DC fronto-medial (fase ISA).
s41467-020-20546-w