Abstrato
As vacinas reduziram a transmissão e a gravidade do COVID-19, mas ainda há escassez de tratamento eficaz para cepas resistentes a medicamentos e indivíduos mais suscetíveis, principalmente aqueles que apresentam uma resposta vacinal abaixo do ideal, devido a condições de saúde subjacentes ou terapias concomitantes. O reaproveitamento de medicamentos existentes é um método oportuno, seguro e cientificamente robusto para o tratamento de pandemias, como o COVID-19. Aqui, revisamos a farmacologia e a justificativa científica para reaproveitar a niclosamida, um anti-helmíntico já em uso humano como tratamento para COVID-19. Além disso, sua potente atividade antiviral, a niclosamida demonstrou efeitos pleiotrópicos anti-inflamatórios, antibacterianos, broncodilatadores e anticancerígenos em numerosos estudos pré-clínicos e clínicos iniciais. As vantagens e a justificativa para formulações nebulizadas e intranasais de niclosamida, que visam o local da infecção primária no COVID-19, são revisadas. Por fim, apresentamos uma visão geral dos ensaios clínicos em andamento que investigam a niclosamida como um candidato promissor contra o SARS-CoV-2.
Abreviaturas
C max – Concentração máxima
CoV – Coronavírus
FDA – Administração de Alimentos e Medicamentos
MRSA – Staphylococcus aureus resistente à meticilina
mTORC – Alvo mecanicista do complexo de rapamicina
NCT – Número nacional de ClinicalTrials.gov
SARS-CoV-2 – Síndrome respiratória aguda grave coronavírus-2
SoC – Padrão de atendimento
1. INTRODUÇÃO
O surto da doença de coronavírus 2019 (COVID-19) causado pela síndrome respiratória aguda grave coronavírus 2 (SARS-CoV-2) foi declarado uma pandemia pela Organização Mundial da Saúde (OMS) em 11 de março de 2020. Seguiu-se um rápido aumento no número de casos de COVID-19 (Paules et al., 2020) e, em janeiro de 2022, houve mais de 296 milhões de casos de COVID-19 e 5,5 milhões de mortes (OMS, 2022). Os sistemas de saúde foram globalmente sobrecarregados (Miller et al., 2020) e estudos de projeção preveem que a dinâmica de transmissão rápida estará potencialmente em jogo até 2025 (Kissler et al., 2020). As vacinas de vetor viral e mRNA provaram ser um sucesso esmagador no controle da pandemia (Rotshild et al., 2021) e até janeiro de 2022, quase 9 bilhões de doses de vacinas foram administradas (OMS, 2022). No entanto, é improvável que as vacinas sozinhas sejam suficientes em populações de pacientes vulneráveis (ou seja, idosos, câncer, deficiências imunológicas primárias, receptores de transplante ou diálise) e os pacientes que recebem tratamentos médicos concomitantes que suprimem o sistema imunológico podem não apresentar uma resposta de anticorpos satisfatória. Além disso, é improvável que a imunidade de rebanho global seja alcançada devido à evolução constante de novas variantes preocupantes e ao declínio das respostas naturais ou estimuladas de anticorpos ao longo do tempo. A logística geopolítica e o nacionalismo das vacinas também tornam improvável que essas vacinas estejam disponíveis de forma igualitária em todo o mundo por mais alguns anos. Portanto, estratégias paralelas, como novas intervenções terapêuticas eficazes, devem ser desenvolvidas rapidamente. Esforços de pesquisa intensivos e colaborativos resultaram em várias opções de tratamento para o COVID-19. Os antivirais, remdesivir (Beigel et al., 2020 ) e molnupiravir (Jayk Bernal et al., 2021 ), anticorpos monoclonais neutralizantes, casirivimab, imdevimab (Somersan-Karakaya et al., 2021 ) e sotrovimab (Gupta et al., 2021 ) , anticorpos IL-6 , tocilizumab (Gordon et al., 2021 ) al., 2021 ; RECOVERY Collaborative Group, 2021) e dexametasona (Horby et al., 2021) são as principais opções de tratamento atualmente aprovadas para COVID-19, mas podem resultar em efeitos adversos sistêmicos graves e afetar apenas moderadamente os resultados clínicos. As limitações dessas terapias destacam a necessidade de desenvolvimento contínuo de medicamentos que salvam vidas para ajudar a combater o vírus.
Os coronavírus (CoVs) são vírus de RNA grandes, envelopados, de sentido positivo e de fita simples pertencentes à família Coronaviridae dentro da ordem Nidovirales (Y. Chen et al., 2020). Eles podem infectar vários hospedeiros mamíferos e são divididos em quatro gêneros: – Alpha, Beta, Gamma e Delta, dos quais Alpha e Beta CoVs são conhecidos por infectar humanos. O sequenciamento completo do genoma e as análises filogenéticas indicaram que o CoV que causa o COVID-19 estava no mesmo subgênero do vírus SARS (Fehr & Perlman, 2015) e foi nomeado com base em sua aparência sob microscopia eletrônica. As infecções humanas por CoV geralmente causam infecção respiratória leve e autolimitada. No entanto, as epidemias de SARS-CoV e coronavírus da síndrome respiratória do Oriente Médio (MERS-CoV) causaram morbidade e mortalidade alarmantes em 2002–2003 e 2012, respectivamente (Gao et al., 2016), e o COVID-19 destacou o risco contínuo de pandemias causadas por esses vírus. Os fatores de risco para COVID-19 grave em todo o mundo incluem idade avançada, raça, sexo, obesidade, doença cardiovascular, diabetes, doença pulmonar crônica e imunossupressão. Portanto, drogas que visam mecanismos pleiotrópicos podem ser importantes. Os CoVs têm um genoma grande e uma taxa de mutação mais alta em comparação com outros vírus de RNA, portanto, erradicá-los definitivamente é difícil (Gralinski & Baric, 2015). Portanto, são necessários inibidores de amplo espectro de CoVs emergentes e o reaproveitamento de medicamentos existentes foi validado como um meio de combater a pandemia de SARS-CoV-2, além de permitir a preparação futura para uma pandemia.
2. REUTILIZANDO DROGAS ANTIGAS PARA UMA NOVA CAUSA
O reaproveitamento de medicamentos surgiu como uma alternativa atraente à abordagem convencional de descoberta de medicamentos, que costuma ser exaustiva e árdua (Ashburn & Thor, 2004). É um processo de identificação de novos papéis terapêuticos para um medicamento já estabelecido para o tratamento de outra condição. A descoberta de um novo fármaco e sua chegada ao mercado é um processo repleto de riscos de toxicidade e ineficácia, que custa bilhões de dólares e requer um longo cronograma. O reaproveitamento, portanto, oferece várias vantagens em relação ao desenvolvimento de medicamentos de novo, como cronogramas de desenvolvimento reduzidos, custos reduzidos e riscos substancialmente menores, pois a segurança e o perfil farmacocinético do medicamento já estão estabelecidos (S. Pushpakom et al., 2019). O risco de falha é menor porque o medicamento reaproveitado demonstrou ser seguro em modelos pré-clínicos e em humanos, desde que os testes em estágio inicial tenham sido concluídos. Como resultado, o prazo para o desenvolvimento de medicamentos é significativamente menor (Breckenridge & Jacob, 2019).
Historicamente, o reaproveitamento de medicamentos tem sido principalmente fortuito, geralmente depois que se descobriu que um medicamento tinha um efeito fora do alvo recém-reconhecido (Nosengo, 2016). Exemplos bem conhecidos são o uso de minoxidil para queda de cabelo, sildenafil para disfunção erétil e talidomida para mieloma múltiplo (Pushpakom et al., 2019). No entanto, sucessos recentes encorajaram o desenvolvimento de abordagens mais sistemáticas, resultando na identificação de vários medicamentos candidatos promissores (Hurle et al., 2013). Nos anos mais recentes, as telas de reaproveitamento de medicamentos surgiram como uma estratégia atraente para responder rapidamente a doenças infecciosas emergentes (Ashburn & Thor, 2004). Os medicamentos aprovados pela Food and Drug Administration (FDA; EUA) que podem alcançar uma atividade antimicrobiana modesta são um mecanismo de resposta seguro e cada vez mais popular para infecções emergentes. Os medicamentos em questão podem ser disponibilizados imediatamente para uso em ensaios clínicos, pois possuem perfis de segurança conhecidos nas doses licenciadas e isso teve um grande impacto durante a pandemia do COVID-19. Por exemplo, a dexametasona foi reaproveitada no estudo RECOVERY (Horby et al., 2021) e estima-se que salvou 1 milhão de vidas em todo o mundo até março de 2021 (NHS England, 2021), enquanto o tocilizumabe, um medicamento reaproveitado para artrite reumatoide moderada a grave, é licenciado para o tratamento de pacientes hospitalizados com COVID-19 moderado a grave (Gordon et al., 2021; Grupo Colaborativo RECUPERAÇÃO, 2021). O Projeto CORONA (uma iniciativa conjunta da Castleman Disease Collaborative Network e do Center for Cytokine Storm Treatment & Laboratory) está rastreando todos os outros medicamentos novos e reaproveitados para COVID-19 e atribui aos medicamentos um “grau”, com base na eficácia do tratamento e se os endpoints pré-especificados são atendidos (Venkatesan, 2021).
Aqui, revisamos os modelos pré-clínicos que demonstraram os efeitos pluripotenciais da niclosamida, bem como alguns dados humanos limitados em uma variedade de estados de doença que sugerem que ela pode ser um agente de escolha no COVID-19.
3. HISTÓRIA E MECANISMO DE AÇÃO DA NICLOSAMIDA
Estruturalmente, a niclosamida (Figura 1) pertence a um grande grupo de moléculas lipofílicas e fracamente ácidas chamadas salicilanilidas, um derivado do ácido salicílico (Pearson & Hewlett, 1985). A niclosamida está listada na lista de medicamentos essenciais da OMS e os comprimidos mastigáveis foram aprovados para uso como agente anti-helmíntico para infecções cestóides (tênia) por mais de 40 anos com uma dose oral diária de 2 g de niclosamida (Andrews et al., 1982). A niclosamida inibe a fosforilação oxidativa e estimula a atividade do ATP nas mitocôndrias dos cestóides, matando tanto o escólex quanto os segmentos proximais da tênia (Al-Hadiya, 2005; Weinbach & Garbus, 1969). Foi demonstrado que afeta várias vias de transdução de sinal, como Wnt/ β-catenina, alvo mecanístico de rapamicina (mTOR) complexo 1 (mTORC1), transdutor de sinal e ativador de transcrição 3 (STAT3), fator nuclear kappa-potenciador de cadeia leve de células B ativadas (fator nuclear-κB; NF-κB) e vias Notch, todos indicando seu potencial para tratar condições como o câncer (resumido na Tabela 1), doenças médicas crônicas e infecções bacterianas e virais.
A niclosamida oral é apenas parcialmente absorvida pelo trato intestinal com baixa biodisponibilidade de 5,5% a 10% e é rapidamente eliminada pelos rins sem efeitos tóxicos cumulativos (Andrews et al., 1982). Estudos de distribuição em roedores com doses orais de 40 mg·kg−1 niclosamida etanolamina (ou seja, ~34 mg·kg−1 niclosamida) e 50 mg·kg−1 niclosamida demonstram que os níveis teciduais são mais elevados nos órgãos excretores (intestinos, fígado e rins) e níveis baixos a insignificantes são alcançados em outros tecidos (como cérebro, coração e pulmões) (Duhm et al., 1961; Tao et al., 2014).
Farmacocinética da niclosamida oral
A administração oral de niclosamida em roedores atingiu uma concentração plasmática máxima média (C máx) de 22,4 ng·ml−1 (1 mg·kg−1), 354 ng·ml−1 (5 mg·kg−1) e 644 ng·ml−1 (~34 mg·kg−1) (Chang et al., 2006; Choi et al., 2021; Tao e tal., 2014). Em humanos recebendo niclosamida (2 g·dia−1, po), a mediana C máx variou de 665 a 759 ng·ml−1 em cinco pacientes com câncer colorretal e de 250 a 6.000 ng·ml−1 em indivíduos saudáveis (Andrews et al., 1982; Burock, Daum, Keilholz, et al., 2018). Em três pacientes com câncer de próstata recebendo 1,5 g·dia−1, po, a C máx variou de 35,7 a 182 ng·ml−1, respectivamente (Schweizer et al., 2018a, 2018b).
Os níveis plasmáticos terapêuticos em estudos com roedores (usando doses de 5 mg·kg−1 ·dia−1, po, a 200 mg·kg−1 ·dia−1, po) provavelmente excedem os níveis plasmáticos em humanos prescritos com uma dose de 2 g po, com base nos resultados de Tao et al. (2014) e assumindo a linearidade da dose. Isso, portanto, levanta desafios farmacocinéticos (PK) e farmacodinâmicos (PD) adicionais, bem como possíveis problemas de toxicidade para ensaios clínicos em humanos.
4 NICLOSAMIDA EM ESTADOS MÉDICOS CRÔNICOS
Niclosamida e síndrome metabólica
Um estudo seminal de Tao et al. (2014) mostrou que a niclosamida etanolamina (150 mg·kg−1 ·dia−1, po) reduziu o acúmulo de gordura no fígado (esteatose) em camundongos alimentados com uma dieta rica em gordura. Os efeitos também foram estudados em células hepáticas humanas e demonstraram aumento da oxidação lipídica e regulação positiva da via da proteína quinase ativada por AMP, sugerindo seu potencial uso como agente antiobesidade. Em um estudo de obesidade em murinos, os camundongos foram alimentados com ração ou dieta rica em gordura e niclosamida (150 mg·kg−1 ·dia−1, via oral ou 75 mg·kg−1 ·dia−1, via oral) e niclosamida etanolamina por 10 semanas (Chowdhury et al., 2017). Tanto a niclosamida quanto a niclosamida etanolamina melhoraram significativamente o metabolismo da glicose, inibindo a via de sinalização do glucagon, sem alterar o peso corporal total ou a secreção ou sensibilidade à insulina. Em um estudo adicional, a administração de niclosamida (140 mg·kg−1 ·dia−1, misturado na comida) a camundongos alimentados com dieta rica em gordura, semelhante a um modelo de obesidade murina, por 4 semanas resultou em um declínio significativo na ingestão de alimentos e no peso corporal em comparação com camundongos de controle (Al-Gareeb et al., 2017). Houve também redução significativa da glicemia de jejum, insulina plasmática de jejum e melhor resistência à insulina.
Niclosamida e autoimunidade
Em um modelo de rato com artrite induzida por colágeno, a niclosamida (100 mg·kg−1, po) reduziu significativamente o índice de artrite, a espessura da almofada plantar e o inchaço do tornozelo (Al-Gareeb et al., 2019). O exame histopatológico revelou infiltração reduzida de células inflamatórias juntamente com destruição óssea e cartilaginosa reduzida. Os níveis séricos do fator de necrose tumoral α (TNFα) e IL-1β também foram significativamente reduzidos em comparação com os animais de controle. Em um estudo de lúpus murino usando camundongos MRL/ lpr, a administração diária de niclosamida (100 mg·kg−1, via oral) por 7 semanas melhorou a proteinúria, níveis de anticorpos anti-dsDNA, características histológicas e melhorou a deposição de C3 nos rins (Jang et al., 2021). A niclosamida também levou a uma redução das células T auxiliares foliculares esplênicas e inibição de STAT3 das células plasmáticas. Finalmente, em um modelo de camundongo induzido por ácido hipocloroso de esclerose sistêmica, a niclosamida (10 mg·kg−1 5 dias·semana−1 por 6 semanas, ip) reduziu os marcadores clínicos de fibrose da pele, como espessamento da pele e conteúdo de colágeno, bem como os níveis de IL-4 e IL-13 na pele. Houve uma diminuição nas vias STAT3, AKT e Wnt/β-catenina na pele de camundongos induzidos por ácido hipocloroso (Morin et al., 2016). Finalmente, em um estudo iraquiano, pacientes com artrite reumatóide ativa em uso de etanercepte mostraram boa resposta à terapia adjuvante com niclosamida (1 g·dia−1, po). Foram observadas melhorias significativas nos índices de gravidade articular e clínica e uma diminuição nos níveis séricos de IL-1β, E-selectina, molécula de adesão intercelular 1 (ICAM1) e proteína de adesão celular vascular 1 (VCAM1) (Al-Gareeb et al., 2018).
Niclosamida e patologia pulmonar
Em uma triagem de aproximadamente 580.000 compostos, a niclosamida foi identificada como um antagonista de TMEM16A, um canal de cloreto ativado por cálcio (CaCC) que contribui para a hipersecreção de muco e broncoconstrição na doença reativa das vias aéreas (Miner et al., 2019). O estudo testou a eficácia, usando vias aéreas contraídas ao máximo e tratadas com citocinas, e confirmaram que a niclosamida tinha um potente efeito broncodilatador. Em camundongos asmáticos transgênicos, a niclosamida (13 mg·kg−1·dia−1 por 3 dias, ip) reduziu a produção de muco e a broncoconstrição, além de demonstrar efeitos anti-inflamatórios e antibacterianos (Cabrita et al., 2019). Centeio et al. (2021) investigaram ainda mais esses achados, demonstrando que a instilação intratraqueal de niclosamida a 0,98% por 4 dias inibiu a produção e secreção de muco em camundongos sensibilizados com ovalbumina. Descobriu-se que a niclosamida exerce efeitos antifibróticos por meio da sinalização Wnt/β-catenina em um modelo celular, bem como em um modelo de fibrose pulmonar murina induzida por bleomicina, após administração uma vez ao dia de niclosamida em baixa dose (3 mg·kg−1, ip) e niclosamida em alta dose (10 mg·kg−1, ip) por 21 dias (Boyapally et al., 2019). Em ratos com hipertensão pulmonar estabelecida induzida por monocrotalina, niclosamida (75 mg·kg−1·dia−1 por 14 dias, po) reduziu a remodelação vascular e melhorou a função cardíaca direita por meio da inibição de STAT3 (Braga et al., 2020). Houve redução da expressão de TGF-β, fator induzível por hipóxia 1α (HIF) e vimentina, um marcador mesenquimal, juntamente com redução da transição epitelial para mesenquimal (EMT).
Niclosamida e câncer
Vários estudos demonstraram que a niclosamida tem potentes efeitos in vitro e in vivo contra uma ampla gama de cânceres. Resumimos estudos animais e pré-clínicos que destacam o uso potencial da niclosamida no câncer na Tabela 1. Em um estudo de escalonamento de dose de Fase 1 testando niclosamida oral mais dose padrão de enzalutamida para câncer de próstata conduzido por Schweizer et al. (2018a, 2018b), os indivíduos que receberam a dose mais alta (1.000 mg três vezes ao dia, via oral) apresentaram toxicidades limitantes da dose, incluindo vômitos, diarreia e colite. As concentrações plasmáticas nesta dose máxima estavam abaixo do limiar terapêutico e, portanto, o estudo foi encerrado devido à ineficácia. Um outro ensaio de Fase Ib mais recente identificou a dose máxima tolerada de uma nova versão reformulada de niclosamida e recomendou um estudo de Fase 2 desta forma biodisponível por via oral em combinação com abiraterona e prednisolona em homens com câncer de próstata resistente à castração (Parikh et al., 2021). Nove pacientes foram recrutados e nenhuma toxicidade limitante da dose foi observada em qualquer dose. Cinco de oito pacientes atingiram uma resposta de antígeno específico da próstata, dois atingiram níveis indetectáveis de antígeno específico da próstata e uma resposta radiográfica. O ensaio clínico NIKOLO é um estudo aberto de Fase II, de centro único e de braço único para investigar a segurança e a eficácia da niclosamida em pacientes com câncer colorretal metastático que progride sob terapia padrão (Burock, Daum, Keilholz, et al., 2018; Burock, Daum, Tröger, et al., 2018). O estudo está focado na viabilidade, toxicidade e eficácia da niclosamida para explorar novas opções de tratamento. Vale a pena notar que, apesar dos ensaios em andamento, a niclosamida não é aprovada para o tratamento de qualquer condição oncológica.
Niclosamida e outros modelos de doença
Em um modelo de endometriose murina, estabelecido pela indução cirúrgica de lesões semelhantes à endometriose, a niclosamida (100 e 200 mg·kg−1, po) diminuiu a taxa de crescimento e a progressão de lesões semelhantes à endometriose e inibiu as vias STAT3 e NF-κB (Prather et al., 2016). A inibição das vias inflamatórias induzidas por macrófagos foi observada em células estromais endometrióticas primárias (Sekulovski et al., 2020). A niclosamida também demonstrou atuar como um potencial agente neuroprotetor, como na doença de Parkinson, ativando PINK1 em HeLA e neurônios corticais primários (Barini et al., 2018), reduz a neuroinflamação na micróglia primária murina ativada in vitro (Serrano et al., 2019) e bloquear as vias de sinalização associadas à dor neuropática em ratos que receberam 1 mM de niclosamida por via intratraqueal (Zhang et al., 2013).
5. NICLOSAMIDA COMO AGENTE ANTIBACTERIANO
A niclosamida tem propriedades antimicrobianas bem identificadas e demonstrou prevenir a formação de biofilmes de bactérias gram-positivas adquiridas em hospitais e associadas a dispositivos, como Staphylococcus aureus e S. aureus resistente à meticilina (MRSA) em concentrações tão baixas quanto 0,01 μg·ml- 1 (Gwisai et al., 2017). Quando aplicada como revestimento de dispositivo, a niclosamida impediu a adesão bacteriana e demonstrou potente atividade antimicrobiana (Gwisai et al., 2017). Em uma triagem de 1.280 medicamentos disponíveis comercialmente, a niclosamida foi um dos nove agentes que possuíam atividade antimicrobiana contra biofilmes pré-formados (Torres et al., 2016). Um estudo time-kill mostrou ainda que a niclosamida é bacteriostática contra várias bactérias gram-positivas, incluindo MRSA, exibindo forte atividade in vivo (Caenorhabditis elegans – modelo de infecção líquida por MRSA), bem como in vitro (Rajamuthiah et al., 2015). A niclosamida teve atividades contra isolados clínicos de Enterococcus faecium resistente à vancomicina (VRE) e foi superior à linezolida como agente descolonizador gastrointestinal de camundongos desafiados com Enterococcus faecium resistente à vancomicina (Mohammad et al., 2018). Neste modelo de camundongo Enterococcus faecium -colonização-redução resistente à vancomicina, niclosamida (10 mg·kg−1 · dia −1 por 8 dias, via oral) foi administrado a camundongos que foram sensibilizados com ampicilina seguido de infecção por E. faecium para estabelecer a colonização gastrointestinal. Tam e outros. (2018) mostraram que a niclosamida inibiu a patogênese do Clostridium difficile multirresistente ao direcionar a entrada de suas toxinas nos colonócitos. Em um modelo de camundongo de infecção primária e recorrente por C. difficile, o tratamento pós-infecção com niclosamida (50 mg·kg −1 ·dia −1 por 4 dias, po) etanolamina (5% em DMSO) reduziu tanto a doença primária quanto a recorrência, sem interromper a microbiota intestinal (Tam et al., 2018). A niclosamida é estável em pH ácido e sinergiza com metronidazol e inibidores da bomba de prótons para eliminar a adesão/invasão de Helicobacter pylori por meio de múltiplos mecanismos, como redução do pH transmembranar, inibição da secreção de IL-8 (CXCL8) e interrupção da motilidade de prótons do H. pylori (Tharmalingam et al., 2018). Uma triagem de medicamentos aprovados pela FDA identificou a niclosamida como um inibidor das moléculas de sinalização de detecção de quorum de Pseudomonas aeruginosa (Imperi et al., 2013). Finalmente, a niclosamida tem atividade significativa contra cepas de Mycobacterium tuberculosis multirresistentes (Sun & Zhang, 1999) e inibiu seu crescimento em macrófagos humanos infectados de maneira bacteriostática (Fan et al., 2019). O mesmo estudo também mostrou que inibiu a replicação do HIV em macrófagos humanos por meio de efeitos transcricionais.
6. NICLOSAMIDA COMO AGENTE ANTIVIRAL
O papel da niclosamida na defesa antiviral do hospedeiro foi relatado pela primeira vez por Jurgeit et al. (2010) pelo uso de um anticorpo monoclonal contra dsRNA viral durante a triagem baseada em imagens de células infectadas. Foi demonstrado que a niclosamida neutraliza os compartimentos ligados à membrana ácida por meio de um modo de ação do transportador de prótons (protonóforo) em vesículas, bem como em lipossomas livres de proteínas (Jurgeit et al., 2012). O bloqueio da acidificação dos compartimentos endolisossomais, sem afetar a ATPase vacuolar, demonstrou inibir a infecção pelo rinovírus humano e pelo vírus influenza de maneira dependente do pH. O mesmo mecanismo demonstrou mediar sua eficácia antiviral contra os vírus da dengue e do zika (Jung et al., 2019). Um estudo descobriu que a atividade antiviral da niclosamida contra o vírus da Dengue foi por meio de uma redução da acidificação endossômica e fosforilação de AKT e p70SK (independente de mTOR) e contra o vírus Zika por meio da acidificação endossômica e bloqueio da interação NS2B-NS3, destacando assim seus efeitos antivirais pleotrópicos (Kao et al., 2018; Z. Li et al., 2017). Em um modelo murino de infecção pelo vírus da Dengue (camundongos lactantes injetados por via intracraniana e ip com o vírus da Dengue), o tratamento com niclosamida (5 mg·kg−1, ip) resultou em uma redução significativa da replicação viral no cérebro e diminuição da mortalidade. No entanto, a exposição de niclosamida nos tecidos-alvo não foi determinada (Kao et al., 2018). Da mesma forma, a administração sistêmica de solução de niclosamida a 1% (50 mg·kg−1) a um modelo humanizado de infecção por zika vírus (pintos embrionários desenvolvendo microcefalia) reduziu significativamente a replicação viral e restaurou a largura e a altura craniana (Cairns et al., 2018). Usando um sistema de triagem de alto rendimento e um ensaio de entrada subsequente, Wang et al. (2016) identificaram a niclosamida como um inibidor da entrada do vírus, liberação viral e transmissão célula a célula contra o vírus Chikungunya e dois outros alfavírus, o vírus Sindbis e o vírus da floresta Semliki. Li et al. (2017) descobriram que a niclosamida é um inibidor de amplo espectro contra flavivírus e também inibiu a replicação dos vírus Ebola e Chikungunya por meio da modulação de mecanismos celulares de maturação viral dependentes de baixo pH (Madrid et al., 2015; Mazzon et al., 2019). Uma triagem sistemática de medicamentos aprovados pela FDA identificou a niclosamida como um dos mais potentes inibidores do vírus Ebola, embora sua eficácia in vivo ainda não tenha sido confirmada em modelos animais (Madrid et al., 2015). Finalmente, a niclosamida também inibe os Beta-CoVs patogênicos (Gassen et al., 2019; Wen et al., 2007; Wu et al., 2004; Yang et al., 2020) e reduziu a replicação dos coronavírus da síndrome respiratória do Oriente Médio (MERS-Co-V) por meio de um mecanismo que envolve autofagia aprimorada por meio da inibição da proteína 2 associada à quinase da fase S (SKP2) (Gassen et al., 2019) .
7. NICLOSAMIDA COMO UM POTENCIAL AGENTE ANTI-SARS-CoV-2
Dada a potente atividade antiviral da niclosamida dentro da família beta-CoV, tornou-se evidente que poderia ser um potente antiviral contra o SARS-CoV-2. Um estudo de Jeon et al. (2020) testando 3.000 medicamentos aprovados pela FDA e outras moléculas bem caracterizadas identificaram a niclosamida como o inibidor mais potente do SARS-CoV-2 em células Vero, com uma potência 40 vezes maior que o remdesivir. Além disso, Weiss et al. (2021) mostraram que a potência da niclosamida é conservada contra a variante Alpha, Beta e Delta SARS-CoV-2 em células Vero transmembrane serine protease 2 (TMPRSS2) e validou a forte atividade antiviral da niclosamida em um modelo epitelial das vias aéreas humanas. A niclosamida também demonstrou inibir o SARS-CoV-2 in vivo. Especificamente, uma formulação de niclosamida inalada foi desenvolvida e testada em um modelo de infecção murina de SARS-CoV-2 (Brunaugh et al., 2021). A administração de niclosamida (0,24 mg·kg−1·dia−1, intranasal) a camundongos infectados com SARS-CoV-2 por 10 dias melhorou a sobrevida e reduziu significativamente as cargas virais. A niclosamida exibiu ainda propriedades potentes como agente bacteriostático anti-MRSA e modulou várias citocinas inflamatórias, como IL-1β, IL-6 e TNF-α. Esses achados sugerem que a niclosamida também pode tratar infecções bacterianas secundárias, que é uma das principais causas de morte em pacientes com COVID-19. É evidente que a administração local nesses modelos de infecção viral permitiu doses substancialmente menores (0,25 e 5 mg·kg−1) em comparação com doses orais, aumentando assim a janela terapêutica em termos de questões de segurança decorrentes da exposição sistêmica excessiva de dosagem oral.
Mecanismo de ação contra SARS-CoV-2
A atividade antiviral da niclosamida contra SARS-CoV-2 é complexa e envolve múltiplos processos celulares conforme ilustrado na Figura 2. O SARS-CoV-2 usa a enzima conversora de angiotensina 2 (ACE2) como um receptor de entrada celular em células permissivas do trato respiratório e as proteínas spike iniciam a fusão do envelope viral com a citomembrana da célula hospedeira (Zhou et al., 2020). Após a ligação do receptor e alterações conformacionais na proteína spike, a catepsina L medeia a proteólise dentro dos endossomos levando à entrada viral nas células hospedeiras, como foi demonstrado para SARS-CoV (Gomes et al., 2020; Huang et al., 2006; Simmons et al., 2005). Pensa-se que a atividade protonofórica da niclosamida, que causa a neutralização endossomal, interfere na entrada e saída viral, impedindo a liberação e a maturação do genoma do SARS-CoV-2. Esse mecanismo foi derivado de estudos com vírus respiratórios dependentes de pH – rinovírus e vírus influenza – que também usam mecanismos sensíveis ao pH da via endossomal para entrada e saída viral, semelhante ao SARS-CoV-2 (Jurgeit et al., 2012). Garret et al. (2021) demonstrou recentemente que o perfil lipídico total é amplificado durante a infecção por SARS-CoV-2 em células VeroE6 e o tratamento com niclosamida levou a uma redução nos lipídios disponíveis para a produção do vírus. Além disso, em células pulmonares humanas primárias e organoides intestinais, a niclosamida aumenta a autofagia por meio da inibição da proteína 2 associada à fase S quinase, atenuando ainda mais a replicação do SARS-CoV-2 (Gassen et al., 2021).
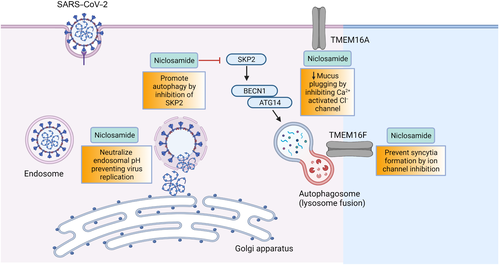
A formação de sincícios em pneumócitos infectados com SARS-CoV-2 foi observada nos pulmões de COVID-19. Para identificar os inibidores da formação de sincícios acionados por picos, foi realizada uma triagem baseada em microscopia de alto teor de mais de 3.000 compostos (L. Braga et al., 2021). A triagem identificou drogas eficazes que inibem a replicação viral, sendo uma das mais potentes a niclosamida. A niclosamida também tem efeitos broncodilatadores potentes, inibe a produção excessiva de muco e diminui a liberação de citocinas pró-inflamatórias, como IL-8, inibindo o TMEM16A (Cabrita et al., 2019). Devido aos seus efeitos nos níveis de cálcio intracelular, a niclosamida pode inibir outras citocinas e, portanto, pode desempenhar um papel importante no controle da tempestade de citocinas e da síndrome do desconforto respiratório agudo (SDRA) em pacientes com COVID-19 gravemente enfermos.
Os estudos acima mostram vários mecanismos plausíveis de ação da niclosamida contra o COVID-19, incluindo prevenção da entrada viral, prevenção da replicação viral por meio da inibição da autofagia e, finalmente, inibição da formação de sincícios acionados por picos. É importante ressaltar que, diferentemente das vacinas ou dos anticorpos monoclonais, o mecanismo de ação da niclosamida direcionado ao hospedeiro significa que sua eficácia antiviral tem menos probabilidade de ser afetada pelo surgimento de variantes do SARS-CoV-2, como demonstrado para a variante Alfa, Beta e Delta por Weiss et al. (2021). Em conclusão, esses estudos confirmaram a atividade potente, multifacetada e pleiotrópica da niclosamida contra o SARS-CoV-2, visando vários aspectos do ciclo de vida viral.
8. ENSAIOS CLÍNICOS DE NICLOSAMIDA PARA COVID-19
Com base em dados pré-clínicos promissores, a niclosamida está atualmente sendo avaliada como um potencial tratamento para COVID-19 em 18 ensaios clínicos em humanos, com base em diferentes formulações e/ou vias de administração. Os detalhes desses ensaios podem ser encontrados em registros públicos, como ClinicalTrials.gov e no site de pesquisa de ensaios da OMS. Doze desses estudos estão na Fase 2/3 e investigam a eficácia da niclosamida em todo o espectro da doença COVID-19 (Figura 3 e Tabela 2).
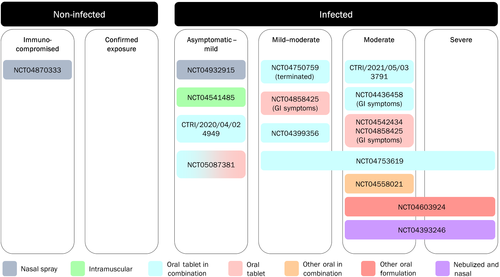
No estágio pré-sintomático e leve da doença de COVID-19, acredita-se que a potente atividade antiviral da niclosamida limite a sintomatologia e a progressão da doença. No entanto, à medida que o COVID-19 progride para uma doença moderada e grave, os efeitos broncodilatadores e anti-inflamatórios da niclosamida podem contribuir para a eficácia. Sua eficácia antibacteriana também pode beneficiar pacientes com COVID-19 em risco de infecções bacterianas secundárias, que é uma das principais causas de mortalidade em COVID-19 (Cevik et al., 2020), principalmente desde a introdução de imunomoduladores como dexametasona e tocilizumabe como medicamentos padrão de atendimento (SoC).
Formulações orais
Dos 14 estudos de Fase 2/3 (Tabela 2), 11 estudos estão investigando formulações orais de niclosamida com sete usando a forma de comprimido oral comercializado de niclosamida (também conhecido sob o nome comercial Yomesan), um utilizando cápsulas e um uma nova suspensão. No entanto, um deles está registrado como encerrado devido a níveis plasmáticos subterapêuticos e outro foi retirado devido a evidências mostrando a não eficácia da hidroxicloroquina, que estava sendo testada em um dos braços do estudo.
A niclosamida em forma de comprimido mastigável está sendo investigada em pacientes moderados com COVID-19 com sinais e sintomas gastrointestinais na dose de 400 mg três vezes ao dia durante 14 dias (National ClinicalTrials.gov (NCT) número 04542434, NCT04858425). Mortalidade, taxa de eventos adversos, eliminação fecal do vírus e várias características clínicas são listadas como medidas de resultado. A niclosamida em forma de comprimido mastigável também está sendo investigada (além do tratamento padrão (SoC) em casos ambulatoriais assintomáticos/leves na dose de 500 mg duas vezes ao dia durante 7 a 14 dias (Registro de Ensaios Clínicos – Índia (CTRI)/2020/04/024949), casos leves a moderados em 2 g quatro vezes ao dia durante 7 dias (NCT04399356), indivíduos moderados com COVID-19 em 2 g · dia-1 por 7 dias (Registro de Ensaios Clínicos – Índia/2021/05/033791), casos moderados de COVID-19 hospitalizados com sintomas gastrointestinais (NCT04436458) e pacientes leves a graves recebendo uma dose de ataque de 2 g + 1 g a cada 12 h no dia 1 e depois 1 g três vezes ao dia durante 7 dias (NCT04753619). O último estudo foi publicado recentemente (Abdulamir et al., 2021). Este estudo randomizado, aberto e controlado incluiu 75 pacientes com COVID-19 leve a grave tratados com SoC mais niclosamida (comprimido) por via oral versus 75 pacientes que receberam apenas SoC. Cada grupo consistia em 25 casos leves, 25 moderados e 25 graves (definidos de acordo com os critérios de classificação da OMS). No COVID-19 moderado e grave, mas não leve, os pacientes que receberam “niclosamida + SoC” tiveram um tempo significativamente menor de recuperação, especialmente em pacientes com comorbidades em comparação com apenas SoC. A sobrevida não aumentou significativamente. O pequeno tamanho da amostra em cada grupo de gravidade da doença e a natureza aberta do estudo limitaram quaisquer conclusões robustas extraídas do estudo.
Atualmente, uma suspensão de niclosamida está sendo testada em pacientes moderados com COVID-19 hospitalizados recebendo 200 mg (10 ml) de niclosamida três vezes ao dia durante 5 dias (além do SoC), com o tempo desde a admissão até a recuperação clínica como medida de desfecho primário. Outro estudo utiliza quatro cápsulas de niclosamida de 250 mg duas vezes ao dia durante sete dias consecutivos em casos moderados a graves, definindo a segurança e o tempo médio até a alta hospitalar como medidas de desfecho primário. Aguardam-se as leituras de eficácia de outros ensaios clínicos que investigam preparações orais de niclosamida em todos os espectros da doença COVID-19.
Injeções intramusculares
Para abordar as preocupações sobre a baixa biodisponibilidade oral da niclosamida, foi desenvolvida uma formulação administrada por via intramuscular. Atualmente está sendo investigado em voluntários saudáveis para avaliar sua segurança, tolerabilidade e farmacocinética/farmacodinâmica (PK/PD) em 40 pacientes com COVID-19 (Tabela 2). Este estudo é um estudo ascendente de dose múltipla injetando diferentes volumes de uma suspensão de 24% em quatro locais de injeção predefinidos. A incidência de eventos adversos emergentes do tratamento e o tempo e a taxa de erradicação do SARS-CoV-2 são os desfechos primários e secundários, respectivamente. Notavelmente, Choi et al. (2021) realizaram um estudo farmacocinético em ratos comparando doses iguais de niclosamida administradas pelas vias intramuscular, intravenosa e oral. Eles encontraram aumento da exposição sistêmica com a injeção intramuscular com uma C máx 70 vezes maior e área sob a curva (AUC) 13 vezes maior em comparação com a via oral. A biodisponibilidade intramuscular foi de 65% em comparação com 5,5% por via oral, destacando a melhora substancial por via intramuscular.
Administração inalatória e intranasal
Em outra abordagem, a baixa disponibilidade oral de niclosamida foi contornada pelo desenvolvimento de uma formulação otimizada para inalação e administração intranasal, com o objetivo de atingir uma alta concentração no pulmão (como tecido-alvo), limitando a exposição sistêmica para diminuir os efeitos colaterais. Backer et al. (2021) publicou um estudo de Fase 1 randomizado, duplo-cego, controlado por placebo, avaliando a segurança e a farmacocinética após a administração inalatória (nebulizada) e intranasal de uma nova formulação de niclosamida em voluntários saudáveis. Os participantes foram aleatoriamente designados para doses únicas ascendentes e cinco doses repetidas ao longo de 2,5 dias. Os critérios de inclusão incluíram um volume expiratório forçado em 1 s (FEV1) de 80%. O estudo não registrou nenhum evento adverso grave, exceto irritação leve das vias aéreas superiores, aumento da fração exalada de óxido nítrico (FeNO) em 14,7% e queda assintomática do volume expiratório forçado em 1 s em 11,8% dos indivíduos. Uma limitação do estudo, no entanto, foi a exclusão de pacientes com condições respiratórias subjacentes, como asma ou doença pulmonar obstrutiva crônica (DPOC), excluindo, assim, pacientes com maior risco de eventos adversos por via inalatória. A Cmax média da niclosamida após a dose mais elevada de 52,9 mg foi de 337 ng·ml−1 (duas vezes por dia, dosagem repetida) e 424 ng·ml−1 (dose única). Isso é menor em comparação com os níveis plasmáticos da (muito mais alta) dose de 2 g, po, usada no tratamento anti-helmíntico (Andrews et al., 1982; Burock, Daum, Keilholz, et al., 2018; Schweizer et al., 2018a, 2018b). A C máx mais baixa limitaria potencialmente os efeitos colaterais sistêmicos observados com a dosagem oral, uma via que está em uso desde a década de 1960.
Após este estudo de Fase 1, três ensaios clínicos de Fase 2/3 foram iniciados, dois dos quais estão investigando a eficácia apenas da administração intranasal – o estudo PROTECT-V (PROFILAXIA para pacientes em risco de infecção por COVID-19), supervisionado pelo Painel de Implementação de Ensaios de Compreensão e Eliminação de Covid-19 do NIHR (CUE-TIP) é um estudo de profilaxia pré-exposição em 1.500 pacientes renais vulneráveis que recebem 140 μl de uma solução de niclosamida etanolamina a 1% (equivalente a 1,4 mg de sal de niclosamida etanolamina) em cada narina duas vezes ao dia por até 9 meses e estudo PREVENT (pacientes com COVID-19 assintomáticos/leves recebendo UNI91103 duas vezes ao dia por 10 dias). Finalmente, 2021; Lu et al., 2020; Teste TACTIC-E, 2020). Para o último, a administração combinada intranasal e intrapulmonar (via nebulização) de niclosamida tem o potencial de ser uma abordagem eficaz, pois a aplicação de aerossol de niclosamida pelas vias inalatória e intranasal permite a administração local no local da doença. Usando essa abordagem de distribuição local, espera-se que os níveis de niclosamida nos tecidos-alvo sejam mais altos do que os níveis plasmáticos (Backer et al., 2021; UNION therapys, 2020) e alcancem concentrações terapêuticas no local primário da infecção. A administração nasal direcionada é crucial porque a nasofaringe e a cavidade nasal são um ponto de entrada e um reservatório para SARS-CoV-2 (Gallo et al., 2021; Sungnak et al., 2020).
No geral, a amplitude e o espectro de ensaios clínicos utilizando niclosamida nos diferentes estágios da doença do COVID-19 fornecerão dados clínicos e farmacológicos humanos valiosos e têm o potencial de permitir o desenvolvimento da niclosamida como um agente anti-COVID-19 eficaz, por si só ou como adjuvante.
9. LIMITAÇÕES E DESAFIOS AO USO CLÍNICO DA NICLOSAMIDA
O perfil de segurança favorável da niclosamida no tratamento de humanos com infecção por tênia pode ser devido ao fato de o órgão de interesse ser o intestino e a droga não precisar ser absorvida sistemicamente e, portanto, não ter a chance de modular negativamente as cascatas de sinalização sistêmica. A entrega sistêmica é necessária para infecções, cânceres e doenças metabólicas que demonstraram ser responsivas à niclosamida. O perfil de segurança da niclosamida nessas condições é amplamente inexplorado e estudos futuros são necessários para uma imagem mais clara de sua toxicidade. A dose oral de niclosamida como agente cestocida é de 2 g em dose única, e isso leva a uma ampla gama de concentrações séricas conforme descrito acima (Andrews et al., 1982), principalmente devido a taxas de absorção variáveis. A combinação de uma baixa biodisponibilidade oral e uma ampla gama de concentrações séricas resulta em eficácia imprevisível em estudos clínicos. Estudos adicionais com uma formulação que forneça alta biodisponibilidade são necessários antes que a niclosamida possa ser usada mais amplamente. Um dos obstáculos nessa direção é que um alvo direto da niclosamida permanece desconhecido.
Há grande interesse em realizar estudos para elucidar a relação estrutura-atividade da niclosamida e, assim, identificar novos derivados da niclosamida que possam ter melhor biodisponibilidade (H. Chen et al., 2013). Um estudo recente que combinou o design de drogas assistidas por estrutura identificou um inibidor baseado em mecanismo (N3) e então determinou a estrutura cristalina de M pro (principal protease de SARS-CoV-2) em complexo com este inibidor (Z. Jin et al., 2020). Por meio de uma combinação de triagem virtual e de alto rendimento baseada em estrutura, os pesquisadores analisaram mais de 10.000 compostos como inibidores de M proe demonstrou que uma estratégia de triagem robusta pode descobrir rapidamente medicamentos para novas infecções. Embora essas estruturas cristalinas forneçam novos insights úteis para a descoberta de drogas, ainda são necessários esforços extensivos para identificar bolsas de ligação efetivas para pequenas moléculas como a niclosamida e, assim, validar os alvos da droga.
Os desafios envolvidos no reaproveitamento da niclosamida começam com sua estrutura cristalina estável e sua lipofilicidade que restringem sua solubilidade em água. Isso resultou em altas doses orais em ensaios pré-clínicos e, portanto, levantou preocupações de segurança para ensaios clínicos, uma vez que dificultou a obtenção de concentrações terapeuticamente relevantes do medicamento. Por exemplo, em um estudo de escalonamento de dose de Fase 1 testando a niclosamida oral mais a dose padrão de enzalutamida para câncer de próstata, os indivíduos que receberam a dose mais alta (1.000 mg três vezes ao dia) apresentaram toxicidades limitantes da dose relacionadas ao trato gastrointestinal (colite, diarreia, náuseas e vômitos), resultando na descontinuação do tratamento. No entanto, 2018a, 2018b). Os eventos adversos relacionados aos dois pacientes que descontinuaram o tratamento (no grupo de 1.000 mg três vezes ao dia) foram provavelmente causados pelas altas concentrações locais de niclosamida no trato gastrointestinal, e não pela alta exposição sistêmica. Os níveis plasmáticos máximos para a dose de 1.000 mg três vezes ao dia (C max = 149–182 ng·ml−1, AUC 0 − t = 629–676 ng·h−1·ml−1 [min–max]) estavam abaixo ou semelhantes aos níveis plasmáticos de estudos usando uma dose diária de 1,5 ou 2 g, que é bem tolerada (Burock, Daum, Tröger, et al., 2018). É importante observar que os ensaios de COVID-19 com niclosamida estão usando a dose diária aprovada de 2 g por via oral (ou doses mais baixas por inalação/intranasal e intramuscular) e, portanto, seria de se esperar que proporções ainda menores do medicamento atingissem o trato gastrointestinal.
A melhoria nas propriedades farmacológicas e farmacocinéticas por meio da reformulação pode ajudar a superar alguns obstáculos e tornar o uso do medicamento mais popular. Em um estudo de câncer de próstata de Fase Ib, uma nova niclosamida/PDMX1001 oralmente biodisponível reformulada (1200 mg três vezes ao dia) alcançou níveis plasmáticos superiores ao limiar terapêutico (C máx = 70–236 ng·ml −1 e concentração mínima pré-dose (C vale) = 100–212 ng·ml−1 [min–máx] vs. dose alvo de 32 ng·ml−1) quando combinado com abirato rona e prednisolona e foi bem tolerado sem toxicidades limitantes da dose (Parikh et al., 2021). Zeyada et al. (2020) empregou uma nova nanoformulação à base de plurônico de niclosamida oral e testou seu efeito no carcinoma hepatocelular em ratos (70 mg·kg−1 6 dias·semana −1 por 3 semanas, po). Essas nanopartículas tiveram propriedades de liberação sustentada por até 7 dias e restauraram a integridade do fígado, reduziram os níveis de alfa-fetoproteína (AFP) e mostraram melhores atividades anticancerígenas em comparação com a droga sozinha. Além disso, os ensaios descritos acima usando injeção intramuscular ou novas formulações de niclosamida oral no COVID-19 elucidarão ainda mais sua segurança e eficácia, impulsionadas por exposições sistêmicas.
A administração direta do medicamento nas vias respiratória e nasal pode superar alguns desses obstáculos e gerar altas concentrações do medicamento no local da infecção primária na infecção por COVID-19, principalmente na cavidade nasal e no tecido pulmonar. Além disso, acredita-se que essa abordagem limite a exposição sistêmica e, portanto, diminua o risco de efeitos colaterais sistêmicos.
10. CONCLUSÕES E ORIENTAÇÕES FUTURAS
Acumulou-se evidência de que a niclosamida é uma droga multifuncional que pode modular várias vias de sinalização e processos biológicos. Mostrou atividade pré-clínica em muitos modelos de doenças, desde câncer e doenças metabólicas até várias infecções. As principais causas de mortalidade em pacientes com COVID-19 são uma resposta imune exagerada, bem como infecções bacterianas secundárias e o desenvolvimento da síndrome do desconforto respiratório agudo. A niclosamida pode funcionar tanto como agente antibacteriostático quanto como imunomodulador; assim, tem vantagens únicas sobre outros agentes atualmente sendo testados na arena COVID-19.
Mais importante ainda, as propriedades antivirais de amplo espectro da niclosamida e a potente inibição do SARS-CoV-2 significam que ela pode ser desenvolvida rapidamente como uma abordagem terapêutica econômica contra o COVID-19 e mantém a promessa de ampla utilização como agente primário ou adjuvante. O uso de niclosamida pode ser estendido a outras infecções respiratórias virais com alta necessidade médica não atendida, como rinovírus, vírus influenza e vírus sincicial respiratório. A reformulação da niclosamida em uma via nebulizada e nasal tem o potencial de fornecer a droga em concentrações terapêuticas ao local de replicação viral e da doença e, assim, minimizar a toxicidade sistêmica. Prevemos que os resultados dos próximos ensaios clínicos de niclosamida no COVID-19 serão um marco importante no gerenciamento da pandemia globalmente.
Nomenclatura de alvos e ligantes
Os principais alvos e ligantes de proteínas neste artigo têm hiperlinks para as entradas correspondentes no IUPHAR/BPS Guide to PHARMACOLOGY http://www.guidetopharmacology.org e são permanentemente arquivados no Concise Guide to PHARMACOLOGY 2021/22 (Alexander, Christopoulos, Davenport, Kelly, Mathie, Peters, Veale, Armstrong, Faccenda, Harding, Pawson, Southan, Davies, et al., 2021; Alexander, Fabbro, Kelly, Mathie, Peters, Veale, Armstrong, Faccenda, Harding, Pawson, Southan, Davies, Beuve, et al., 2021a; Alexander, Fabbro, Kelly, Mathie, Peters, Veale, Armstrong, Faccenda, Harding, Pawson, Southan, Davies, Boison, et al., 2021b).
RECONHECIMENTOS
Esta pesquisa foi apoiada pelo NIHR Cambridge Biomedical Research Centre, Reino Unido (BRC-1215-20014). As opiniões expressas são as dos autores e não necessariamente as do NIHR ou do Departamento de Saúde e Assistência Social. RS e JC são os Investigadores Chefes dos ensaios clínicos PROTECT-V e TACTIC-E, respectivamente.
O estudo PROTECT-V é supervisionado pelo NIHR Covid-19 Understanding and Elimination-Trials Implementation Panel (CUE-TIP). O PROTECT-V é financiado pela LifeArc, Addenbrooke’s Charitable Trust, Cambridge University Hospitals e Kidney Research UK com contribuições financeiras da Union Therapeutics para o braço da niclosamida. O estudo TACTIC-E é financiado pela UNION Therapeutics, Dinamarca, bem como pela AstraZeneca e Evelo Biosciences com apoio financeiro significativo do NIHR Cambridge BRC. RS e JC reconhecem o apoio financeiro do NIHR Cambridge BRC. AW e MS também reconhecem o apoio do Innovation Fund Denmark (Innovationsfonden) sob o número de concessão 0153-00209 e da Fundação Novo Nordisk sob o número de concessão NFF NNF20CC0035580.
CONTRIBUIÇÕES DO AUTOR
JC teve a ideia do artigo. SS realizou a pesquisa inicial da literatura. SS, MF, JG, SK e JG escreveram o primeiro rascunho. Figura 1 projetada por AW, Figura 2 projetada por IL e Figura 3 projetada por SS, AW, JG e JC. SS, AW, JG, MS, RS e JC revisaram criticamente o artigo. Todos os autores aprovaram a versão final.
CONFLITO DE INTERESSES
JC e RS reconhecem os subsídios institucionais da Union Therapeutics para a condução de ensaios clínicos de niclosamida iniciados por investigadores. A MS é acionista da UNION Therapeutics e a AW se beneficia de um esquema de incentivos aos funcionários. Os demais autores declaram não haver conflito de interesses.
British J Pharmacology - 2022 - Singh - Niclosamide A promising treatment for COVID‐19