Hadas Bar-Joseph, Yael Raz, Anat Eldar-Boock, Nadav Michaan, Anjo Yoel, Ester Saiag, Luba Nemerovsky, Ido Ben-Ami, Ruth Shalgi e E Grisaru
Abstrato
Após a administração da vacina SARS-CoV-2, muitas mulheres em todo o mundo relataram irregularidades menstruais de curto prazo. Embora o sangramento menstrual, “o quinto sinal vital”, seja experimentado por mais de 300 milhões de pessoas em qualquer dia em todo o mundo, essas mudanças foram apenas parcialmente estudadas. Períodos irregulares são importantes muito além da fertilidade e do desconforto que eles impõem; eles estão associados ao risco de morbidade cardiovascular, doenças crônicas e mortalidade prematura. O exame pré-clínico do envelope polimérico da vacina indica seu acúmulo nos ovários. As células endócrinas somáticas do folículo ovariano – as células da granulosa (GCs) – participam do ciclo de feedback estrito hipotálamo-hipófise-ovariano (HPO) que governa o ciclo menstrual por meio de reguladores endócrinos e parácrinos, como AMH e inibinas. Nosso objetivo foi desvendar o efeito direto da vacina COVID-19 nas GCs e vincular sua atividade pós-vacina a mudanças nos padrões menstruais. GCs primários humanos expostos in vitro à vacina Pfizer COVID-19 BNT162b2 não demonstraram nenhuma alteração em sua viabilidade, mas alteraram transcrições de mRNA, especificamente dos principais fatores regulatórios: InibinaB foi regulada positivamente, enquanto AMH foi regulada negativamente. Examinamos ainda amostras de sangue pré e pós-vacinação de mulheres individuais e encontramos uma alteração de 2 a 3 vezes na proporção do nível de proteína FSH/InibinaB pós-vacinação, em comparação com seus valores pré-vacinação. Essa expressão alterada de InibinaB pode impactar significativamente o eixo HPO em mulheres vacinadas e pode, em última análise, influenciar a ciclicidade do endométrio, manifestada clinicamente pelas alterações comumente relatadas nos padrões de sangramento menstrual.
Introdução
Historicamente, a pesquisa sobre distúrbios menstruais tem sido escassa, em grande parte devido a noções não científicas que ligam o sangramento menstrual à poluição e à impureza. A pandemia da COVID-19 revelou uma lacuna crítica na ciência da saúde feminina, agravando a ansiedade, a ignorância e a hesitação em relação à vacina. Durante a pandemia da COVID-19, milhões de mulheres em todo o mundo foram vacinadas contra o vírus SARS-CoV-2. Embora os dados clínicos pré-clínicos e retrospectivos concordem quanto à segurança da vacina para fertilidade e gravidez, não muito tempo após a administração da primeira e segunda doses, muitas mulheres relataram mudanças em seus padrões de sangramento menstrual. Esses relatórios foram seguidos por publicações revisadas por pares apoiando esses fenômenos, independentemente da marca da vacina. As evidências apontam para mudanças temporárias de curto prazo, mas estatisticamente significativas, na duração e no fluxo do ciclo, a maioria das quais são retomadas dentro de um ciclo. Essas mudanças podem estar associadas a múltiplas características, como idade da mulher, tipo de contracepção em uso, etnia, gravidade de outros efeitos colaterais da vacina e muito mais. No entanto, a ligação entre o dia do ciclo na vacinação e as alterações menstruais é controversa.
Uma ligação entre irregularidades menstruais e administração de vacinas foi demonstrada já em 1913, rastreando a vacina contra tifo; desde então, foi demonstrado que as vacinas contra hepatite B e vírus do papiloma afetam o ciclo menstrual também. Foi sugerido que esse efeito colateral é resultado da resposta imune à vacina, ativação de células imunes endometriais que regulam a geração do endométrio ou influência imunológica na secreção do hormônio folicular estimulante (FSH) e do hormônio luteinizante (LH). O exame da vacina COVID-19 apontou para uma resposta imunológica, manifestada pela liberação de citocina (como Interleucina-8; IL-8). Entretanto, um efeito direto da vacina no ovário deve ser examinado, pois artigos recentes mostraram que as células ovarianas podem ser infectadas diretamente pelo vírus SARS-CoV-2, e que a vacina causou uma resposta biológica semelhante à da sinalização da prolactina, o que pode levar a irregularidades menstruais de curto prazo.
A vacina da Pfizer-BioNTech contra a COVID-19, BNT162b2 (comercialmente chamada de COMIRNATY®; “vacina”), foi a primeira a ser autorizada pela FDA para uso amplo. A vacina usa uma tecnologia de nanopartículas lipídicas (LNP) clinicamente validada, desenvolvida pela Acuitas therapeutics Inc. Em seu “Relatório Final” para a FDA, a Acuitas acompanhou a distribuição e o acúmulo de um envelope de LNP contendo mRNA marcado (veículo LNP) no corpo de ratos modelo de pesquisa e sugeriu os ovários como um dos quatro órgãos que acumularam o veículo LNP.
A principal unidade funcional do ovário é o folículo. Ele é composto por um oócito cercado por células da granulosa endócrina somática (GCs) que dão suporte ao oócito durante a foliculogênese. As GCs fazem parte do eixo hipotálamo-hipófise-ovariano (HPO) que governa a atividade do sistema reprodutivo. O ciclo menstrual pode ser facilmente interrompido, por exemplo, devido ao estresse e à má nutrição.
Nós hipotetizamos que as alterações menstruais em mulheres pós-vacinadas podem resultar de um efeito direto da vacina nos GCs, levando a modificações na expressão e secreção de reguladores hormonais foliculares e, portanto, afetando o ciclo. A inibinaB é produzida principalmente por GCs de folículos antrais em crescimento dependentes de FSH e secretada predominantemente durante a fase folicular do ciclo (antes da ovulação). Há pouca evidência de uma correlação entre os níveis séricos de inibinaB e parâmetros do ciclo menstrual, como fluxo e duração do sangramento. No entanto, como a inibinaB é um participante fundamental no ciclo de feedback do HPO, que é correlacionado com a duração do ciclo, nós nos concentramos nela.
Resultados
Nosso objetivo foi determinar o efeito direto da vacina BNT162b2 contra a COVID-19 nos GCs ovarianos e sugerir que ela contribui para as alterações menstruais pós-vacinação.
Expusemos GCs primários humanos in vitro (hpGCs), obtidos de mulheres submetidas a tratamentos de fertilização in vitro, a duas concentrações da vacina (“dose injetada” ou “dose de órgão final”; veja “Métodos”) por 24 ou 48 h. Para superar vieses resultantes de diferenças nas características das mulheres e nos protocolos de fertilização in vitro (detalhados na Tabela Suplementar 1), reunimos hpGCs de mais de uma mulher em cada um dos nossos experimentos.
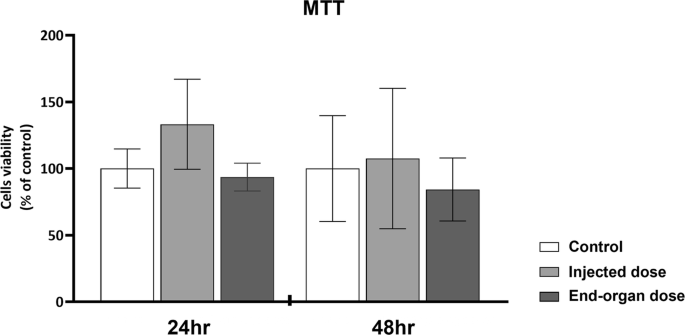
Primeiro, examinamos se a vacina inflige um efeito tóxico na vitalidade das células. Usando um teste MTT (Fig. 1), mostramos que a vitalidade das células não é comprometida pela vacina, independentemente da concentração da dose ou do tempo de exposição.
Fig. 1: Vitalidade dos GCs primários humanos (hpGCs) após exposição à vacina BNT162b2 COVID-19.
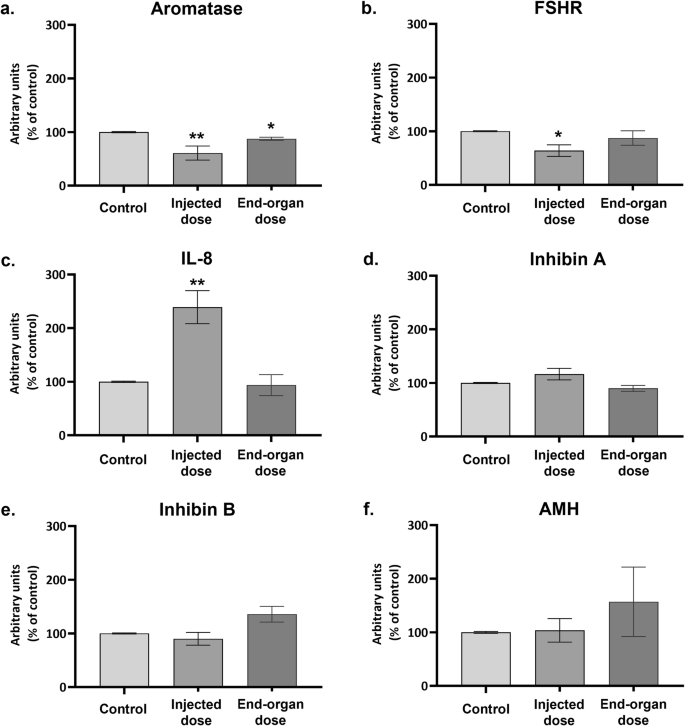
Em seguida, seguimos o nível de transcrições de mRNA de genes associados à atividade de GCs. Enquanto 24 h de exposição à dose injetada da vacina (Fig. 2) causaram uma diminuição nos níveis de mRNA de aromatase e FSHR e um aumento proeminente no nível de mRNA de IL-8 (nenhuma alteração foi detectada nos níveis de mRNA de InibinaA, InibinaB ou AMH ), a exposição à dose de órgão final levou a um aumento do nível de mRNA de InibinaB que não atingiu significância estatística (PV = 0,061), concomitante com a regulação negativa do nível de aromatase.
Fig. 2: Expressão de mRNA de genes selecionados em hpGCs após exposição de 24 horas à vacina BNT162b2 COVID-19.
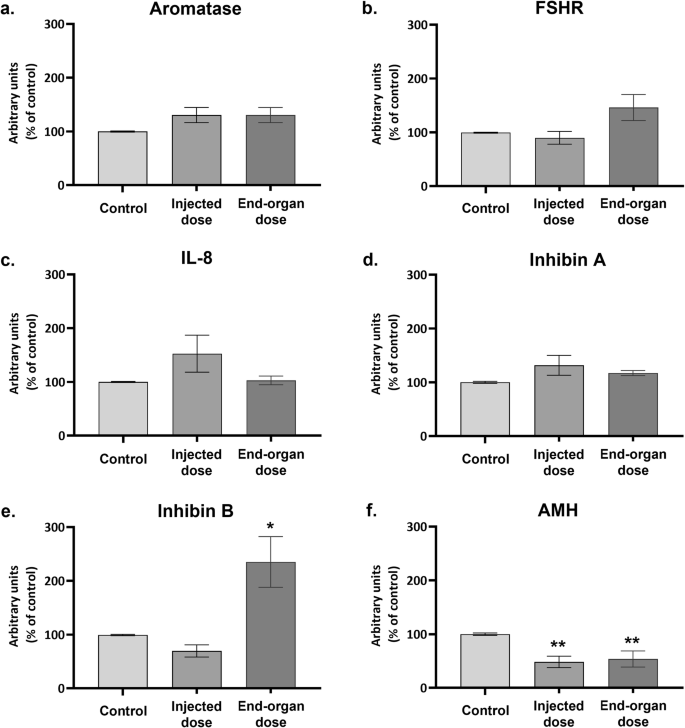
Após 48 h de exposição (Fig. 3), a dose injetada não influenciou mais os níveis de mRNA de aromatase, FSHR, IL-8 ou InibinaA. Esses transcritos de mRNA também não foram afetados pela dose do órgão final. No entanto, a dose do órgão final causou um aumento profundo (mais de 200%) no nível de mRNA de InibinaB. O nível de AMH foi regulado negativamente em ambas as doses.
Fig. 3: Expressão de mRNA de genes selecionados em hpGCs após exposição de 48 horas à vacina BNT162b2 COVID-19.
Em seguida, medimos o nível da proteína InhibinB secretada dos hpGCs no meio de cultura, em resposta à exposição à vacina, e detectamos um aumento em seu nível (112, 121 e 134% em três experimentos independentes, em comparação ao controle) após 48 h de exposição à dose do órgão final, correspondendo ao aumento em seu nível de mRNA. Não houve alteração detectável no nível da proteína InhibinA no meio de cultura em nenhuma dose ou duração da exposição à vacina (dados não mostrados).
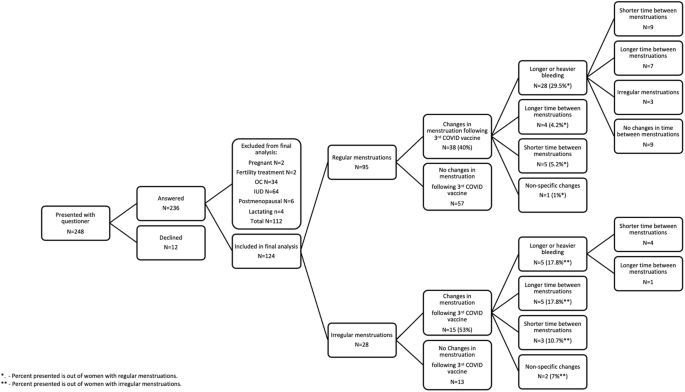
Para acompanhar nossa investigação experimental in vitro, entrevistamos mulheres que frequentavam o Sourasky Medical Center ~4 meses após receberem sua terceira dose da vacina BNT162b2 COVID-19. Das 236 mulheres que responderam ao nosso questionário eletrônico (Fig. 4), 112 foram excluídas devido a vários motivos, como gravidez ou menopausa, e 124 foram incluídas em nossa análise final. Quarenta por cento das mulheres com menstruações regulares e 53% das mulheres com menstruações irregulares relataram várias mudanças na duração do ciclo e nos padrões de sangramento após a administração da terceira dose da vacina.
Fig. 4: Alterações menstruais após a 3ª dose do resumo do questionário de vacinação contra COVID-19.
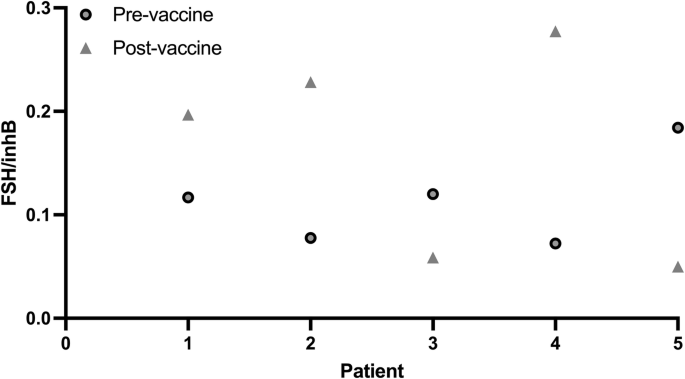
Finalmente, perguntamos se o aumento detectado na inibina B, após uma exposição direta à vacina, também pode ser rastreado em mulheres vacinadas e apontar seu papel nas irregularidades menstruais. Para esse fim, analisamos amostras de sangue de cinco mulheres antes e ~1 mês após a vacinação da 3ª dose. Todas as mulheres relataram mudanças em seu padrão de sangramento menstrual após a vacina. O sangue foi coletado sem registrar o dia do ciclo menstrual. Como FSH/Inibina B apresenta uma proporção relativamente estável, independente do dia do ciclo, e como cada mulher tem sua própria proporção FSH/Inibina B que é estável, não apenas ao longo do ciclo, mas nos ciclos seguintes, seguimos essa proporção. Descobrimos que, para todas as mulheres testadas, a proporção FSH/Inibina B foi alterada 2–3 vezes após a vacinação (Fig. 5).
Fig. 5: Alterações na proporção FSH/InibinaB em resposta à administração da vacina contra a COVID-19.
Discussão
Durante a pandemia da COVID-19, milhões de mulheres em todo o mundo foram vacinadas contra o vírus SARS-CoV-2. Pouco tempo depois, mulheres administradas com a primeira e a segunda doses relataram alterações em seu ciclo menstrual. A influência das vacinas nos sangramentos menstruais das mulheres foi previamente estabelecida, como nas vacinas contra os vírus da hepatite B e do papiloma onde a ativação do sistema imunológico, a inflamação e a regulação perturbada da regeneração do útero foram sugeridas como a causa.
Estudos que acompanharam a função ovariana em mulheres vacinadas submetidas a tratamentos de fertilização in vitro indicam que a vacina não afeta a função ovariana ou a qualidade do oócito (maturação do oócito ou taxas de fertilização após vacinas baseadas em mRNA), mesmo quando anticorpos IgG anti-COVID-19 foram detectados nos fluidos foliculares (FF). Além disso, a reserva ovariana pós-vacinação, avaliada pelos níveis séricos de AMH bem como a contagem de folículos antrais e níveis séricos hormonais, não foram alterados. No entanto, períodos irregulares são importantes muito além da fertilidade; eles causam desconforto e estresse emocional, que muitas vezes estão sendo ignorados. Além disso, eles estão associados ao risco de morbidade cardiovascular, doenças crônicas e mortalidade prematura. O estudo atual mostra que as alterações no ciclo menstrual ocorrem após a 3ª dose (~6 meses após a segunda dose) e não apenas após a primeira e a segunda vacinação, como na maioria dos relatórios.
Regulado pelo eixo HPO, o ciclo menstrual é composto por três fases: folicular, ovulatória e lútea. A fase folicular – do início do sangramento menstrual até a ovulação – governada pelo FSH promovendo o crescimento folicular, e a fase lútea – da ovulação até o próximo sangramento menstrual – regulada por um aumento de LH promovendo a formação do corpo lúteo. A duração normal dos ciclos ovulatórios (entre 21 e 35 dias), é geralmente derivada de durações variáveis da fase folicular. Em contraste, a fase lútea é relativamente constante em sua duração (~14 dias).
GCs, as células endócrinas somáticas do folículo, participam do ciclo de feedback estrito do HPO da seguinte maneira: o FSH estimula os GCs via receptor de FSH (FSHR) a secretar reguladores endócrinos e parácrinos, como estrogênio (produzido pela aromatase dentro dos GCs), AMH e inibinas. Por sua vez, esses hormônios regulam o FSH, reduzindo diretamente sua síntese e secreção da hipófise (estrogênio e inibinas) ou reduzindo indiretamente a sensibilidade do folículo ao FSH (AMH). Como os GCs desempenham um papel na regulação do eixo HPO, e seguindo o “relatório final” da Acutias, indicando que o veículo LNP se acumula nos ovários, pretendemos explorar se a vacina pode afetar diretamente a expressão de reguladores ovarianos, o que por sua vez pode explicar as mudanças pós-vacinação nos ciclos menstruais.
Para avaliar o efeito direto da vacina no ovário, reunimos hpGCs isolados de várias mulheres, mitigando assim vieses devido a diferenças fisiológicas individuais e protocolos de tratamento. Examinamos duas concentrações de vacina para determinar seus efeitos: (i) 0,05 μg/ml (‘dose injetada’) para avaliar a toxicidade celular e (ii) 0,05 pg/ml (‘dose de órgão final’), representando a concentração acumulada nos ovários das mulheres, com base no Relatório Final para o FDA.
Primeiro, buscamos descobrir se a vacina é tóxica para as células, usando uma dose 1000 vezes maior do que no órgão final. Descobrimos que a viabilidade dos hpGCs não foi comprometida após 24 ou 48 h de exposição às doses injetadas ou no órgão final. Assim, concluímos que as descobertas reunidas neste trabalho não foram resultado de comprometimento da vitalidade das células, mas sim relacionadas a mudanças em sua atividade.
Para dar suporte à nossa hipótese, examinamos o nível de mRNA dos genes relacionados à atividade dos GCs. Uma estimulação de 24 horas com a dose injetada da vacina causou uma diminuição nos níveis de mRNA da aromatase e FSHR , refletindo sua atividade e receptividade reduzidas ao FSH. Junto com o aumento robusto no nível de mRNA da quimiocina pró-inflamatória IL-8 , que atua para resolver o estímulo inflamatório e promover a cura, esses resultados provavelmente representam uma fase de estresse agudo experimentada pelas células. Essa resposta celular era esperada após uma exposição direta à dose injetada da vacina. Curiosamente, a dose no órgão final não causou uma mudança notável na expressão da aromatase, FSHR ou IL-8, mas levou a um aumento no nível de mRNA da InibinaB que não atingiu significância estatística e ainda não foi refletido no nível de proteína secretada.
Continuamos a acompanhar os hpGCs após uma exposição de 48 horas à vacina, conforme medido no “Relatório final”. Nesse ponto de tempo, as alterações relacionadas ao estresse detectadas após a exposição de 24 horas à dose injetada voltaram ao seu estado basal, apontando para uma recuperação da atividade e da capacidade de resposta das células. No entanto, a exposição à dose do órgão final resultou em uma elevação proeminente no nível de mRNA da InibinaB . O nível da proteína secretada apresentou uma tendência semelhante, apoiando ainda mais nossos resultados. Embora a secreção de InibinaB no meio de cultura tenha sido elevada em comparação ao controle em 3 experimentos independentes, não foi estatisticamente significativa. Isso pode ser devido às diferenças na concentração de InibinaB (medida por ELISA) dos 3 controles independentes, causadas por diferentes taxas de fixação e sobrevivência dos hpGCs durante o período de cultura. Essas diferenças são refletidas no alto STDEV do grupo de controle, que por sua vez afetou o valor de P. Além disso, poderíamos ter detectado uma elevação mais proeminente na proteína secretada se tivéssemos permitido um período de cultura mais longo, pois as proteínas são expressas após os mRNAs. No entanto, esses resultados apoiam os níveis elevados de mRNA observados e implicam um aumento dos níveis de InibinaB nos soros de mulheres pós-vacinadas. Este último pode causar uma interrupção do eixo hormonal enraizado na base das mudanças relatadas no ciclo menstrual, implicando um nível alterado de InibinaB ~1 mês após a vacinação.
Acompanhamos ainda outros participantes do eixo HPO.
InhibinA, outro membro da família Inhibin, está envolvido na regulação da secreção de FSH e LH. Como é expressa principalmente pelo corpo lúteo não ficamos surpresos ao não encontrar nenhum efeito da vacina em sua expressão em hpGCs.
O AMH, produzido exclusivamente por GCs, principalmente de pequenos folículos em crescimento até pequenos folículos antrais, contribui para o ciclo menstrual afetando outros folículos de forma parácrina. Ele regula negativamente o nível de FSHR em folículos pré-antrais e inibe a ativação de folículos primordiais do pool ovariano. Embora tenhamos usado hpGCs que foram isolados de folículos pré-ovulatórios, detectamos a expressão de AMH. Isso pode ser devido ao fato de que na FIV, os oócitos são isolados de pequenos folículos antrais também, ou devido a uma baixa expressão basal de AMH por grandes folículos antrais. Observamos uma redução significativa nas transcrições de AMH em ambas as doses da vacina, 48 h após a administração in vitro. Isso implica uma redução similar na expressão de AMH em folículos menores no ovário após a vacinação, o que pode resultar em uma população maior de folículos hormonalmente ativos, o que pode causar um nível sérico ainda maior de InibinaB e interrupção do ciclo. No entanto, como mostrado, isso não representa um reservatório primordial clinicamente diminuído, mas um efeito local e transitório.
Tanto a Inibina B quanto o AMH são secretados pelos GCs dos folículos em crescimento. Como a maioria dos folículos em crescimento sofre atresia (apoptose folicular) e apenas alguns continuam a se desenvolver em direção à ovulação, a atresia dos folículos afetados pela vacina poderia esclarecer por que as alterações menstruais relatadas são transitórias. As respostas variadas à vacina entre diferentes indivíduos também podem ser influenciadas pela fase do ciclo menstrual (folicular ou lútea) no momento da vacinação.
Os níveis de FSH e InibinaB mudam ao longo do ciclo menstrual, mas sua proporção permanece relativamente constante, independente do dia do ciclo; espera-se que essa proporção seja semelhante entre ciclos menstruais consecutivos da mesma mulher. Em linha com nossos experimentos in vitro, nossa análise in vivo da proporção FSH/InibinaB em mulheres antes e ~1 mês após a 3ª dose da vacina contra COVID-19 mostrou que a proporção FSH/InibinaB pós-vacinação foi alterada em 2–3 vezes. Essa mudança reforça nossa hipótese de que a vacinação causou uma elevação imediata na expressão de InibinaB, o que levou a mudanças na duração e sangramento dos ciclos menstruais, bem como a uma proporção FSH/InibinaB alterada um mês depois.
Como a vacina anti-COVID-19 é a primeira vacina comercialmente disponível baseada em mRNA, e como não há veículo disponível para servir como “controle”, não podemos descartar a possibilidade de que as mudanças que caracterizamos nos hpGCs foram induzidas pelo envelope da vacina e não especificamente pela sequência de mRNA da COVID-19. Hoje, quando há mais vacinas baseadas em mRNA no pipeline, essa questão é altamente relevante.
Para resumir, este estudo revela um mecanismo único e independente para alterações menstruais relacionadas à vacina, concomitante com a resposta imune infligida pela vacina. Nosso trabalho sugere que, na exposição, a vacina COVID-19 pode afetar os GCs diretamente, embora não reduzindo sua viabilidade. A exposição à concentração da vacina no órgão final exerceu alterações nas transcrições de dois fatores-chave de regulação ovariana: uma regulação positiva proeminente de InibinaB e uma regulação negativa de AMH . Essas alterações podem afetar fortemente os níveis séricos de FSH em mulheres vacinadas; levar à interrupção do crescimento folicular (ou seja, crescimento de muitos folículos no momento “errado” do ciclo) e atividade (ou seja, produção de estrogênio); e, finalmente, afetar a ciclicidade do útero que é clinicamente exibida por alterações no padrão de sangramento menstrual. A análise sérica de mulheres vacinadas que relataram alterações menstruais mostrou um nível de FSH/InibinaB transformado, apoiando nossos resultados.
Métodos
A pesquisa foi conduzida em conformidade com a Declaração de Helsinque. O Institutional Review Board do Sha’are Zedek Medical Center aprovou todos os aspectos do estudo envolvendo hpGCs (número de aprovação 0240-19-SZMC), e o consentimento informado foi obtido de todos os participantes. O Institutional Review Board do Tel Aviv Sourasky Medical Center aprovou os componentes do estudo relacionados às alterações menstruais após a terceira dose do questionário de vacinação contra a COVID-19 (número de aprovação 0530-21-TLV), para o qual o consentimento informado foi obtido eletronicamente, bem como as medições do nível de hormônio sérico (número de aprovação 0086-22-TLV), para o qual o consentimento informado foi obtido de todos os participantes.
Isolamento de células da granulosa primária humana (hpGCs)
hpGCs foram obtidos de mulheres caucasianas, de 20 a 45 anos de idade com IMC normal, submetidas a tratamentos de fertilização in vitro no Sha’are Zedek Medical Center, Jerusalém, entre 11/2021 e 12/2022, vários meses após a administração da primeira e segunda doses da vacina COVID-19 da Pfizer-BioNTech em Israel. As características dos participantes estão resumidas na Tabela Suplementar 1. hpGCs foram isolados de FF aspirado, conforme descrito anteriormente. Nesta metodologia de coleta, todo o FF está sendo extraído do folículo; então, o oócito é isolado dentro do complexo cúmulo-oócito, a maioria das células restantes são GCs murais. FF foram centrifugados; os pellets resultantes foram ressuspensos em tampão de hemólise (0,12% Tris, 0,84% NH4Cl) e então lavados várias vezes em solução salina tamponada com fosfato de Dulbecco. Os pellets foram ressuspensos em pools (para garantir um número adequado de células/poço) com meio de cultura fresco (Dulbecco’s Modified Eagle’s Medium F-12; DMEM-F12; Biological Industries, Beit HaEmek, Israel), suplementado com L-glutamina, penicilina e estreptomicina (2 mM, 10000IU/ml e 100 mg/ml, respectivamente; Biological Industries) e 10% de SFB (Biological Industries). As células foram semeadas em placas de 6 poços (Thermo Fisher Scientific, Rockford, IL, EUA) para permitir a aderência celular e garantir a coleta apenas de hpGCs, e incubadas a 37 ° C sob uma atmosfera controlada de 5% de CO2 no ar.
Estimulação
No dia seguinte, os hpGCs foram lavados com meio de cultura fresco suplementado com a vacina Comirnaty® para COVID-19 (Pfizer). O ensaio pré-clínico publicado no “Final Report” pela Acutias acompanhou a distribuição e acumulação de um veículo LNP no corpo de ratos modelo de pesquisa após a administração de uma dose única, ao longo de 48 h, mostrando que fora do local da injeção, ele foi acumulado em 4 dos 28 órgãos examinados dos ratos, sendo os ovários um deles ( ~ 0,1%). Em humanos, os adultos são tratados com uma dose de 30 µg/pessoa (equivalente a uma concentração de ~ 0,06 µg/ml, teoricamente distribuída em um volume sanguíneo médio de 5 L para as mulheres adultas). Assim, examinamos duas concentrações de vacina (diluídas do frasco original não diluído – “concentração de estoque” de 50 µg/ml): (i) 0,05 µg/ml (“dose injetada”), para avaliar a toxicidade celular. (ii) 0,05 pg/ml (“dose no órgão final”), representando a concentração acumulada nos ovários das mulheres (~0,1% da dose injetada).
Cálculos das concentrações utilizadas para tratar hpGCs
Usamos frascos de copo roxo Pfizer COMIRNATY. O frasco não informa a concentração da vacina, então calculamos:
- Cada frasco não diluído contém 225 µg de vacina em 0,45 ml.
- O frasco é diluído antes da injeção com 1,8 ml de diluente.
- A concentração final administrada injetada em adultos (após diluição) é: 30 µg em 0,3 ml, ou 100 µg/ml.
- Assim, no frasco diluído: 2,25 ml de vacina, a 100 µg/ml, o que equivale a um total de 225 µg no frasco.
Disso deduzimos que o frasco não diluído contém 225 µg de vacina em 0,45 ml, resultando em uma concentração de 50 µg/ml (“concentração estoque”).
Utilizamos esse estoque para os tratamentos da seguinte forma:
- “Dose injetada”: 1 µl do estoque não diluído da vacina (50 µg/ml) em 1 ml do meio de cultura de células resulta em uma concentração de 0,05 µg/ml. Essa concentração se assemelha à concentração da dose da vacina administrada diretamente no sangue de uma mulher adulta: 30 µg em ~5 litros de sangue, 0,06 µg/ml.
- “Dose de órgão final”: diluição de 1:1000 da “dose injetada”. Esta concentração se refere ao acúmulo de 0,1% do veículo NLP administrado nos ovários de ratas fêmeas, conforme indicado no “Relatório final”.
Os hpGCs foram coletados 24 ou 48 h depois para análise de RNA e o meio de cultura foi coletado para análise de proteínas.
Ensaio de viabilidade celular
hpGCs foram semeados em uma placa de 96 poços (200 µl/poço, em triplicatas) em um meio de cultura fresco e estimulados com a vacina conforme elaborado acima. Após incubação de 24 ou 48 h, a viabilidade dos hpGCs foi medida usando o ensaio MTT (M5655; Sigma Aldrich, St. Louis, MO, EUA) de acordo com as instruções do fabricante.
Reação de PCR quantitativa
O RNA foi extraído usando reagente Trizol (Bio-Tri; Bio-lab Chemicals, Jerusalém, Israel), de acordo com as instruções do fabricante, e quantificado com o espectrofotômetro Nano-Drop (ND-1000; Thermo Fisher Scientific, Waltham, MA EUA). O RNA total foi transcrito reversamente usando um kit de transcrição reversa de cDNA de alta capacidade (4368814; Applied Biosystems; Foster City, CA, EUA) e usado para análise de expressão gênica relativa (20 ng de cDNA por reação foram usados como um modelo de amplificação). O HPRT1 serviu como um controle de normalização endógeno.
Alterações nos níveis de expressão de mRNA foram detectadas e analisadas por qPCR, pelo StepOnePlus Real-Time PCR System (Applied Biosystems, Thermo Fisher Scientific), usando reagente verde SYBR (Power SYBR Green PCR Master Mix; Applied Biosystems) e primers SYBR (Tabela 1 ) ou primers TaqMan e TaqMan (Tabela 2). A expressão relativa foi calculada usando o Δ Ct comparativo.
O EFEITO DIRETO DA VACINAÇÃO CONTRA O VÍRUS SARS-COV-2 NAS CÉLULAS DA GRANULOSA OVARIANA HUMANA EXPLICA AS IRREGULARIDADES MENSTRUAISFonte: https://www.nature.com/articles/s41541-024-00911-2