Uma pré-impressão publicada esta semana fornece evidências conclusivas de que o SPED é real – e provavelmente responsável pela COVID Longa.
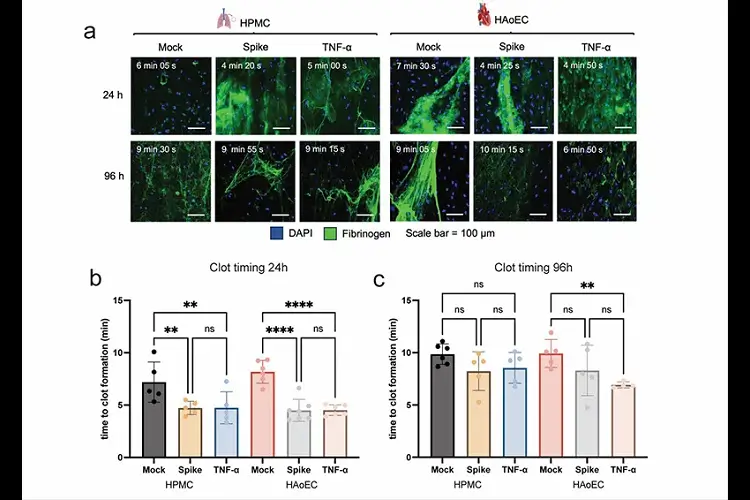
O pico do SARS-CoV-2 induz um estado pró-coagulante do endotélio humano. O pico do SARS-CoV-2 e o HPMC e HAoEC tratados com TNF-a foram perfundidos com plasma humano citratado recalcificado enriquecido com fibrinogênio marcado fluorescentemente. Imagens representativas da formação do coágulo HPMC e HAoEC 24h e 96h após o tratamento (a). O tempo para a formação do coágulo foi determinado a partir da imagem da série temporal, definido como o tempo em que a oclusão completa do canal e a formação do sinal de fluorescência saturado do fibrinogênio marcado fluorescentemente foram observadas. Tempo de coagulação para ambos os ECs em 24h (b) e 96h (c) após o tratamento. ANOVA unidirecional com comparações múltiplas foi usada para análise estatística.
Uma pré-impressão foi publicada online esta semana que mostra que a Proteína Spike do SARS-CoV-2 induz um estado de doença do endotélio. A constelação de descobertas descreve precisamente o que chamei de SPED (Doença Endotelial da Proteína Spike). Foi há quatro anos que eu hipotetizei que a Proteína Spike induziria inflamação crônica do endotélio com ativação de cascatas de coagulação e altos níveis de moléculas de adesão celular.
O artigo é um resumo das minhas descobertas nos últimos quatro anos:
Em consonância com descobertas anteriores, mostramos que as ECs tratadas com spike expressam altos níveis de marcadores de adesão celular. O aumento da expressão de ICAM1 nas ECs media o recrutamento e a fixação de leucócitos e a formação de armadilhas extracelulares de neutrófilos (NET), bem como um estado protrombótico do endotélio. De fato, mostramos que o tratamento com spike de SARS-CoV-2 desencadeou diretamente a adesão de leucócitos e aumentou o estado pró-coagulante das ECs. O ICAM1 elevado no plasma, que pode ser liberado pelo endotélio danificado, também está positivamente correlacionado com a gravidade da doença, como foi observado em pacientes com COVID-19. Além disso, ICAM1 elevado e outras moléculas de adesão de EC associadas à gravidade da doença foram descritas em doenças cardiovasculares crônicas, incluindo aterosclerose e doença cardíaca coronária. Nossos resultados também mostram que a expressão de ICAM1 parece persistir além da presença do spike de SARS-CoV-2, sugerindo um estado de inflamação sustentada das ECs. Da mesma forma, vários estudos mostraram níveis aumentados de ICAM1 no soro de pacientes recuperados de COVID-19. O ICAM1 circulante, que pode se originar do endotélio danificado, pode contribuir para a inflamação prolongada mesmo em pacientes recuperados e não mais infecciosos de COVID-19, indicando o envolvimento do endotélio no PASC.
Nossos resultados mostraram perfis semelhantes de expressão de quimiocina devido à ativação do pico do SARS-CoV-2 em EC humano aos observados em pacientes com COVID-19. Vários estudos descreveram que níveis elevados de IL-1β, IL-6, IL-8, IL-17 no plasma estão associados à gravidade da doença em pacientes com COVID-19. Portanto, as ECs podem desempenhar um papel significativo na produção de várias citocinas inflamatórias e quimiocinas que contribuem para a tempestade de citocinas e resposta inflamatória excessiva, exacerbando a doença em pacientes com COVID-19 grave. A expressão de IL-1β, CXCL1, CXCL8 e CCL20 pode contribuir para o recrutamento de neutrófilos para a superfície do endotélio, levando à formação de NET e imunotrombose. Quimiocinas como CCL8, CXCL2 e CXCL10 podem levar ao recrutamento de monócitos e macrófagos para as ECs ativadas. O aumento da expressão de CCL2 também contribui para a amplificação da ativação de monócitos e macrófagos. O recrutamento de células imunes para a superfície da EC ativada por spike pode levar à infiltração de células inflamatórias e danos adicionais ao tecido circundante, o que pode acontecer independentemente de uma infecção ativa e em diferentes regiões anatômicas. Diferentes níveis de expressão de quimiocina e dinâmica ao longo do tempo entre HPMC e HAoEC sugerem uma possível resposta específica da origem da EC. Nossa análise de RNAseq destaca ainda mais as assinaturas transcriptômicas distintas e as vias associadas à ativação do spike do SARS-CoV-2 de HPMC e HAoEC. Portanto, é necessário caracterizar respostas vasculares específicas de órgãos de órgãos que também são afetados pela COVID-19, como cérebro e rins.
Nossos dados de RNAseq destacam ainda que o pico do SARS-CoV-2 sozinho pode desencadear uma série de respostas associadas a patógenos, indução de estados pró-inflamatórios robustos, alteração do desenvolvimento de EC e apoptose, provavelmente associados aos sintomas tromboinflamatórios observados em pacientes com COVID-19. Além disso, a expressão prolongada de genes associados a vias pró-inflamatórias e apoptose pode induzir disfunção endotelial persistente e danos. O aumento prolongado observado de moléculas de adesão e apresentação de antígeno pode prolongar o recrutamento de células imunes e mediar a interação de EC com linfócitos T CD8 + e CD4 +. Além disso, a análise transcriptômica também mostrou uma interrupção prolongada da regulação das cascatas do complemento e da coagulação, refletindo um possível estado pró-trombótico sustentado e aumento de complicações cardiovasculares após a infecção por COVID-19. Vale a pena notar que não vimos mudanças significativas na ligação dos leucócitos e no tempo de coagulação em um ponto de tempo posterior in vitro, o que pode ser devido à limitação na sensibilidade do ensaio em nosso modelo. Portanto, é essencial validar as mudanças de longo prazo devido à ativação do spike do SARS-CoV-2 no EC em um estudo mais extenso, por exemplo, em modelos animais ou estudos clínicos envolvendo pacientes convalescentes de COVID-19. Além disso, estudos futuros devem considerar a avaliação das consequências da ativação do EC pelo SARS-CoV-2 além dos pontos de tempo indicados, bem como os efeitos inflamatórios vasculares de outras variantes do spike do SARS-COV-2.
Em resumo, nossos resultados forneceram uma caracterização detalhada e abrangente dos efeitos inflamatórios vasculares do SARS-CoV-2. Mostramos que o endotélio desempenha um papel essencial na determinação do resultado da infecção por COVID-19, como inflamação vascular e dano sistêmico a órgãos durante e possivelmente além da fase aguda da infecção. As estratégias terapêuticas também devem considerar a extensão dos efeitos inflamatórios do SARS-CoV-2 no endotélio vascular. Tratamentos direcionados à proteção da CE e prevenção de dano endotelial podem ser essenciais na prevenção e no gerenciamento do efeito pós-sequela da COVID-19.
Efeitos inflamatórios vasculares sustentados da proteína spike do SARS-CoV-2 em células endoteliais humanas
https://www.researchsquare.com/article/rs-5003230/v1
Não tenho alegria em estar correto. No entanto, sou grato que, por estarem corretos, aqueles que leram meu trabalho desde o começo sempre souberam que proteger o endotélio da Proteína Spike foi primordial.
Fonte: https://wmcresearch.substack.com/p/gultom-et-al-proving-spike-protein