ABSTRATO
A gama de ameaças de radiação que enfrentamos hoje inclui tudo, desde exposições individuais à radiação até vítimas em massa resultantes de um incidente terrorista, e muitos destes cenários de exposição incluem também a probabilidade de lesões traumáticas adicionais. Lesão por radiação é definida como uma exposição à radiação ionizante que induz uma série de lesões a órgãos dentro de um período de tempo especificado. A gravidade da lesão de órgãos depende da dose de radiação e da duração da exposição à radiação. Órgãos e células com alta sensibilidade à lesão por radiação são a pele, o sistema hematopoiético, o trato gastrointestinal (GI), as células espermatogênicas e o sistema vascular. Em geral, a síndrome aguda da radiação (ARS) inclui quebras de fita dupla de DNA (DSB), síndrome hematopoiética (depleção de células da medula óssea e células circulatórias), lesão cutânea, morte GI, hemorragia cerebral e esplenomegalia dentro de 30 dias após a exposição à radiação. A lesão por radiação sensibiliza órgãos e células-alvo, resultando em ARS. Entre os seus muitos efeitos na integridade dos tecidos em vários níveis, a exposição à radiação resulta na ativação das vias iNOS/NF-kB/NF-IL6 e p53/Bax; e aumenta quebras de fita simples e dupla de DNA, sinalização de TLR, concentrações de citocinas, infecção bacteriana, liberação de citocromo c da mitocôndria para o citoplasma e possível depleção de NAD e ATP dependente de PARP. Essas alterações levam à apoptose e autofagia e, como resultado, ao aumento da mortalidade. Nesta revisão, resumimos o que se sabe sobre como a exposição à radiação leva à resposta à radiação com o tempo. Também descrevemos contramedidas atuais e futuras relevantes para o tratamento e prevenção de lesões por radiação.
ANTECEDENTES
Os relatórios sobre a mortalidade na coorte de sobreviventes da bomba atómica do estudo do ciclo de vida (LSS), seguidos pela fundação de investigação dos efeitos da radiação, indicam que (1) o risco de todas as causas de morte está positivamente associado às doses de radiação; (2) a análise convencional do limiar de dose não sugere nenhum limiar; (3) o risco de mortalidade por câncer aumenta significativamente para a maioria dos órgãos principais, (4) um risco aumentado de doenças não neoplásicas, incluindo os sistemas circulatório, respiratório e digestivo, está associado aos efeitos da radiação [1]. O potencial de exposição a radiações nocivas aumentou dramaticamente desde o desenvolvimento de armas nucleares durante a Segunda Guerra Mundial. O número de nações com capacidade para produzir armas nucleares é cada vez maior. O potencial para acidentes nucleares e exposições acidentais torna-se maior com a proliferação da construção de centrais nucleares para satisfazer a crescente procura de energia que possa ser produzida em grande escala e ainda assim limpa e mais amiga do ambiente. Além disso, o uso generalizado de radioisótopos na medicina aumenta a disseminação de materiais radioativos e o potencial de exposições ocupacionais acidentais. E, claro, a possibilidade assustadoramente real de que grupos terroristas possam utilizar armas nucleares ou outras armas radiológicas representa um sério risco de vítimas em massa. O facto de mais de 50% dos pacientes com cancro receberem radioterapia em algum momento durante o curso da sua doença [2] representa outra fonte significativa de exposição, uma vez que os tecidos normais estão sujeitos a lesões por radiação.
Os responsáveis pela resposta às ameaças de radiação modelaram muitos dos seus potenciais cenários de exposição, mas na maior parte dos casos assumiram apenas a exposição à radiação como a única causa de lesões. No entanto, não é realista presumir que ocorrerão lesões acidentais por radiação na ausência de outras lesões – especialmente quando se consideram incidentes terroristas. Tornou-se bastante claro que a exposição à radiação combinada com muitos outros tipos de lesões, desde traumas a infecções, resulta frequentemente numa resposta sinérgica negativa mais prejudicial do que a soma das lesões individuais. Só recentemente começámos a apreciar as consequências práticas das lesões combinadas e a compreender que a resposta do corpo às lesões combinadas pode ser diferente das respostas à radiação ou às lesões físicas isoladamente.
Nesta revisão pretendemos resumir a nossa compreensão atual de como a resposta fisiológica à radiação é exibida em relação à radiação isoladamente ou acompanhada de outras lesões. Concentramo-nos em respostas especialmente relevantes para os efeitos na saúde: síndrome hematopoiética (lesão na medula óssea e depleção de células sanguíneas circulatórias), esplenomegalia, morte gastrointestinal, atrofia da pele, hemorragia cerebral e infecção bacteriana em órgãos a nível sistémico. Além disso, serão discutidos danos e reparos no DNA, processos de transdução de sinal, apoptose mediada por radicais livres e autofagia em nível celular e molecular. Também discutimos a eficácia potencial dos atuais medicamentos que alteram a resposta à radiação, que também poderiam ser usados para tratar ou prevenir lesões relacionadas à radiação, bem como o potencial para o desenvolvimento de novos medicamentos.
LESÃO POR RADIAÇÃO
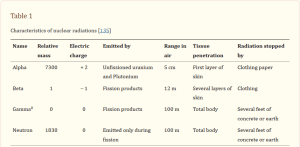
A radiação é dividida em dois grupos: radiação ionizante e radiação não ionizante. A radiação ionizante é definida como qualquer tipo de radiação eletromagnética (por exemplo, raios X ou raios gama) ou radiação particulada (por exemplo, nêutrons ou partículas alfa) que contém energia suficiente para ionizar átomos ou moléculas. Em outras palavras, a energia associada é usada para ejetar elétrons das órbitas externas de átomos ou moléculas que entram em contato com as formas de energia. Os efeitos da radiação nos sistemas biológicos dependem dos tipos de radiação ionizante que transferem a sua energia linear, uma medida da quantidade de energia transferida para uma substância à medida que a radiação passa através dela. A energia linear é classificada em dois tipos de radiação: radiações de baixa transferência de energia linear (low-LET) e radiações de alta transferência de energia linear (high-LET). A Tabela 1 resume os tipos e características físicas básicas da radiação nessas categorias. As radiações de baixo LET incluem raios gama, raios X, partículas beta; radiações de alto LET incluem nêutrons, partículas alfa e raios cósmicos de partículas pesadas [3]. As exposições à radiação que são preocupantes para a saúde humana cobrem todo o espectro LET, e a exposição pode vir de fontes externas, bem como de substâncias radioativas internalizadas (por inalação, ingestão ou contaminação de feridas).
Ao contrário da radiação ionizante, sabe-se que as fontes de radiação não ionizante incluem linhas de energia, microondas, ondas de rádio, radiação infravermelha, luz visível e lasers. A superexposição à radiação não ionizante pode resultar em problemas de saúde, embora a radiação não ionizante seja geralmente considerada menos prejudicial do que a radiação ionizante. Esta revisão cobre apenas os efeitos politraumáticos da radiação ionizante em biomoléculas, células, tecidos e órgãos.
Está bem caracterizado que uma grande dose de radiação recebida durante um curto período de tempo pode desencadear um padrão complicado de respostas fisiológicas conhecido como síndrome de radiação aguda (SRA). Os órgãos mais sensíveis à radiação incluem o sistema hematopoiético [4], o sistema gastrointestinal (GI) [5], a pele [6, 7], o sistema vascular [8, 9], o sistema reprodutivo e o cérebro [10–12]. Uma faixa de dose (1–7 Gy em humanos) de radiação ionizante representa um risco de danos ao sistema hematopoiético, levando a reduções nas contagens de células sanguíneas e plaquetas e aumento na suscetibilidade a infecções e hemorragias [13, 14] enquanto altas doses a irradiação de corpo inteiro (≥ 8 Gy em humanos) causa síndrome gastrointestinal aguda, além de complicações hematopoiéticas. Os efeitos gastrointestinais manifestam-se como perda de criptas intestinais e ruptura da barreira mucosa gastrointestinal [15]. Altas doses também podem induzir hemorragia gastrointestinal, endotoxemia, bacteremia, anorexia, náusea, vômito, diarréia e perda de eletrólitos e líquidos [16]. Na verdade, não há uma demarcação clara entre síndrome hematopoiética, síndrome GI, síndrome cutânea, síndrome imunológica ou sintoma cerebral; eles representam um continuum de danos. Há danos hematopoiéticos que influenciam os danos gastrointestinais com radiação mais alta e é provável que haja algum dano gastrointestinal reversível, mesmo em doses mais baixas de radiação, que evidentemente afetam os danos hematopoiéticos e o sistema imunológico [17].
A lesão cutânea causada por queimaduras de radiação é caracterizada pela perda da epiderme e da derme [15, 18], redução das células-tronco da pele e comprometimento da comunicação celular e da integridade cutânea, fator que pode desencadear a falência de outros sistemas orgânicos [19]. A lesão cutânea em camundongos não irradiados leva 14 dias para cicatrizar, enquanto a lesão cutânea em camundongos irradiados leva mais de 4 semanas para cicatrizar. O exame histopatológico exibe um botão de cicatrização relativamente menor, atrofia dos neutrófilos e da camada de células adiposas abaixo da derme [15].
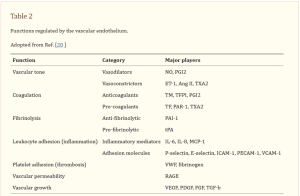
O endotélio vascular também é danificado [8]. O endotélio é uma monocamada de células endoteliais que reveste o lúmen de todos os vasos sanguíneos. Em um ser humano adulto, a superfície endotelial contém aproximadamente 1–6 × 1013 células cobrindo aproximadamente 4.000–7.000 m2. Pesa aproximadamente 1 kg [20]. O endotélio vascular regula muitas funções, incluindo tônus vascular, coagulação, fibrinólise, adesão de leucócitos (isto é, inflamação), adesão plaquetária (isto é, trombose), permeabilidade vascular e crescimento vascular. A Tabela 2 mostra moléculas envolvidas nas funções acima mencionadas [21].
NO óxido nítrico, prostaciclina PGI2, ET-1 endotelina-1, Ang II angiotensina II, TXA2 tromboxano A2, trombomodulina TM, inibidor da via do fator tecidual TFPI, fator tecidual TF, receptor 1 ativado por protease PAR-1, plasminogênio PAI-1 inibidor de ativador-1, ativador de plasminogênio tecidual tPA; Il interleucina, proteína quimioatraente de monócitos MCP-1 1, molécula de adesão intercelular ICAM-1 1, molécula de adesão de células endoteliais plaquetárias PECAM-1, molécula de adesão de células vasculares VCAM-1 1, fator VWF von Willebrand, receptor RAGE para produtos finais de glicação avançada, Fator de crescimento endotelial vascular VEGF, fator de crescimento derivado de plaquetas PDGF, fator de crescimento de fibroblastos FGF, fator de crescimento tumoral TGF-1-1
Lesões concomitantes e interdependentes em vários sistemas orgânicos podem levar à disfunção de múltiplos órgãos (MOD) e à falência de múltiplos órgãos (MOF), e a morte pode ocorrer como resultado [22–24]. No entanto, o endotélio vascular pode desempenhar um papel fundamental para ligar e desencadear o MOD e o MOF, em parte, porque está (1) presente de forma ubíqua e fornece oxigênio às células e tecidos e (2) a radiação causa perda da função da barreira endotelial, tecido edema e hipóxia tecidual [21]. Portanto, a intervenção na disfunção endotelial vascular, como a estatina [25], demonstrou ser vantajosa na prevenção, mitigação e tratamento de lesões por radiação.
Em nosso laboratório, todo o corpo de camundongos fêmeas B6D2F1 foi exposto a fótons gama de 9,5 Gy Co-60. Dentro de 4 horas após a irradiação, foi observada pela primeira vez a depleção de células da medula óssea e de esplenócitos. Vinte e quatro horas depois, as contagens de neutrófilos e linfócitos circulantes diminuíram significativamente devido à falta de neutrófilos amadurecidos e linfócitos mobilizados da medula óssea. Dentro de 7 dias, os glóbulos vermelhos e as plaquetas circulantes pareciam diminuir enquanto os glóbulos brancos continuavam a diminuir [26]. Ao mesmo tempo, bactérias sistêmicas foram detectadas na medula óssea, no sangue do fígado e no sangue do coração devido à quebra da integridade da barreira intestinal [15, 27]. Embora a medula óssea, baço, GI, cérebro, fígado e rim manifestassem uma ligeira diminuição no nível de ATP celular, ainda foram observados danos à medula óssea, baço e GI. Nos dias 11 a 20, a hemorragia cerebral apareceu no cérebro, cerebelo, ponte, mas foi observada principalmente no cerebelo [Kiang JG, Smith JT, Anderson MN, Umali MV, Ho C, Zhai M, Lin B, Jiang S., 2019, Ghrelin a terapia com G-CSF peguilado inibe lesões hemorrágicas, modifica citocinas e aumenta a produção de ATP e a fosforilação de AKT no cérebro após irradiação ionizante de corpo inteiro isoladamente ou em combinação com trauma de ferida, não publicado]. Como resultado de todas essas alterações fisiopatológicas, as causas de morte subjacentes à mortalidade aumentam. A hemorragia cerebral pode ter contribuído para a mortalidade, uma vez que todos os ratos mortos tiveram hemorragia cerebral [10] e baixo nível de ATP [28, Kiang et al., não publicado], mas os ratos sobreviventes de 30 dias (1) não tiveram hemorragia cerebral, (2) ainda exibia contagens baixas de linfócitos [29], (3) a medula óssea ainda tinha baixa celularidade [29], (4) o GI ainda não se recuperou da lesão [27], (5) o cérebro apresentava níveis celulares normais de ATP [Kiang et al., não publicado], e (6) mais importante, sobreviveram à exposição letal à radiação.