FATORES DE CONFUSÃO QUE INFLUENCIAM A GRAVIDADE DA LESÃO POR RADIAÇÃO
Muitos fatores de confusão podem influenciar a gravidade da lesão por radiação, nomeadamente, tipos de radiação, duração da radiação, taxas de dose de radiação, idades, géneros ou condições de saúde existentes. A taxa de mortalidade está positivamente correlacionada com os tipos de radiação [30, 31], doses de radiação [1, 15, 32, 33] e taxas de dose de radiação [32]. As fêmeas são consideradas mais sensíveis à radiação do que os machos. Além disso, os animais mais jovens são considerados mais radioresistentes do que os animais mais velhos [34]. No entanto, não está claro se as condições de saúde pré-existentes podem influenciar diretamente a gravidade das lesões por radiação com base nestas descobertas.
LESÃO COMBINADA
Dados coletados de eventos históricos de exposição à radiação sugerem que 60-70% das vítimas irradiadas também são frequentemente submetidas a queimaduras, como vítimas do bombardeio duplamente atômico de Hiroshima e Nagasaki, no Japão [35, 36]. Lesões combinadas foram observadas em 10% das 237 vítimas expostas à radiação e queimaduras térmicas do acidente do reator de Chernobyl [18]. Queimaduras, feridas e infecções podem resultar em mortalidade após exposições à radiação não letais em modelos animais de lesões combinadas, incluindo camundongos [15, 30, 37], ratos [38–42], porquinhos-da-índia [43], cães [44, 45] e suínos [43]. A pele exposta à radiação também atrasa o tempo de cicatrização de feridas [15, 46]. Lesões combinadas podem acelerar a mielossupressão aguda, a inibição do sistema imunológico, o desequilíbrio de fluidos, a falha da macro/microcirculação, o dano celular maciço e a interrupção das funções de órgãos vitais, agravando assim a ocorrência de disfunção e falência de múltiplos órgãos, que são as mais graves. causas frequentes de morte após lesão combinada [47–49]. Nos modelos animais experimentais, o tempo entre a irradiação e o trauma adicionado é crítico. Um único trauma seguido sequencialmente por uma irradiação apresenta menor mortalidade quando comparado a uma irradiação seguida sequencialmente por um trauma, o que resulta em mais mortalidade no modelo animal [30, 31, 50, 51]. No entanto, se o trauma adicionado ocorrer simultaneamente com a irradiação, então o modelo animal experimental ainda apresenta menos mortalidade do que a sequência de trauma anterior [52]. No entanto, Reid et al. [45] observaram letalidade semelhante independentemente da ordem dos eventos em um modelo animal que combina exposição à radiação com trauma por queimadura.
Embora se saiba que a lesão combinada geralmente exacerba a cicatrização de feridas, a perda de peso corporal, a depleção de células sanguíneas circulantes, a redução do peso do baço, as citocinas/quimiocinas circulantes e a sepse, não está claro se a lesão combinada exacerbaria o endotélio vascular.
Deve-se notar que, ao seguir os sobreviventes do bombardeio atômico e seus descendentes, o risco de todas as causas de morte está positivamente associado à dose de radiação. A dose zero é a melhor estimativa do limiar. O risco de mortalidade por câncer aumenta significativamente para a maioria dos principais órgãos [1]. No entanto, não está claro se a lesão combinada com radiação causaria maior risco de mortalidade por câncer. Embora o modo de morte por lesão combinada seja bastante claro, os eventos moleculares que podem levar à mortalidade combinada com lesão aumentada permanecem pouco compreendidos.
MECANISMOS MOLECULARES
A radiação induz a depleção de glóbulos brancos, ativa vias de transdução de sinal, aumenta a produção de citocinas e quimiocinas e aumenta a suscetibilidade à infecção bacteriana [15]. As alterações observadas após a irradiação aparecem em vários níveis – núcleo, citoplasma, tecidos, órgãos e sistema – e em vários momentos após a lesão. Se as células sobrevivem ou morrem após a radiação ionizante isoladamente ou quando combinadas com outro trauma depende do número e da gravidade das lesões orgânicas, o que determina até que ponto as vias de transdução de sinal responsáveis por desencadear a morte celular por apoptose e autofagia são ativadas.
Pesquisas recentes identificaram intermediários moleculares importantes envolvidos em lesões por radiação. Entre as muitas moléculas ativadas por lesão por radiação, a óxido nítrico sintase induzível (iNOS) e o óxido nítrico (NO) desempenham papéis importantes na apoptose induzida por lesão por radiação [53] e na autofagia [54] devido à produção de peroxinitrito por radicais livres [55]. A região promotora do gene iNOS contém motivos de muitos fatores transcricionais (56). A lesão por radiação aumenta a iNOS e seus fatores de transcrição, como o fator nuclear-κB (NF-kB) e o fator 6 semelhante a Kruppel (KLF-6), resultando no aumento da produção de NO que leva à apoptose mediada por caspases (53) e mediada por nitração de proteínas. autofagia [54]. A lesão por radiação aumenta as concentrações de interleucina-6 (IL-6), fator de necrose tumoral-α (TNF-α) e interferon-γ (IFN-γ) no sangue humano [57]; IL-1β, IL-3, IL-6 e G-CSF em sangue de camundongo [15, 58, 59]; e IL-6 e IL-8 no SNC de primatas não humanos (60). As citocinas são responsáveis por estimular o fator nuclear IL6 (NF-IL6), que subsequentemente se liga ao motivo de consenso dentro do promotor iNOS (variando de + 10 a - 300 pb a montante da caixa TATA) para ativar a expressão do gene iNOS (61). Além disso, a superprodução de espécies reativas de IL-6, NO ou nitrogênio pode causar disfunção da barreira GI [14, 62, 63], o que pode permitir que bactérias entrem em órgãos sistêmicos. Essas mudanças são bastante potencializadas pela lesão combinada por radiação [15].
DANOS E REPARO DO DNA
A gravidade do dano cromossômico é proporcional à dose de radiação absorvida. A radiação ionizante de alto e baixo LET produz diferentes tipos de danos ao DNA. A radiação ionizante de alto LET (nêutrons, partículas alfa, partículas pesadas de raios cósmicos) tem maior probabilidade de causar danos diretos ao DNA que são mais complexos e difíceis de reparar do que os danos causados pela radiação de baixo LET, enquanto a radiação ionizante de baixo LET (gama e X -raios) causa danos ao DNA principalmente indiretamente através da formação de radicais livres [64]. A exposição aguda à radiação ionizante causa danos às macromoléculas e aumenta a geração dependente de mitocôndrias de espécies reativas de oxigênio (ROS) e espécies reativas de nitrogênio (NOS), com subsequente parada no ponto de verificação do ciclo celular, apoptose e autofagia (53, 54).
A radiação ionizante induz danos nas bases, quebras de fita simples (SSBs), quebras de fita dupla (DSBs) e ligações cruzadas de DNA. DSBs são a lesão letal primária [65, 66]. Duas vias de reparo, recombinação homóloga (HR) e união final não homóloga (NHEJ) reparam eficientemente DSBs. A maioria (80–90%) do reparo de DSB envolve NHEJ [67, 68]. Em poucas horas, a irradiação ionizante induz quebras na cadeia de DNA que levam à fosforilação da ataxia telangiectasia mutada (ATM). Como resultado, a histona H2AX é fosforilada em segundos, o que é denominado γ-H2AX e é dependente da dose de radiação [69, 70]. É evidente que a formação de γ-H2AX está correlacionada com quebras na cadeia de DNA [71]. Aumentos na formação de γ-H2AX são encontrados em camundongos [72], minipigs de Gottingen [73] e primatas não humanos [74]. A formação de focos γ-H2AX foi encontrada em linfócitos do sangue periférico e cabelos arrancados, sugerindo um biodosímetro robusto para analisar a exposição parcial do corpo à radiação ionizante em humanos [74].
Em camundongos, é evidente que a lesão combinada por radiação causa uma quantidade maior de danos ao DNA do que a radiação ionizante sozinha. No entanto, estudos mostraram que células Lin+, células Lin−Sca1+c-Kit− e células Lin−Sca1−c-Kit+ produziram mais quebras de DNA após lesão por radiação do que lesão combinada por radiação [72].
ATIVAÇÃO DA VIA DE TRANSDUÇÃO DE SINAL EM RESPOSTA A DANOS NO DNA
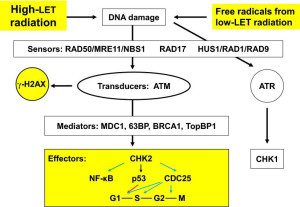
Proteínas de reparo de DNA, incluindo RAD50, MRE11, NBS1, RAD17, RAD1, RAD9 e HUS1, ligam-se a DSBs induzidos por radiação ionizante para formar complexos, que são detectados por quinases mutadas de ataxia telangiectasia (ATM). DSBs estimulam a fosforilação de ATM em minutos. O ATM fosforilado é estável por muitas horas. MDC1, 53BP, BRCA1 e TopBP1 medeiam a fosforilação de CHK2 por ATM e quinases relacionadas. O CHK2 fosforilado então fosforila p53 e CDC25. A p53 fosforilada interrompe o ciclo celular em G1 / S e o CDC25 fosforilado interrompe o ciclo celular em S e G2 / M para permitir o reparo do DNA (ver revisão # 72 e Fig. 1).
Figura 1 – Representação simplificada da resposta do ponto de verificação induzido por dano ao DNA. A radiação ionizante induz quebras no DNA. Após a detecção de um determinado dano pelas proteínas sensoras, este sinal é transduzido para a proteína efetora CHK2 através da proteína transdutora ATM. Esta ativação ATM induz a formação de γ-H2AX, usado como biomarcador para quebras de DNA. Dependendo da fase do ciclo celular em que a célula se encontra, isso pode levar à ativação do p53 e à inativação do CDC25, o que eventualmente leva à parada do ciclo celular. As proteínas mediadoras são, em sua maioria, específicas do ciclo celular e associadas a sensores de danos, transdutores de sinal ou efetores em fases específicas do ciclo celular e, assim, ajudam a fornecer especificidade de transdução de sinal. O efeito da luz UV é através da proteína transdutora ATR e da proteína efetora CHK1. MRE11 recombinação meiótica 11, NBS1 síndrome de quebra de Nijmegen 1, ATM ataxia telangiectasia mutada, ATR ataxia telangiectasia relacionada, forma fosforilada γ-H2AX da histona variante 2AX, mediador MDC1 do ponto de verificação de dano ao DNA 1, proteína de ligação 63BP p63, câncer de mama BRCA1 1, TopBP1 proteína de ligação à topoisomerase 1, verificação de CHK1 1, verificação de CHK2 2, ciclo de divisão celular CDC25 25, lacuna G1 1, síntese S, lacuna G2 2, mitose M.
ATM fosforilado pode induzir a fosforilação da variante histona H2AX na serina 139, gerando γ-H2AX (75). Ensaios imunocitoquímicos com anticorpos que reconhecem γ-H2AX tornaram-se o padrão ouro para detecção de DSBs porque existe uma relação próxima de 1:1 entre o número de DSBs e focos γ-H2AX formados. Além disso, a taxa de reparo de DSB se correlaciona com a taxa de perda de focos γ-H2AX (76). γ-H2AX desencadeia a via de transdução de sinal CHK2 que ativa p53 e CDC25. Deve-se notar que o ATM fosforilado também fosforila diretamente o p53, que ativa transcricionalmente o inibidor de CDK p21 e interrompe o ciclo celular em G1/S (77).
Evidências recentes demonstram que a fosforilação de ATM dependente de DSB ativa NF-kB (78, 79). ATM fosforilado liga-se e fosforila IKKγ no núcleo. O complexo sai do núcleo e se associa a IKKα e IKKβ. O complexo IKK libera NF-kB de seus inibidores, IκBα e IκBβ, e o NF-kB não ligado fica então livre para se mover para o núcleo e regular os genes alvo. A rede de sinalização NF-kB inclui reparo de DNA, regulação de verificação do ciclo celular, antioxidantes mitocondriais, sobrevivência e apoptose e expressão de citocinas e quimiocinas em resposta a danos induzidos por radiação ionizante [15].
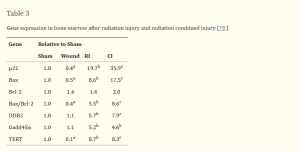
Traumas adicionais, como ferimentos, potencializam a expressão gênica induzida pela radiação ionizante. A Tabela 3 mostra que camundongos irradiados com 60Co γ apresentam aumentos na expressão dos genes p21, Bax, DDB2 e Gadd45α. Camundongos tratados com irradiação 60Co γ e traumatismo de feridas exibem aumentos adicionais em p21, Bax e DDB2, mas não em Gadd45α. Além disso, os mecanismos subjacentes a este aumento em ratos com lesões combinadas por radiação permanecem obscuros.