MUDANÇAS NA EXPRESSÃO GÊNICA ENVOLVIDA NA ADESÃO CELULAR, MATRIZ EXTRACELULAR E SINALIZAÇÃO DA MEMBRANA CELULAR
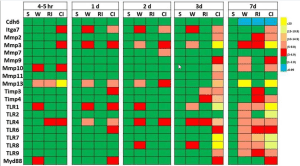
Usando técnicas de arranjo genético, mostramos que os níveis de caderina-6 (uma glicoproteína de adesão célula-célula dependente de cálcio) diminuem na pele próxima à ferida de camundongos feridos, irradiados e combinados feridos 7 dias após o ferimento e a irradiação (Tabela 4) . A inibição da caderina-6 pela integrina α-7 está elevada em camundongos lesionados combinados. As metaloproteinases de matriz (MMPs) envolvidas na quebra da matriz extracelular também estão aumentadas. Entre eles, MMP3 e MMP13 aumentam significativamente após lesão combinada mais do que após ferimento, enquanto a irradiação não induz tal aumento. No entanto, os inibidores teciduais endógenos de metaloproteinases (Timps; conhecidos por inibir MMPs) aumentam em camundongos lesionados irradiados e combinados. O gene de resposta primária de diferenciação mieloide 88 (Myd88: um transdutor de sinal envolvido na ativação de numerosos genes pró-inflamatórios) também aumenta em camundongos lesionados combinados. Acredita-se que esse aumento no Myd88, a quebra da matriz extracelular pelas MMPs e a diminuição nas moléculas adesivas célula-célula facilitem as infecções bacterianas graves que foram encontradas em camundongos lesionados irradiados e combinados. Além disso, os receptores toll-like (TLRs) nas membranas celulares também aumentam significativamente. O TLR4, cujos ligantes de ligação incluem os lipopolissacarídeos de bactérias gram-negativas, aumenta em 4 a 5 horas após a lesão combinada e permanece elevado por até 7 dias. Deve-se notar que o aumento da expressão do gene Timps é provavelmente uma resposta de autodefesa, mas ocorre tarde demais para impedir a quebra da matriz extracelular [80].
TABELA 4
Expressão gênica na pele próxima à ferida após lesão combinada por radiação e radiação [78]
A lesão combinada por radiação induz níveis maiores de expressão gênica do que a radiação isolada na pele de camundongos. Camundongos fêmeas B6D2F1/J receberam 9,75 Gy60 de radiação γ Co seguida imediatamente por 15% de trauma cutâneo na superfície corporal total. Amostras de pele foram coletadas várias vezes após tratamento simulado (Sham), ferimento (W), lesão por radiação (RI) e lesão combinada por radiação (CI). Cada grupo tinha 6 ratos. Matrizes genéticas foram usadas para quantificar a expressão gênica
Cdh6 Caderina 6, Itga7 intergrina alfa-7, metalopeptidase de matriz Mmp, inibidor de metaloproteinase Timp, receptor TLR toll-like, Myd88: resposta primária de diferenciação mieloide 88¨.
APOPTOSE MEDIADA POR RADICAIS LIVRES
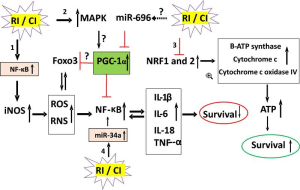
Em células de mamíferos, a radiação ionizante de baixo LET, mas não a radiação ionizante de alto LET, gera radicais livres, incluindo espécies reativas de oxigênio (ROS) e espécies reativas de nitrogênio (RNS), por meio de mecanismos mitocondriais (81, 82). Consistente com esta observação, os eliminadores de radicais livres ou o tratamento com hipóxia podem ajudar a prevenir lesões por radiação ionizante de baixo LET. Os radicais livres são necessários para a função fisiológica das células, mas a superprodução de radicais livres danifica os componentes celulares (Fig. 2). As ERO são formadas a partir da hidrólise da água no núcleo e no citoplasma. As ERO no núcleo causam danos ao DNA, enquanto as ERO no citoplasma ativam múltiplas vias de transdução de sinal envolvidas no crescimento, apoptose e autofagia [7, 15, 53, 54]. Essas lesões podem levar à parada do ciclo celular, transformação e morte celular.
FIGURA 2
RI e CI alteram mecanismos moleculares que determinam a sobrevivência. RI e CI ativam 4 vias de transdução de sinal. 1. RI e CI ativam NF-κB. NF-κB liga-se a 10 locais de motivos na região promotora do gene iNOS para transcrever e traduzir a proteína iNOS. Esta proteína catalisa a produção de NO de modo a produzir altos níveis de peroxinitrito, um radical livre para nitrar outras proteínas. O radical livre estimula o NF-κB que aumenta a concentração circulante de citocinas/quimiocinas e vice-versa. Como resultado, ocorre a morte celular. 2. RI e CI ativam MAPK que é conhecido como anti-sobrevivência. 3. RI e CI diminuem NRF1 e NRF2 de modo que a B-ATP sintase, o citocromo c e o citocromo c oxidase IV são reduzidos. Então, a produção de ATP é reduzida e ocorre a morte celular. 4. RI e CI aumentam o miR-34a que é evidente para ativar o NF-κB. Lesão por radiação RI, lesão combinada CI, proteína quinase ativada por mitógeno MAPK, fator nuclear NF-κB-keppaB, Foxo3 forkhead box O3, coativador gama 1-alfa do receptor ativado por proliferador de peroxissoma PGC-1α, fator respiratório nuclear NRF, nítrico induzível por iNOS óxido, espécies reativas de oxigênio ROS, espécies reativas de nitrogênio RNS, interleucina IL, fator de necrose tumoral TNF.
Enquanto as ROS têm vida curta e são extremamente reativas, as RNS têm vida mais longa e são mais específicas nas reações que sofrem [7]. O NO reage com o superóxido para formar o ânion peroxinitrito, resultando em estresse oxidativo [15, 55] e na liberação do citocromo c da mitocôndria para o citoplasma, bem como na subsequente conjugação do citocromo c com caspase-9 e Apaf-1 para formam apoptossomas que ativam caspase-3 e caspase-7. A caspase-3 ativada então ativa a caspase-2, -6, -8 e -10, resultando em apoptose (56).
Como a exposição à radiação ionizante combinada com traumatismo ferido ou hemorrágico aumenta a expressão do gene iNOS e os níveis de proteína iNOS, devido à ativação de NF-kB e NF-IL6 e aumento nas citocinas séricas [15, 27, 33], maior produção de ânion peroxinitrito e prevê-se mais nitração de proteínas em relação à observada apenas após a exposição à radiação. Pode-se, portanto, esperar que a apoptose ocorra em maior extensão após a lesão combinada por radiação. O ânion peroxinitrito também leva a mais autofagia mediada por LC3 (veja abaixo).
A radiação ionizante ativa as vias PI3K / AKT e proteína quinase ativada por mitógeno (MAPK) [27, 83]. A via PI3K/AKT ativa proteínas anti-apoptóticas [28, 84]. As vias MAPK incluem atividade de quinase 1/2 regulada por sinal extracelular (ERK1/2) [85], JNK [86] e p38 [87]. O primeiro é anti-apoptose, enquanto os dois últimos são pró-apoptose. É evidente que tanto a radiação isolada quanto a lesão combinada por radiação melhoram as vias da MAPK em amostras do íleo [27].
AUTOFAGIA MEDIADA POR RADICAIS LIVRES
Um crescente corpo de evidências sugere que a radiação ionizante induz a morte celular programada mediada não apenas pela família de proteínas Bcl-2 e proteases de caspases (morte celular tipo I), mas também morte celular programada dependente de autofagia tipo 2 (PCDT2) (88). O papel da autofagia induzida por radiação ionizante em células normais, especialmente nas células de tecidos sensíveis à dose, como o intestino delgado, é um assunto que requer atenção.
A autofagia (ou autofagocitose) é um mecanismo lisossomal de degradação de constituintes próprios que é conservado evolutivamente e ocorre em várias células eucarióticas (89–91). Três formas de autofagia foram distinguidas, com base em como o material intracelular é entregue aos lisossomos: autofagia mediada por acompanhantes, microautofagia e macroautofagia (92). A macroautofagia é a forma mais genérica de autofagia; em condições normais, a macroautofagia é responsável pela degradação rotineira de organelas redundantes ou defeituosas, proteínas de vida longa, grandes macromoléculas e patógenos. A macroautofagia proporciona, assim, um equilíbrio homeostático entre as atividades biossintéticas e biodegradativas e a imunidade inata. A macroautofagia é caracterizada pela formação de autofagossomos (fagóforos), nos quais porções do citoplasma são sequestradas, a carga embalada dentro de um vacúolo fechado por membrana dupla é transportada para lisossomos ou endossomos tardios para biodegradação (93, 94).
Uma das etapas cruciais deste processo de múltiplos estágios é a conversão da proteína de cadeia leve 3 tipo I (LC3-I) (também conhecida como proteína semelhante à ubiquitina Atg8) em tipo II (LC3-II) por uma serina protease Atg4 sensível a redox ou por E-1 e E-2 como enzimas Atg7 e Atg3 [95–97]. A proteína LC3 é considerada um marcador para autofagossomos (95, 96).
A macroautofagia (MAG) é induzida em resposta a certas condições, incluindo a exposição à radiação ionizante. A indução de MAG em resposta ao estresse citotóxico pode ser protetora ou prejudicial. Foi recentemente demonstrado que o PCDT2 está relacionado ao modulador de autofagia regulado por danos (DRAM), à proteína quinase associada à morte (DAPK), à eliminação massiva autofágica de mitocôndrias apoptóticas e à ativação oxidativa da serina protease Atg4, que pode ocorrer via radical livre. mecanismos ativados pela radiação ionizante. Embora as espécies de radicais livres produzidas pela radiação ionizante tenham efeitos de curto prazo, a subsequente ativação de vias pró-oxidantes, como a cascata iNOS, pode potencializar e prolongar a oxidação e, assim, estender a regulação positiva do MAG.
LC3-II é identificado em células de defesa do intestino delgado do hospedeiro, como as células de Paneth, que são consideradas relativamente resistentes à radiação e podem, portanto, ajudar a manter a barreira GI após insultos que de outra forma seriam letais. Avaliamos a dinâmica da proteína LC3 para rastrear MAG em células da cripta ileal após radiação ionizante ou lesão combinada por radiação. Descobrimos que há um aumento maior de LC3-II em células Paneth positivas para CD15 no dia 7 após lesão combinada por radiação do que após lesão por radiação isolada (80). O aumento está correlacionado com a ativação de iNOS, produção de NO, peroxidação lipídica e nitração de proteínas. A regulação positiva da autofagia é acompanhada por uma diminuição na interação proteína-proteína entre LC3, proteína de choque térmico 70 kDa e antanogene-1 associado a Bcl-2 (54).
A INFECÇÃO BACTERIANA ATIVA VIAS DE TRANSDUÇÃO DE SINAL
A superprodução de espécies reativas de IL-6, NO ou nitrogênio pode causar disfunção da barreira GI [14, 27, 62, 63], resultando na entrada de bactérias nos órgãos sistêmicos. Em nosso laboratório, coletamos sangue do coração e tecido do fígado de camundongos simulados recentemente falecidos ou sacrificados, feridos [15] ou com hemorragia [27], feridos por radiação ou feridos por radiação combinada e cultivamos o tecido para determinar se bactérias facultativas haviam entrado no circulação. Como os tecidos de animais saudáveis são normalmente estéreis (exceto bacteremia ocasional e transitória), a presença de bactérias em números detectáveis é indicativa de infecção sistêmica.
Nos camundongos tratados com simulação, nenhuma bactéria foi encontrada nos tecidos testados. Em camundongos feridos, com hemorragia e lesionados por radiação, Enterococcus sp., Staphylococcus sp. [15] e Proteus mirabilis [27] foram detectados apenas ocasionalmente. No entanto, em camundongos lesionados por radiação, Sphingomonas paucimobilis [27], Enterococcus sp., Staphylococcus sp., Bacillus sp. e Lactobacillus sp. [15] eram comuns, e as mesmas espécies bacterianas também foram isoladas do íleo. A bacteremia em camundongos que receberam apenas feridas foi transitória e esteve presente apenas até o dia 3 após o ferimento. Por outro lado, a infecção sistêmica foi demonstrada em camundongos feridos por radiação combinada até o dia 17 e esporadicamente em camundongos feridos por radiação até o dia 25. Em camundongos feridos por radiação combinada, Bacillus e Lactobacillus foram isolados nos primeiros 8 dias após a lesão combinada por radiação . Os dados [15] implicam que os ratos que receberam apenas feridas foram capazes de resistir à infecção. No entanto, a infecção sistêmica ocorreu tanto em camundongos feridos por radiação quanto em camundongos que receberam apenas radiação. Isso foi observado vários dias antes nos camundongos lesionados por radiação [15, 27].
A bacteremia induziu aumentos nas concentrações séricas de citocinas, o que promoveu ainda mais a superexpressão de iNOS, produção de peroxinitrito [55] e ativação em camundongos feridos por radiação [15]. É importante notar, ao interpretar estes dados, que a composição da microbiota luminal pode influenciar a resposta intestinal do hospedeiro à radiação e pode mudar naqueles que desenvolvem diarreia pós-irradiação [98]. Por esta razão, não é surpreendente observar variações na resposta intestinal à radiação ou à radiação combinada com traumatismo da ferida.