K Acevedo-Whitehouse, R Bruno
Resumo
Aplicações terapêuticas de mRNA sintético foram propostas há mais de 30 anos e atualmente são a base de uma das plataformas de vacinas usadas em grande escala como parte da estratégia de saúde pública para controlar a COVID-19. Até o momento, não há estudos publicados sobre a biodistribuição, captação celular, escape endosomal, taxas de tradução, meia-vida funcional e cinética de inativação de mRNA sintético, taxas e duração da expressão de antígeno induzida por vacina em diferentes tipos de células. Além disso, apesar da suposição de que não há possibilidade de integração genômica de mRNA sintético terapêutico, apenas um estudo recente examinou as interações entre o mRNA da vacina e o genoma de células transfectadas e relatou que um retrotransposon endógeno, LINE-1, não é silenciado após a entrada do mRNA na célula, levando à transcrição reversa de sequências de mRNA de vacina de comprimento total e entrada nuclear. Essa descoberta deve ser uma grande preocupação de segurança, dada a possibilidade de surgirem modificações epigenéticas e genômicas induzidas por mRNA sintético. Propomos que, em indivíduos suscetíveis, a depuração citosólica de nucleotídeos sintéticos modificados (nms -mRNAs) é impedida. A presença sustentada de nms -mRNA no citoplasma desregula e ativa elementos transponíveis endógenos (TEs), fazendo com que algumas cópias de mRNA sejam transcritas reversamente. O acúmulo citosólico de nms -mRNA e as moléculas de cDNA transcritas reversamente ativam as vias sensoriais de RNA e DNA. Sua ativação simultânea inicia uma resposta inata sincronizada contra ácidos nucleicos não próprios, estimulando a produção de interferon tipo I e citocina pró-inflamatória que, se não regulada, leva a condições autoinflamatórias e autoimunes, enquanto TEs ativados aumentam o risco de mutagênese insercional das moléculas transcritas reversamente, o que pode interromper regiões codificadoras, aumentar o risco de mutações em genes supressores de tumores e levar a danos sustentados ao DNA. Indivíduos suscetíveis teriam então, como esperado, um risco aumentado de danos ao DNA, autoinflamação crônica, autoimunidade e câncer. À luz da atual administração em massa de vacinas nms -mRNA, é essencial e urgente compreender completamente as cascatas intracelulares iniciadas pela absorção celular de mRNA sintético e as consequências desses eventos moleculares.
Palavras-chave: Autoimunidade, Autoinflamação, Dano ao DNA, Elementos transponíveis endógenos, Integração genômica, IFN, LINE-1, vacina de mRNA, nms -mRNA, TREX-1
Introdução
O mRNA exógeno foi proposto pela primeira vez em 1990 para uso em aplicações terapêuticas e preventivas. Desde então, tem havido um interesse acentuado e crescente no desenvolvimento de novas terapêuticas baseadas em RNA. As aplicações clínicas atuais de dois tipos principais de tecnologia baseada em RNA: RNA mensageiro (mRNA) e RNA interferente pequeno (siRNA) são focadas em imunoterapia contra câncer, terapia de reposição de proteínas, edição de genoma e vacinação. A ideia central que cerca essa tecnologia é simples: as aplicações baseadas em mRNA permitem a entrega de instruções genéticas para corrigir um defeito somático sintetizando a versão normal de uma proteína ausente ou alterada, ou a entrega de instruções para criar uma proteína antigênica para induzir respostas imunes específicas; enquanto as aplicações baseadas em siRNA silenciam genes relacionados à doença de uma maneira específica da sequência. Antes da pandemia da COVID-19, os únicos terapêuticos baseados em RNA que receberam aprovação clínica da Food and Drug Administration (FDA) dos EUA ou da European Medicines Agency (EMA) são quatro medicamentos de nanopartículas lipídicas sintéticas (LNP)-mRNA ou siRNA quimicamente modificados (patisiran, givosiran, lumasiran e inclisiran). Eles estão disponíveis comercialmente para tratar condições incomuns, como porfiria hepática aguda, hiperoxalúria tipo I, hipercolesterolemia familiar heterozigótica e amiloidose hereditária mediada por transtirretina.
Apesar de quase três décadas desde que foi demonstrado pela primeira vez que o mRNA poderia ser usado para gerar respostas imunes específicas contra um patógeno, antes da pandemia da COVID-19, as vacinas baseadas em mRNA para uso humano só haviam sido desenvolvidas e testadas em ensaios pré-clínicos e clínicos. Em 2020, como resultado da pandemia da COVID-19, as vacinas baseadas em mRNA foram desenvolvidas em uma velocidade sem precedentes. Em menos de um ano, duas vacinas baseadas em mRNA contra a COVID-19 foram projetadas, fabricadas, testadas e autorizadas para uso geral e generalizado na população humana. Uma situação de emergência de saúde pública pode muitas vezes justificar decisões rápidas, e algumas serão necessariamente baseadas em menos do que as informações mínimas desejáveis. No entanto, independentemente da emergência, alguns atalhos nunca devem ser cortados, particularmente aqueles que, se ignorados, podem impactar seriamente a saúde humana. Em outras palavras, mesmo as medidas de emergência de saúde pública devem atender à premissa fundamental do primum non nocere, talvez um dos principais preceitos da bioética que todos os estudantes de medicina aprendem em todo o mundo. Embora se possa argumentar que toda intervenção farmacológica preventiva ou terapêutica é uma faca de dois gumes se considerarmos cada efeito colateral potencial que pode estar associado ao seu uso, antes de consentir em receber as vacinas de mRNA da COVID-19, os receptores devem certamente ser informados sobre o que é conhecido e o que não é conhecido em termos de segurança imediata e de longo prazo. Isso foi explicitamente lembrado à comunidade médica e científica logo após a autorização da vacina, mas não foi feito sistematicamente, pelo menos não na maioria dos países.
O perfil de segurança do mRNA sintético modificado por nucleosídeo (doravante, nms -mRNA) está longe de ser completamente compreendido. Ensaios para avaliar a biodistribuição, captação celular, escape endosomal, taxas de tradução, meia-vida funcional e cinética de inativação do mRNA sintético, taxas e duração da expressão de antígeno induzida pela vacina em diferentes tipos de células, bem como potenciais interações com o genoma do hospedeiro foram ignorados. Uma das principais preocupações de segurança da introdução do nms -mRNA, como o contido nas duas vacinas de mRNA COVID-19 aprovadas, é a possibilidade de que tais modificações levem, em última análise, a modificações epigenéticas e/ou genômicas em células em divisão e não divisão. Infelizmente, apesar da falta de informações, a maioria das revisões científicas que abordam os riscos e benefícios dessas plataformas de vacinas ressaltam seus altos níveis de segurança e afirmam que não há risco de integração genômica com essas vacinas, como pode ocorrer – embora com baixa frequência – com vacinas baseadas em DNA plasmídico ou algumas vacinas vetorizadas. No entanto, deve-se entender que antes da autorização da vacina de mRNA sintético COVID-19 e do lançamento em massa, até onde sabemos, nenhum artigo publicado havia examinado experimentalmente a possibilidade de ocorrência de fenômenos epigenéticos (como modificações da estrutura da cromatina), integração cromossômica de nms -mRNA retrotranscritos, genotoxicidade e oncogênese após a absorção da vacina de mRNA. Nos 14 meses seguintes à autorização da vacina, apenas um estudo revisto por pares que conhecemos examinou uma destas possibilidades, mostrando que o nms -mRNA da vacina pode ativar a expressão de elementos transponíveis endógenos (TEs), sofrer transcrição reversa e entrar no núcleo da célula.
O relatório de consenso do início de 2020 da reunião de trabalho científico da Coalition for Epidemic Preparedness Innovations (CEPI) e da Brighton Collaboration (BC) Safety Platform for Emergency Vaccines (SPEAC) que se concentrou na redução das preocupações de segurança das vacinas contra a COVID-19 que estão sendo projetadas, não apresentou evidências de nenhum estudo sobre a potencial genotoxicidade do nms -mRNA, nem expressou qualquer preocupação sobre a falta de estudos sobre este assunto. Qual é, então, a evidência científica que sustentou a alegação de que as vacinas baseadas em nms -mRNA usadas para imunizar contra a COVID-19 não podem se inserir no genoma do hospedeiro? Qual conjunto de evidências científicas mostrou que nenhum efeito adverso relacionado à genotoxicidade ou carcinogenicidade é esperado nas células dos receptores da vacina? Uma revisão completa da literatura revisada por pares sobre a segurança da vacina de mRNA sintética mostra que todos os artigos mencionam altos níveis de segurança sem fornecer nenhuma citação, ou que fornecem uma citação para um estudo de revisão recente, que afirma que o mRNA exógeno é uma plataforma não integradora e que não há “nenhum risco potencial de [..] ou mutagênese insercional”, sem fornecer nenhuma evidência científica para apoiar esta afirmação. Na verdade, nenhum dos 38 estudos citados naquele artigo de revisão para mostrar uma lista das vacinas de mRNA disponíveis para uso pré-clínico in vivo investigou a genotoxicidade ou a oncogênese potencial. Da mesma forma, para todas as oito vacinas de mRNA que estavam passando ou haviam concluído os ensaios clínicos em humanos citados, nenhum desses estudos havia sido conduzido.
Após sua implantação inicial em dezembro de 2020, as vacinas de mRNA contra a COVID-19 foram amplamente distribuídas a indivíduos de muitos países ao redor do mundo. No momento em que este artigo foi escrito, de acordo com dados da Organização Mundial da Saúde, mais de 782 milhões de doses de vacinas de mRNA foram administradas até o momento. Se considerarmos que, de acordo com a OMS, em média, as pessoas receberam 1,69 doses dessas vacinas, então, com base no número de doses inoculadas, mais de 462 milhões de pessoas receberam entre pelo menos uma dose de uma vacina nms -mRNA. Além disso, as vacinas nms -mRNA estão atualmente em desenvolvimento para proteger contra outras doenças infecciosas e não infecciosas. À luz de uma administração tão massiva desse tipo de vacina, identificar potenciais sinais de segurança, entender os mecanismos que podem causar tais eventos e ajustar as recomendações de acordo não é apenas esperado da comunidade científica e médica, é imperativo.
A hipótese
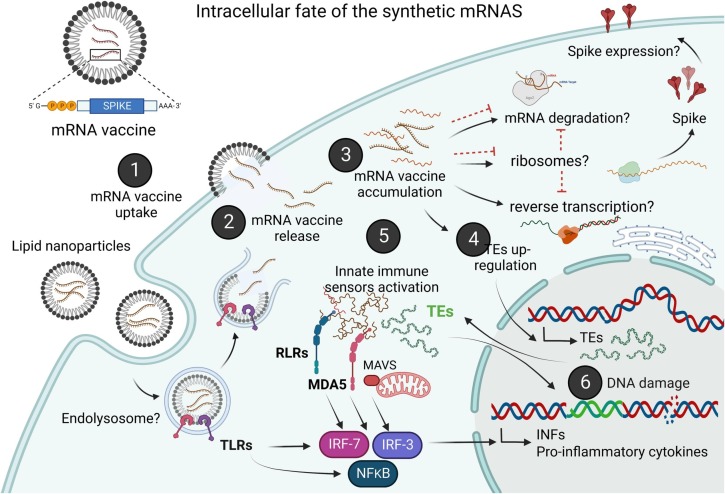
Nós hipotetizamos que em indivíduos geneticamente ou fisiologicamente suscetíveis, a depuração de nms -mRNAs é dificultada. A presença sustentada de nms -mRNA no citoplasma desregula os elementos transponíveis endógenos (TEs), levando à transcrição reversa do mRNA da vacina. O acúmulo intracelular de nms -mRNA e das moléculas de cDNA transcritas reversamente acionam vias sensoriais intrínsecas de RNA citosólico e DNA. A ativação simultânea dessas vias inicia uma resposta inata coordenada contra ambos os tipos de ácidos nucleicos não próprios, estimulando a produção de interferon tipo I e citocina pró-inflamatória que, se não regulada, leva a condições autoinflamatórias e autoimunes. TEs ativados aumentam o risco de mutagênese insercional do mRNA da vacina retrotranscrito, o que pode interromper regiões codificadoras, aumentar o risco de mutações em genes supressores de tumor e levar a danos sustentados ao DNA. Nossa hipótese é representada graficamente na Fig. 1.
Avaliação da hipótese
Reconhecimento inato e destino intracelular do mRNA sintético
Após a infecção viral, as vias de detecção intracelular que mediam a detecção imune inata de RNA estranho são receptores endossômicos do tipo Toll (TLRs) 3, 7 e 8, e receptores citosólicos do tipo RIG-I (RLRs). A família RLR compreende três membros: gene I induzível por ácido retinoico (RIG-I), gene 5 associado à diferenciação do melanoma (MDA-5) e o gene 2 do laboratório de genética e fisiologia (LGP2). Os RLRs ativados se ligam à proteína de sinalização antiviral mitocondrial (MAVS), por sua vez regulando positivamente as cinases TBK1 e IKK, que ativam os fatores de transcrição NF-κB, IRF-3 e IRF-7. Quando ativados, esses fatores se translocam para o núcleo e iniciam uma resposta potente que inclui a produção induzível de interferons tipo I (IFNs) e citocinas pró-inflamatórias. Essas moléculas regulam positivamente a expressão de vários outros genes, muitos dos quais têm efeitos antivirais marcantes, incluindo a degradação de ácidos nucleicos estranhos. Além de induzir IFNs tipo I, RLRs e MAVS também ativam a apoptose, promovendo a autodestruição da célula infectada.
O RNA viral também pode desencadear a morte celular e induzir citocinas inflamatórias, como a IL-1β, por meio da ativação do domínio de ligação ao nucleotídeo, proteínas contendo repetições ricas em leucina (NLRs) NLRP3 inflamasoma. Além disso, em certas linhagens celulares existem fatores antivirais intrínsecos celulares preexistentes, como RNASE L, a proteína quinase R dependente de dsRNA induzível por IFN (PKR), o polipeptídeo catalítico da enzima de edição de mRNA da apolipoproteína B (APOBEC3G), as proteínas contendo motivos tripartidos (TRIM) TRIM5α, Tetherin/BST-2, SAMHD1, TREX1, IFITM e as proteínas da família IFIT, que podem se ligar a componentes virais e bloquear a replicação viral diretamente, mesmo antes do início da resposta do IFN, embora a maioria desses fatores possa ser induzida ainda mais pelos IFNs para amplificar seus efeitos antivirais.
Em contraste com o RNA viral, o nms -mRNA da vacina foi modificado pela incorporação da nucleobase N1-metilpseudouridina (m1Ψ) para estabilizar e proteger da degradação da nuclease, prolongar a meia-vida citosólica, promover a ligação à pequena subunidade ribossômica e melhorar a eficiência da tradução. Se o acúmulo de nms- mRNA dentro das células pode ativar sensores citosólicos de forma semelhante ao que ocorre com o RNA viral nunca foi estudado em profundidade. Um dos poucos estudos publicados sobre este tópico mostrou que moléculas de RNA com nucleotídeos modificados interrompem a sinalização precoce da via de ativação imune inata semelhante à RIG-I, e o RNA contendo pseudouridina se liga à RIG-I, mas não consegue desencadear as mudanças conformacionais canônicas da RIG-I associadas à sinalização imune inata robusta. No entanto, é razoável supor que o nms- mRNA ainda pode induzir uma resposta imune dependente de IFN tipo I por meio do reconhecimento do receptor imune inato. O MDA-5, por exemplo, não reconhece apenas o RNA viral; ele também reconhece o RNA sintético e o RNA endógeno, e pode se ligar até mesmo a uma única fita de dsRNA. Há evidências de que a ligação de mRNA exógeno não modificado aos RLRs hospedeiros ativa vias imunes inatas que levam a um “estado antiviral” em células transfetadas com vacina, reduzindo a estabilidade intracelular e as taxas de tradução do mRNA estranho. No entanto, isso não parece ser o caso do nms- mRNA das vacinas atuais, pois agora se sabe que o ácido nucleico modificado pode ser detectado dentro dos centros germinativos dos linfonodos axilares das vacinas por pelo menos 60 dias após a inoculação.
Embora muito tenha sido aprendido sobre padrões que servem como motivos de reconhecimento para sensores intracelulares de ácidos nucleicos, ainda não há uma compreensão real do reconhecimento de nms- mRNA, contido em vacinas de mRNA atualmente disponíveis. O sinal de reconhecimento de RNA citosólico do RIG-I é um 5′-trifosfato livre. Estudos adicionais que usaram RNAs sintetizados quimicamente descobriram que uma região de pares de bases na faixa de 10 a 20 nucleotídeos proximal à extremidade 5′-trifosfato livre do ligante de RNA é essencial para a atividade imunoestimulatória via RIG-I, em vez de qualquer sequência de RNA por si só. Da mesma forma, é o comprimento do RNA e as estruturas secundárias, e não a sequência de RNA, que são considerados determinantes-chave da ativação do MDA5 e do envolvimento do adaptador de sinalização MAVS.
É possível que, em vez de ativar IFNs diretamente, os fatores de restrição celular detectem e inibam a tradução de smn -mRNAs mesmo antes do início da resposta de IFN, tornando o reconhecimento de RNA um dos primeiros gatilhos das respostas imunes inatas. Entre esses fatores de restrição estão proteínas citoplasmáticas induzidas por IFN com repetições de tetratricopeptídeos (IFIT). As proteínas IFIT podem ser expressas por vias independentes de IFN e podem reconhecer RNA viral que contém uma fração 5′-trifosfato (5′-ppp) ou não possui 2′-O-metilação. Em outras palavras, os IFITs reconhecem motivos de RNA específicos encontrados no RNA viral, mas ausentes no mRNA celular, e a ligação direta de proteínas IFIT ao RNA viral 5′-ppp inibe a tradução e replicação viral, sem a necessidade de ativação de IFN. Portanto, é razoável supor que o acúmulo intracelular e a persistência do nms- mRNA após a absorção da vacina poderiam ativar diretamente as proteínas da família MDA-5 e IFIT, entre outros sensores de RNA, iniciando uma reação imune inata orquestrada contra os RNAs sintéticos e levando a um “estado celular antiviral” crônico.
Independentemente do que se sabe sobre o reconhecimento de motivos de RNA genômico e subgenômico viral por RLRs, ainda não está claro como e por quanto tempo os nms- mRNAs interagem com sensores de RNA intracelular. O destino do nms- mRNA altamente estabilizado dentro do citoplasma é essencial para entender; mas, até agora, permanece inexplorado e não foi considerado antes da autorização de uso emergencial e aprovação de vacinas nms- mRNA para uso humano. Da mesma forma, a presença de mRNAs truncados, fragmentos curtos de dsRNA e outros contaminantes dentro das vacinas que poderiam alterar ainda mais o reconhecimento imunológico e desregular as vias de sinalização imunológica, não foi, até onde sabemos, examinada. No entanto, considerando a ampla biodistribuição de compostos de vacina de mRNA-nanolipídios, bem como a capacidade de tradução aumentada e persistência de mRNA modificado sintético, não é irracional supor que vacinas baseadas em mRNA poderiam induzir inflamação sustentada e um estado celular antiviral persistente em vários tecidos. As consequências em nível de organismo dos eventos moleculares aqui hipotetizados serão discutidas mais adiante neste artigo.
Transcrição reversa e integração genômica de RNA estranho
Acreditava-se geralmente que o genoma dos vírus de RNA não poderia se integrar ao genoma do hospedeiro. No entanto, evidências de integração de RNA viral subgenômico não retroviral na célula hospedeira foram descritas para alguns vírus, como o vírus Ebola, o vírus Marburg, o vírus da estomatite vesicular e o vírus da coriomeningite linfocítica em humanos e outros hospedeiros mamíferos, e agora acredita-se que os retrotransposons humanos podem facilitar a transcrição reversa de genomas de RNA viral não retroviral e, subsequentemente, permitir sua inserção genômica. O RNA do SARS-CoV-2 foi detectado durante meses em muitos pacientes recuperados de COVID-19 que não estavam eliminando o vírus infeccioso, e uma pré-impressão de um estudo que acompanhou uma coorte de 50 indivíduos que estavam exibindo sintomas de COVID longa após a vacinação, relatou uma descoberta semelhante. Uma explicação proposta para esse fenômeno foi que partes do genoma do SARS-CoV-2 poderiam estar passando por transcrição reversa e integração genômica dentro de células somáticas infectadas, levando à transcrição persistente das sequências integradas. Um artigo recente confirmou essa hipótese por um estudo in vitro que detectou a presença de cópias transcritas reversamente de sequências do SARS-CoV-2 em células humanas transfetadas e ao encontrar transcrição ativa dos segmentos subgenômicos integrados do SARS-CoV-2. Dado que as sequências integradas correspondiam apenas à extremidade 3′ do genoma do SARS-CoV-2, vírions infecciosos viáveis não seriam capazes de ser produzidos como resultado dessa inserção genômica, embora transcrições quiméricas do hospedeiro viral tenham sido observadas em vários tecidos de dois pacientes com COVID-19 analisados.
Ao considerar vacinas de mRNA, o paradigma atual é que o RNA sintético não pode se integrar ao genoma das células dos receptores da vacina. No entanto, um estudo recente que usou células de câncer hepático mostrou que o mRNA BNT162b2 da vacina Pfizer/BioNTech pode sofrer transcrição reversa dentro do citoplasma de células humanas e entrar no núcleo após a ativação do LINE-1, um elemento transponível genômico (TE). Os TEs genômicos, que compreendem retrovírus endógenos (ERVs), elementos nucleares intercalados longos (LINEs), elementos nucleares intercalados curtos (SINEs) e transposons de DNA, são sequências repetitivas que, quando ativadas, copiam a si mesmas ou a outras sequências e inserem essas cópias no genoma. Sendo uma fonte de instabilidade genômica, eles são principalmente reprimidos na maioria das células somáticas de mamíferos, exceto durante a embriogênese inicial, e a expressão aberrante de TEs tem sido associada a várias doenças, do câncer a distúrbios autoimunes.
Os TEs humanos estão entre os primeiros elementos do hospedeiro a serem desregulados após a entrada de um vírus em uma célula, e sua atividade aumenta significativamente a expressão do gene antiviral, particularmente a do IFN-β e IFN-γ. A atividade ocorre por meio do intensificador-promotor de ação cis ou por meio da identificação errônea de sequências de TE transcritas no citoplasma como RNA viral por sensores imunológicos inatos. Estudos conduzidos em camundongos e em humanos mostraram que, durante o curso de uma infecção viral, a expressão de ERV e LINE varia, precedendo a regulação positiva de genes antivirais, genes de resposta imune e os genes do complexo principal de histocompatibilidade (MHC), sugerindo que os TEs regulados positivamente são um componente-chave das respostas de defesa intracelulares precoces e conservadas do hospedeiro. As células também podem reconhecer aberrantemente estruturas de dsRNA adotadas pelos TEs, que se assemelham a RNAs virais, e desencadear uma resposta de IFN tipo I. Em humanos, os componentes LINE-1 podem desencadear a sinalização imune inata por meio da ativação das vias de detecção de RNA mediadas por RIG-I e MDA-5 que irão regular positivamente a expressão de IFN e iniciar respostas inflamatórias por meio da detecção de RNA estranho e regulação genética. A ativação de IFN mediada por TE desempenha um papel no desenvolvimento de doenças autoimunes caracterizadas pela ativação constitutiva de IFN tipo I, câncer e senescência celular.
Dado que Zhang et al. detectaram um sítio de reconhecimento de consenso do componente da endonuclease humana LINE-1 flanqueando ambas as extremidades das sequências genômicas integradas do SARS-CoV-2, eles propuseram que o fenômeno observado poderia ser, pelo menos em parte, devido ao envolvimento do LINE-1. O LINE-1 é altamente abundante no genoma de mamíferos, incluindo humanos, onde vem amplificando cópias por mais de 160 milhões de anos. A maioria das 500.000 cópias do LINE-1 contidas no genoma humano estão presentes como repetições truncadas ou cópias que contêm mutações que afetam a retrotransposição; no entanto, existem cerca de 150 cópias completas que são capazes de se autocopiar e transpor para outras regiões genômicas. Este efeito cis é comum em células onde o LINE-1 não é silenciado, mas também há um efeito trans, embora menos comum, que pode ser exercido pelo LINE-1, que resulta na transcrição reversa e inserção de outras sequências genéticas.
Na linha germinativa e na maioria das células somáticas dos humanos, a atividade do LINE-1 é tipicamente suprimida por diferentes mecanismos moleculares, incluindo silenciamento de genes mediado por RNA interferente pequeno (siRNA), metilação de histona e DNA e atividade enzimática de APOBEC3 e SAMHD1. No entanto, antes da implantação, a massa celular interna e as células do trofectoderma mostram inserções endógenas de LINE-1 de novo, e estudos in vitro com células-tronco embrionárias e células-tronco pluripotentes descreveram transcrição e tradução endógenas de LINE-1 que levam à retrotransposição. Isto ocorre porque durante os estágios iniciais da embriogênese, o meio celular suporta a retrotransposição ativa do LINE-1 e as células somáticas embrionárias regulam negativamente as restrições moleculares da retrotransposição do LINE-1, provavelmente porque a atividade do LINE-1 desempenha um papel fundamental na geração do mosaicismo somático. Curiosamente, em organismos pós-natais, alguns tipos de células, incluindo neurônios e células gliais, têm menos restrições à atividade do LINE-1, levando à variação do genoma somático no sistema nervoso, o que contribui para a neurogênese, mas também para doenças neuropsiquiátricas quando a atividade do LINE-1 é anormalmente alta. O LINE-1 agora também é conhecido por ser ativo em linfócitos T maduros , onde desempenha um papel no controle da quiescência e exaustão das células T.
Com base nos resultados relatados por Zhang et al., um estudo independente abordou se o mesmo fenômeno de transcrição reversa e entrada nuclear poderia ser observado para o mRNA da vacina. Usando uma linhagem de células hepáticas humanas (Huh7) e a vacina de mRNA da Pfizer/BioNTech, Aldén et al. descobriram que, de fato, o mRNA exógeno ativa ambos os ORFs da LINE-1, levando à transcrição reversa e à transposição nuclear do mRNA da vacina de comprimento total (BNT162b2) que codifica a glicoproteína Spike completa do SARS-CoV-2. A transcrição reversa ocorreu em apenas seis horas após a exposição à vacina, e o cDNA BNT162b2 transcrito reversamente entrou no núcleo da célula. A escolha de uma linhagem de células hepáticas para o experimento foi intencional: um relatório sobre a farmacocinética da vacina de mRNA da Pfizer/BioNTech revelou que a maior concentração de mRNA da vacina, perdendo apenas para o local da inoculação, foi detectada no fígado algumas horas após a inoculação, 2 revelando que o nms- mRNA ligado a nanolipídios não permanece no músculo deltoide ou nos linfonodos axilares, confirmando o que foi relatado em um estudo independente sobre a biodistribuição de nms- mRNA da vacina. Além disso, estudos de sistemas de entrega de mRNA de nanopartículas lipídicas conduzidos em ratos e camundongos mostraram evidências de hepatotoxicidade transitória, sugerindo que esse órgão pode ser uma preocupação de segurança para as vacinas de nms- mRNA. Os resultados relatados por Aldén et al. não devem ser generalizados, visto que o estudo foi feito usando uma linhagem de células cancerígenas, e o LINE-1 tende a ser transcricionalmente ativo em células cancerígenas. No entanto, a transcrição e a expressão proteica do LINE-1 foram maiores nas células cancerígenas expostas ao mRNA do BNT162b2 do que nas células cancerígenas que receberam apenas solução salina, sugerindo que a transcrição reversa e a transposição nuclear do mRNA da vacina não foram devidas ao LINE-1 já estar ativo na linhagem de células cancerígenas. Simplificando, até o momento, não há razões cientificamente válidas e biologicamente relevantes para supor que o mesmo fenômeno não poderia ocorrer em células somáticas de uma pessoa que recebe a vacina de mRNA.
Inflamação mediada por LINE-1
O silenciamento genômico do hospedeiro da expressão de TE é crítico na maioria dos tecidos não embriogênicos para evitar não apenas danos ao genoma, mas também inflamação prematura ou sustentada. A falha em silenciar a expressão do retrotransposon LINE-1 resulta em aumento da expressão de cópias específicas do locus de LINE-1 e é acompanhada por uma assinatura inflamatória associada à ativação do IFN. No entanto, como mencionado anteriormente, está se tornando cada vez mais evidente que a exposição intracelular a RNA estranho (ou seja, viral ou sintético) pode reativar TEs e cooptá-los para iniciar um “estado antiviral”. A ativação de TEs é conhecida por ocorrer em infecções por SARS-Cov-2, semelhante ao que foi observado durante infecções com outros vírus de RNA e vírus de DNA, em diferentes tipos de células e espécies hospedeiras.
TEs ativados podem estimular a expressão gênica antiviral, por meio de funções intensificadoras de ação cis ou por meio de seu reconhecimento como motivos virais por receptores de reconhecimento de padrões, como RIG-I e MDA-5, que podem detectar ssRNA, dsRNA, RNA sintético e RNA celular. Além disso, sequências de TE transcritas são capazes de formar dsRNAs que podem, por sua vez, ser reconhecidos por receptores de reconhecimento de padrões, conforme descrito anteriormente, e desencadear um estado celular antiviral e pró-inflamatório sustentado. Isso pode levar ao desenvolvimento de doenças autoimunes e autoinflamatórias. Portanto, é razoável supor que o nms- mRNA da vacina estabilizado e persistente poderia promover e sustentar a inflamação em tecidos expostos à vacina após sua biodistribuição. Um estado crônico de respostas imunes inatas ativas devido à atividade do LINE-1 ocorreria, sustentando e promovendo a transcrição reversa, a importação nuclear e a integração genômica de sequências retrotranscritas: em outras palavras, um círculo vicioso molecular com consequências clínicas sérias poderia ocorrer após o recebimento da vacina nms- mRNA, provavelmente piorando a cada dose recebida.
Danos ao DNA mediados por LINE-1 e mutações no gene p53
Dado que a transposição de sequências copiadas de LINE-1 requer a clivagem de ambas as cadeias do DNA genômico (DSB), a dessilenciação de sua atividade pode causar quebras de DNA de cadeia dupla em células da linha germinativa e somáticas. Em muitas células cancerosas, sabe-se que a atividade de LINE-1 está correlacionada com mutações de p53 e alterações no número de cópias que são essenciais para a carcinogênese, particularmente em cânceres de mama, ovário, endométrio e cólon. Outros tecidos podem ser afetados de forma semelhante. Por exemplo, um estudo da transformação de células do vírus da hepatite C (HCV) mostrou que, como resultado da inflamação sustentada da infecção crônica com HCV, a expressão de LINE-1 é ativada antes da transformação oncogênica, e que LINE-1 não silenciado contribui para a instabilidade genômica do carcinoma hepatocelular, mesmo após a depuração viral. A indução in vitro da expressão de LINE-1 aumentou a fosforilação do membro do complexo MRN RAD50, uma chave do complexo proteico catalítico para coordenar e detectar DSBs e iniciar a via de resposta a danos no DNA. Assim, LINE-1 não silenciado em tecidos somáticos que são alvos esperados da vacina (por exemplo, células dendríticas, linfonodos, células musculares) e alvos não intencionais da vacina (por exemplo, fígado, glândulas suprarrenais, baço, ovários e cérebro) poderia concebivelmente aumentar o risco de genotoxicidade e carcinogênese nesses tecidos, e dado que cópias recém-inseridas de sequências TE podem ser transmitidas a cada geração celular sucessiva e modificar o genoma humano somático, a atividade sustentada de LINE-1 a partir do mRNA persistente da vacina poderia ser importante para a carginogênese. Conforme declarado antes, o risco aumentaria concebivelmente com cada dose recebida. Esses fenômenos moleculares seriam esperados mais frequentes em células-alvo de vacinas intencionais e não intencionais com altos níveis intrínsecos de expressão de LINE-1, como células gliais, linfócitos T, células senescentes e em células com mecanismos reduzidos de reparo de danos ao DNA. A suscetibilidade seria particularmente alta para indivíduos com respostas imunes adaptativas celulares suprimidas ou subótimas, ou aqueles com doenças neuropsiquiátricas, onde a atividade de LINE-1 é anormalmente alta. Além disso, já foi demonstrado que células transfetadas com o gene Spike do SARS-CoV-2 exibem uma resposta aumentada a danos ao DNA, produção de ROS e um estado celular senescente, o que pode, por sua vez, levar à senescência parácrina em células adjacentes e disfunção endotelial. Embora os autores desse estudo tenham especulado que a duração esperadamente breve da estimulação antigênica após a vacinação pode ser insuficiente para que indivíduos vacinados apresentem efeitos semelhantes, agora se sabe que tanto o nms -mRNA quanto sua proteína codificada são viáveis e expressos por semanas, então é plausível que tais efeitos sejam, de fato, prevalentes.
Acúmulo citosólico de DNA ativa respostas pró-inflamatórias
Além do reconhecimento de RNA estranho, o DNA citosólico também pode ser detectado por uma cascata de sinalização denominada resposta de DNA estimulador de IFN (ISD). Essa via sensorial ativa uma potente produção de IFN tipo I por meio do mesmo fator de transcrição envolvido no reconhecimento de RNA estranho: fator regulador de interferon 3 (IRF3). Anteriormente em nosso artigo, descrevemos as cascatas moleculares que hipotetizamos que surgiriam do nms- mRNA citosólico persistentemente estabilizado. Agora descreveremos o destino hipotético e as consequências biológicas do acúmulo citosólico de DNA de vacina retrotranscrito.
A sintase GMP-AMP cíclica (cGAS) é o principal sensor imunológico citosólico que liga DNAs de fita dupla citosólicos de vírus, bactérias, mitocôndrias, micronúcleos, bem como DNA de retroelementos endógenos. A ativação de cGAS gera dinucleotídeo cíclico GMP-AMP cíclico (cGAMP), que, por sua vez, ativa uma resposta de interferon tipo I via estimulador de genes de interferon (STING). A sinalização STING pode desencadear a ativação transcricional de NF-κB, iniciando a síntese de citocinas pró-inflamatórias, incluindo IFNs tipo I IFN-α e IFN-β. Portanto, a via cGAS-STING medeia a defesa imunológica contra DNA estranho e contra DNA derivado de tumor. No entanto, a ativação aberrante da via cGAS-STING pelo auto-DNA vazado para o citosol ou pela falha em eliminar o auto-DNA acumulado também pode levar a doenças autoinflamatórias e autoimunes e promover a tumorigênese. É por isso que é essencial para a remoção adequada do DNA transcrito reversamente não produtivo citosólico acumulado e fragmentos derivados de retroelementos endógenos, como retrotransposons L1, retrovírus endógenos de repetição terminal longa (LTR) e elementos SINE, a fim de evitar a ativação mediada por auto-DNA de sensores de ácido nucleico que, de outra forma, aumentariam o IFN tipo I e as citocinas pró-inflamatórias.
Han e colaboradores relataram recentemente que o ORF9b do SARS-CoV-2, codificado por um ORF alternativo dentro do gene N, regula negativamente a imunidade antiviral ao inibir a ativação de IFNs tipo I e tipo III que são induzidos por vias de detecção de dsRNA citosólico da sinalização RIG-I/MDA5-MAVS, e que a infecção por SARS-CoV-2 também pode suprimir a indução de IFNs tipo I e III por TRIF e STING, que são proteínas da via de detecção de DNA citosólico e da cascata de sinalização cGAS-STING, respectivamente. Notavelmente, a via cGAS-STING foi relatada recentemente como um fator crítico de respostas aberrantes de IFN tipo I em casos graves de COVID-19, uma doença causada por um vírus de RNA, não um vírus de DNA. Dado que a compartimentação estrita do DNA celular no núcleo e nas mitocôndrias é necessária para evitar a detecção de auto-DNA, a fonte de DNA imunoestimulatório citosólico após a infecção por SARS-CoV-2 permanece desconhecida, mas pode ser explicada pela transcrição reversa conduzida por LINE-1 após a infecção. Uma explicação não mutuamente exclusiva é que a fonte de DNA citosólico em pacientes graves com COVID-19 é o DNA mitocondrial fragmentado dentro das células endoteliais vasculares causado pela disfunção mitocondrial induzida pela glicoproteína Spike do SARS-CoV-2. Quando liberado no citosol, o DNA mitocondrial fragmentado pode ativar a via cGAS–STING dentro das células endoteliais. Portanto, é razoável hipotetizar que os mRNAs da vacina transcritos reversamente que se acumularam no citosol após a ativação precoce de nms -mRNA de TEs, levam à ativação da via cGAS-STING. O DNA acumulado citosólico pode se tornar uma molécula autoimunoestimulatória levando à ativação imune inata dependente de cGAS/STING.
Polimorfismos Trex1 e o acúmulo de retroelementos endógenos podem ser a causa direta de miocardite após a recepção de vacinas de mRNA
Uma proteína amplamente expressa em células de mamíferos, a exonuclease de DNA 3′–>5′, exonuclease de reparo 3′ 1 (TREX1, anteriormente conhecida como DNase III), degrada substratos de DNA fita simples e dupla fita removendo nucleotídeos das extremidades 3′ das moléculas de DNA. TREX1 ajuda a manter a tolerância imunológica inata ao auto-DNA citosólico removendo substratos de DNA para prevenir o início da autoimunidade. Estudos mostraram que mutações em TREX1 levam ao acúmulo de auto-DNA no citosol de células deficientes em TREX1, o que, como discutido acima, desencadeia inflamação sistêmica e autoimunidade pela ativação crônica de uma resposta de interferon tipo I mediada por cGAS-STING. Exemplos de condições autoinflamatórias e autoimunes associadas a mutações TREX1 são lúpus eritematoso sistêmico, síndrome de Aicardi-Goutieres, criofibrinogenemia, lúpus frieira, encefalite Cree e vasculopatia retiniana com leucodistrofia cerebral.
A acumulação não resolvida ou excessiva de DNA citosólico ativa diretamente a via ISD, induzindo uma transcrição robusta do gene TREX1 e iniciando a produção dependente de IRF3 de IFN tipo I. Níveis aumentados de IFN tipo I são típicos de distúrbios autoimunes, provavelmente relacionados à acumulação de auto-DNA citosólico devido a uma enzima TREX1 interrompida que falha em manter a tolerância imunológica inata do hospedeiro ao auto-DNA e resulta em uma resposta imunológica inata anormal com consequências clínicas. Por exemplo, camundongos deficientes em TREX1 desenvolvem miocardite inflamatória linfocítica letal com cardiomiopatia dilatada progressiva e insuficiência circulatória, bem como alterações patológicas nos órgãos linfoides, tanto no baço quanto no timo, consistentes com uma cardiomiopatia autoimune devido a uma resposta dependente de IFN que é caracterizada por superexpressão dramática de mRNA de IFN-β no tecido cardíaco. Consistente com uma patologia autoimune, o soro de camundongos deficientes em TREX1 continha altas concentrações de autoanticorpos IgG que fortemente coravam o tecido cardíaco em ensaios de imuno-histoquímica. Os autoanticorpos coletados de camundongos deficientes em TREX1 foram capazes de se ligar a extratos de coração knockout e wild-type indistintamente, mostrando que os autoantígenos associados à miocardite inflamatória não eram específicos para os corações knockout de TREX1, e uma autorreatividade mais ampla foi observada para soros de camundongos deficientes em TREX1 mais velhos, como esperado com a disseminação de epítopos.
Essas descobertas não devem ser ignoradas à luz do número crescente de casos de miocardite aguda e miopericardite relatados em receptores da vacina de mRNA, particularmente em homens jovens após a segunda dose, o que levou o FDA a emitir um alerta sobre os riscos aumentados de miocardite e pericardite após a segunda dose de uma vacina de mRNA contra a COVID-19. Considerando que o gene humano TREX1 exibe mutações e que os polimorfismos de nucleotídeo único (SNPs) do gene TREX1 foram relacionados a resultados graves de doenças infecciosas e condições autoimunes em humanos, é possível que polimorfismos no TREX1 e em outros genes que codificam proteínas que regulam direta ou indiretamente os sensores de DNA citosólico, possam determinar a suscetibilidade às vacinas nms -mRNA, influenciar a resposta à imunização e influenciar a suscetibilidade a distúrbios inflamatórios graves, incluindo miocardite, após a vacinação de mRNA contra a COVID-19.
Teste experimental da nossa hipótese
Nossa hipótese deve ser testada experimentalmente usando um animal modelo, como o rato, com respostas imunes semelhantes a RNA e TEs estranhos, incluindo LINE-1, de humanos. Nossa hipótese também precisaria ser testada em um subconjunto de indivíduos vacinados e não vacinados, usando análise comparativa genômica de alta resolução de TE diferencialmente expressos e transcrições de genes imunes. Tal abordagem lançaria luz sobre a conexão entre os TEs e redes de regulação gênica inflamatória desencadeadas por RNA e DNA citosólicos, e contribuiria para nossa compreensão do risco genotóxico, mutagênico, carcinogênico e imunopatogênico representado pelas vacinas nms- mRNA.
As questões que precisariam ser abordadas seriam se: 1) a expressão de mRNA de TEs difere entre indivíduos vacinados e não vacinados, 2) a expressão de mRNA de TREX-1 difere entre indivíduos vacinados e não vacinados, 3) a expressão de mRNA de INFs, IRF3, marcadores de inflamossomo difere entre indivíduos vacinados e não vacinados, e 4) se autoanticorpos IgG e reatividade detectável contra tecido cardíaco são observados com maior frequência em indivíduos vacinados do que em indivíduos não vacinados.
Consequências e discussão
Argumentamos e apresentamos evidências de que os mRNAs da vacina podem causar uma cascata de respostas antivirais inatas celulares, provocando a regulação positiva de TEs endógenos, bem como a ativação de sensores de RNA e DNA por meio de vias conservadas que envolvem a produção de IFN, promovendo assim a expressão de centenas de genes alvo de IFN que podem sustentar um estado antiviral crônico dentro das células transfetadas pela vacina e células vizinhas. Também sugerimos um novo mecanismo que poderia fundamentar a resposta inata aos mRNAs nms.
Diferentes fatores do hospedeiro podem coordenar as respostas ao nms- mRNA por meio de vias sensoriais intrínsecas de RNA e DNA, e variações genéticas interindividuais, como SNPs, ou variantes de splicing de transcrições de moléculas de sinalização-chave podem dificultar a eliminação precisa de ácidos nucleicos citosólicos estranhos e próprios, levando a respostas pró-inflamatórias sustentadas reguladas positivamente e aumentando o risco de condições autoinflamatórias e autoimunes, instabilidade genômica e câncer. Portanto, a exposição e o acúmulo subsequente de nms- mRNA podem aumentar a complexidade das respostas intracelulares a ácidos nucleicos estranhos, regulando positivamente a sinalização de TEs e IFN por meio de uma via upstream independente de TLR-, RIG-I-, MDA-5, IFITs- e cGAS-STING, ainda não caracterizada. Este seria um novo paradigma em nossa compreensão das respostas celulares às aplicações terapêuticas de mRNA sintético. As modificações feitas nas vacinas nms- mRNA conferem estabilidade intracelular ao mRNA e aumentam a eficiência da tradução, mas também podem ser um determinante significativo das respostas autoinflamatórias e autoimunes se, como hipotetizado, elas ativarem TEs e outros sensores de ácido nucleico, levarem à expressão de interferon tipo 1 e citocina pró-inflamatória e afetarem a capacidade inata da célula de discriminar motivos citosólicos próprios e não próprios, interrompendo a tolerância imunológica inata do hospedeiro ao DNA próprio citosólico.
Os IFNs são sintetizados e secretados por todos os tipos de células quando seus receptores de superfície celular ou citoplasmáticos identificam padrões moleculares virais. A ativação adequada e oportuna de sensores de ácido nucleico é essencial para que o hospedeiro elimine vírus infecciosos. No entanto, o impacto do nms- mRNA nos sensores de ácido nucleico e a extensão e as consequências das respostas intracelulares a esses ácidos nucleicos persistentes ainda são desconhecidos. A indução de um estado celular antiviral sustentado por meio da regulação positiva de genes relevantes, incluindo aqueles que codificam IFN-α e IFN-β, após a vacinação com nms- mRNA, provavelmente levaria à regulação positiva crônica de uma rede de genes pró-inflamatórios que poderia predispor a condições autoinflamatórias e autoimunes. Além disso, o estado pró-inflamatório e a ativação de sensores intracelulares de RNA e DNA dessilenciariam retroelementos endógenos. Esses eventos moleculares aumentariam o risco de instabilidade genômica, cromossômica e celular e carcinogênese.
Embora modelos murinos de síndrome respiratória do Oriente Médio (MERS), SARS-CoV e influenza mostrem indução vigorosa de IFNs tipo I e -III, o envolvimento dessas citocinas em pacientes com COVID-19 é controverso. Broggi et al. descobriram que os níveis de mRNA de IFN nos swabs naso-orofaríngeos de pacientes com COVID-19 grave não diferiram daqueles de controles saudáveis. Em contraste, o fluido de lavagem broncoalveolar de pacientes com doença grave apresentou níveis elevados de citocinas inflamatórias e IFNs tipo I (IFN-α e IFN-β) e -III (IFN-λ). Isso é consistente com o envolvimento dos IFNs tipo III na resposta imune antiviral nas superfícies epiteliais durante os estágios iniciais da infecção viral e sugere atividade coordenada dos IFNs tipo I e tipo III durante a interação das respostas imunes inatas e adaptativas nas barreiras respiratórias e gastrointestinais.
Em uma análise comparativa recente das respostas imunes à infecção natural por SARS-CoV-2 versus respostas imunes à vacinação de mRNA contra COVID, o perfil fenotípico e transcricional de células imunes revelou uma regulação positiva impressionante de IFNs tipo I e tipo II em pacientes com COVID-19, mas não em indivíduos vacinados. Essas observações foram interpretadas como consistentes com a ideia de que as vacinas de mRNA anti-COVID-19 suprimem ativamente a sinalização de IFN tipo I enquanto provocam uma resposta imune adaptativa robusta. Com base nas observações de Ivanova et al. e usando relatórios de eventos adversos após a vacinação do banco de dados VAERS, Seneff et al. argumentaram que a vacinação de mRNA do SARS-CoV-2 prejudica a sinalização do IFN tipo I e pode afetar o controle regulatório da síntese de proteínas e a oncovigilância, abrindo caminho para um risco aumentado de neurodegeneração, trombocitopenia imune, miocardite, paralisia de Bell, doença hepática, supressão de respostas imunes adaptativas, diminuição do reparo de danos ao DNA e tumorigênese. Temos uma visão complementar à de Seneff et al., pois propomos que a regulação do IFN é diferente entre indivíduos vacinados com nms- mRNA e naturalmente infectados devido às diferenças nas células-alvo e nas vias de sinalização molecular que são ativadas. As superfícies epiteliais dos tratos respiratório e entérico são o principal campo de batalha para infecções naturais, enquanto a administração intramuscular, a distribuição sistêmica e o acúmulo de tecido da vacina nms- mRNA escapam das barreiras mucosas naturais, levando a sinais de detecção de perigo e detecção intracelular de DNA e RNA não próprios em um nível sistêmico. Já existem algumas evidências experimentais para isso. Após a administração intratraqueal de um análogo sintético de RNA fita dupla (poliinosina:ácido policitidílico; poli I:C) em camundongos, que estimula tanto o TLR3 quanto a via RIG-I–MDA-5 in vivo, as células dendríticas residentes no pulmão expressaram os níveis mais altos de transcrição de IFN-λ, durante as fases inicial e tardia após a administração de poli I:C. Em contraste, células epiteliais, monócitos e macrófagos alveolares expressaram IFNs tipo I e citocinas pró-inflamatórias, mas não IFN-λ, em resposta ao poli (I:C). De acordo com os dados in vivo , a estimulação in vitro de TLR7 induziu apenas a regulação positiva de citocinas pró-inflamatórias, enquanto a ativação de RIG-I e MDA-5 por meio da administração intracelular de poli (I:C) e de RNA de grampo de cabelo trifosfato (3p-hpRNA) induziu altos níveis de IFNs tipo I, mas não de IFNs tipo III, de maneira dependente de MAVS.
Propomos que a supressão ativa da produção de IFN Tipo I que foi observada em indivíduos vacinados e discutida por Seneff et al. reflete a desregulação da sinalização de IFN Tipo I desencadeada pela ativação do inflamossomo NLRP3, AIM2 ou MxA por moléculas derivadas do hospedeiro recrutadas após a detecção de indicadores endógenos de perigo ou estresse celular, como o acúmulo citosólico de mRNA sintético, produtos de clivagem de RNAs gerados pela via antiviral RNAse L ou DNAs retrotranscritos. A ativação do inflamossomo ocorre em resposta a ativadores próprios e estranhos e pode ser tanto protetora quanto prejudicial. Uma vez ativado, ele pode conduzir a imunopatologia porque a IL-1β estimula respostas de inflamação sistêmica ativando as vias de sinalização da quinase N -terminal NF-κB e c-Jun, levando a tempestades de citocinas, que são comuns em doenças inflamatórias agudas. Portanto, a ativação do inflamossomo e a produção de IL-1β são rigidamente reguladas durante a infecção viral para evitar uma resposta hiperinflamatória prejudicial. Os IFNs tipo I atuam como reguladores negativos potentes do inflamossomo NLRP3 e têm um papel duplo, tanto como agentes antivirais poderosos quanto como reguladores imunológicos homeostáticos. A ativação do inflamossomo também pode ter um papel regulador na defesa antiviral inata, prevenindo a produção de IFN mediada por cGAS-STING durante a infecção com vírus de DNA, revelando um circuito regulador no qual os IFNs tipo I inibem o inflamossomo e o inflamossomo ativado também inibe a produção de IFN tipo I.
O SARS-CoV-2 e outros coronavírus humanos podem desencadear o inflamossomo em células infectadas, e os marcadores do inflamossomo sérico estão relacionados à gravidade da COVID-19. Em células mononucleares do sangue periférico (PBMCs) de pacientes com COVID-19 moderada a grave e tecidos de pacientes post-mortem em autópsia, o inflamossomo NLRP3 foi ativado. No entanto, ainda não se sabe se as vacinas nms -mRNA também podem, direta ou indiretamente, ativar os inflamossomos de forma dependente ou independente de IFN e, após a ativação, inibir a produção de IFN tipo I e tipo III.
Até agora, a base da imunogenicidade induzida por nms -mRNA ainda não é totalmente compreendida. Por exemplo, a metilação cap 2′-O do mRNA impede o reconhecimento por proteínas de ligação ao RNA induzidas por IFN, e vários estudos abordando a questão das modificações da extremidade 5′ do RNA sintético na afinidade de ligação do RIG-I e seu impacto na ativação da sinalização imune inata sugeriram que as modificações da cap 5′ podem conduzir à sinalização IFN forte, subótima ou abolida, enquanto o impacto das modificações do RNA 5′ sintético na ativação do MDA-5 ou cGAS ainda precisa ser determinado. Precisamos urgentemente de estudos experimentais controlados para uma melhor compreensão da segurança da vacina de mRNA. Especificamente, precisamos saber se o nms- mRNA ativa diferentes sensores de ácido nucleico intracelular daqueles ativados durante infecções por SARS-Cov-2, se o nms- mRNA é detectado precoce e diretamente por sensores intrínsecos ou alvos celulares de forma dependente ou independente de IFN, e precisamos entender os mecanismos moleculares que fundamentam a regulação positiva precoce e o acúmulo citosólico de TEs como uma fonte potencial de auto-DNA imunoestimulatório, instabilidade genômica e mutagênese, devido a um aumento na transcrição reversa e integração mediadas por LINE-1. Sabe-se que células com vias de remoção de auto-DNA prejudicadas apresentam instabilidade genômica e apresentam maior risco de transformação maligna. Portanto, indivíduos com polimorfismos genéticos específicos em genes que codificam sensores de DNA, como TREX1, que são expostos ao estresse celular e estímulos inflamatórios relacionados ao nms- mRNA e ao acúmulo de DNA após a regulação positiva de TEs, podem estar em maior risco de desenvolver distúrbios inflamatórios e autoimunes graves e carcinogênese. Se for assim, então a abordagem única de vacinação em massa usando a tecnologia nms- mRNA não seria uma medida segura de saúde pública para a humanidade.
Se nossa hipótese fosse confirmada, as implicações para a saúde pública seriam surpreendentes e assustadoras no contexto da vacinação em massa contra a COVID-19 que já está ocorrendo, particularmente se o nms- mRNA entrar no cérebro, medula óssea e – se já estiver presente no vacinado – células cancerosas ou pré-cancerosas, ou se a vacina for administrada a mulheres no início da gravidez e o nms- mRNA transfetar células embrionárias. É lógico que, se nossa hipótese for comprovada como correta, qualquer outro candidato a vacina de mRNA deve ser totalmente investigado para entender o sensor citoplasmático e nuclear, fatores intrínsecos e vias de sinalização ativadas por cada 5′ Cap sintético único e combinado, conteúdo de GC, caudas poliA e modificações UTRs feitas no mRNA da vacina, a fim de elucidar completamente a extensão de seus mecanismos de sinalização de ação a jusante e os impactos potenciais na saúde. O conhecimento obtido com esses estudos será crucial para entender, além de suposições não comprovadas, a segurança das vacinas de mRNA e das terapias baseadas em mRNA na saúde humana.
RISCOS POTENCIAIS PARA A SAÚDE DA TERAPIA DE VACINA BASEADA EM MRNA UMA HIPÓTESEFonte: https://pmc.ncbi.nlm.nih.gov/articles/PMC9876036/#s0055