Protocolo clínico (páginas 67-69)
8.3.5. Exposição durante a gravidez ou amamentação e exposição ocupacional
A exposição à intervenção do estudo em estudo durante a gravidez ou amamentação e a exposição ocupacional são reportáveis à Pfizer Safety dentro de 24 horas após o conhecimento do investigador.
8.3.5.1. Exposição durante a gravidez
Uma EDP ocorre se:
- Descobriu-se que uma participante do sexo feminino está grávida durante ou após a interrupção da intervenção do estudo.
- Um participante do sexo masculino que esteja recebendo ou tenha interrompido a intervenção do estudo expõe uma parceira antes ou próximo ao momento da concepção.
- Descobriu-se que uma mulher está grávida enquanto estava exposta ou foi exposta à intervenção do estudo devido à exposição ambiental. Abaixo estão exemplos de exposição ambiental durante a gravidez:
- Um membro da família ou profissional de saúde relata que está grávida após ter sido exposta à intervenção do estudo por inalação ou contato com a pele.
por inalação ou contato com a pele.
- Um membro masculino da família ou profissional de saúde que tenha sido exposto à intervenção do estudo por inalação ou contato com a pele expõe então sua parceira antes ou próximo ao momento da concepção.
Um membro da família ou profissional de saúde do sexo masculino que foi exposto à intervenção do estudo por inalação ou contato com a pele expõe sua parceira antes ou próximo ao momento da concepção.
ELE É EXPOSTO POR INALAÇÃO OU CONTATO COM A PELE E ENTÃO EXPONDE SEU PARCEIRO POR INALAÇÃO OU CONTATO COM A PELE!!!!!!!!!!
ENTÃO, O QUE HÁ NESTES FRASCOS??????
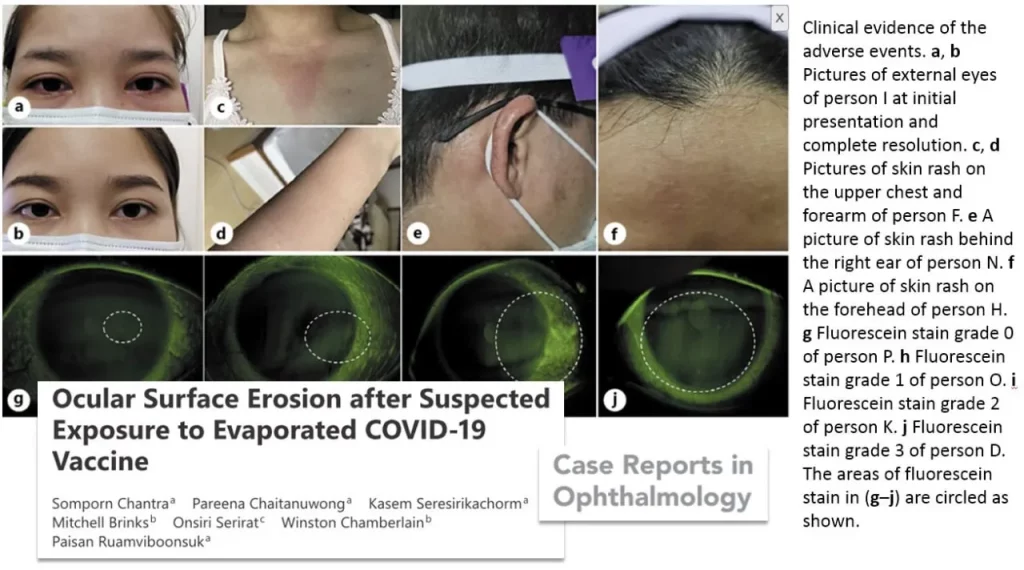
https://karger.com/cop/article/12/3/944/822388/Ocular-Surface-Erosion-after-Suspected-Exposure-to
Um total de 15 funcionários apresentaram sintomas e sinais de erosão da superfície ocular no tempo médio desde o acidente até o início de 10,2 ± 7,1 horas; 4 funcionários também tiveram erupção cutânea. Esse pessoal incluía todas as 13 pessoas que já trabalhavam nas salas quando o acidente ocorreu e continuaram por mais 4 a 6 horas e 2 pessoas que se apresentaram nas salas 1 a 2 horas após o acidente e permaneceram por 2 a 3 horas. A proximidade e o momento sugerem correlação da CoronaVac com as reações oculares e cutâneas. Devem ser tomados cuidados para evitar frascos quebrados, derramamentos e aerossolização da CoronaVac durante a vacinação.
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
- Se a EDP ocorrer no contexto de exposição ambiental, o investigador deverá relatar as informações à Pfizer Safety usando o Formulário de Relatório SAE da Vacina e o Formulário Suplementar da EDP. Como as informações de exposição não pertencem ao participante inscrito no estudo, as informações não são registradas no CRF; no entanto, uma cópia do Formulário de Relatório de Vacina SAE preenchido é mantida no arquivo do centro do investigador.
O acompanhamento é realizado para obter informações gerais sobre a gravidez e seu resultado para todos os relatórios de PDE com resultado desconhecido. O investigador acompanhará a gravidez até o término (ou até o término da gravidez) e notificará a Pfizer Safety sobre o resultado como acompanhamento do Formulário Suplementar EDP inicial. No caso de nascido vivo, a integridade estrutural do neonato pode ser avaliada no momento do nascimento. No caso de interrupção, o(s) motivo(s) da interrupção devem ser especificados e, se clinicamente possível, a integridade estrutural do feto interrompido deve ser avaliada por inspeção visual grosseira (a menos que os resultados dos testes pré-procedimento sejam conclusivos para uma anomalia congênita e o resultados são relatados). Resultados anormais da gravidez são considerados EAGs. Se o resultado da gravidez atender aos critérios para um EAG (ou seja, gravidez ectópica, aborto espontâneo, morte fetal intrauterina, morte neonatal ou anomalia congênita), o investigador deverá seguir os procedimentos para relatar EAGs.
Resultados anormais da gravidez são considerados EAGs. Se o resultado da gravidez atender aos critérios para um EAG (ou seja, gravidez ectópica, aborto espontâneo, morte fetal intrauterina, morte neonatal ou anomalia congênita)
Seguem informações adicionais sobre os resultados da gravidez que são relatados à Pfizer Safety como SAEs:
- Aborto espontâneo, incluindo aborto espontâneo e aborto retido;
Aborto espontâneo, incluindo aborto espontâneo e aborto retido
- As mortes neonatais que ocorrem dentro de 1 mês após o nascimento devem ser notificadas, independentemente da causalidade, como EAGs. Além disso, as mortes infantis após 1 mês devem ser notificadas como EAG quando o investigador avaliar a morte infantil como relacionada ou possivelmente relacionada com a exposição à intervenção do estudo.
As mortes neonatais que ocorrem dentro de 1 mês após o nascimento devem ser notificadas, independentemente da causalidade, como EAGs. Além disso, as mortes infantis após 1 mês devem ser notificadas como EAG quando o investigador avaliar a morte infantil como relacionada ou possivelmente relacionada com a exposição à intervenção do estudo.
Informações adicionais sobre o EDP poderão ser solicitadas pelo patrocinador. O acompanhamento adicional dos resultados do nascimento será tratado caso a caso (por exemplo, acompanhamento de bebês prematuros para identificar atrasos no desenvolvimento). No caso de exposição paterna, o investigador fornecerá à participante o Formulário de Divulgação de Informações para Parceira Grávida para entregar ao seu parceiro. O investigador deve documentar nos documentos de origem que a participante recebeu o Formulário de Divulgação de Informações para Parceiro Grávido para fornecer ao seu parceiro.
atrasos no desenvolvimento
8.3.5.2. Exposição durante a amamentação
Uma exposição durante a amamentação ocorre se:
- Descobriu-se que uma participante do sexo feminino está amamentando enquanto recebe ou após interromper a intervenção do estudo.
- Descobriu-se que uma mulher está amamentando enquanto está exposta ou foi exposta à intervenção do estudo (isto é, exposição ambiental). Um exemplo de exposição ambiental durante a amamentação é um membro da família ou profissional de saúde que relata que está amamentando após ter sido exposto à intervenção do estudo por inalação ou contato com a pele. O investigador deve relatar a exposição durante a amamentação à Pfizer Safety dentro de 24 horas após o conhecimento do investigador, independentemente de ter ocorrido um EAG. As informações devem ser relatadas por meio do Formulário de Notificação de SAE de Vacina. Quando a exposição durante a amamentação ocorre em ambiente de exposição ambiental, as informações de exposição não pertencem ao participante inscrito no estudo, portanto as informações não são registradas no CRF. No entanto, uma cópia do Formulário de Relatório de SAE da Vacina preenchido é mantida no arquivo do centro do investigador. Um relatório de exposição durante a amamentação não é criado quando um medicamento da Pfizer aprovado especificamente para uso em mulheres que amamentam (por exemplo, vitaminas) é administrado de acordo com o uso autorizado. Entretanto, se o bebê apresentar um EAG associado a tal medicamento, o EAG será relatado juntamente com a exposição durante a amamentação.
8.3.5.3. Exposição profissional
Uma exposição ocupacional ocorre quando uma pessoa recebe contato direto não planejado com a intervenção do estudo, o que pode ou não levar à ocorrência de um EA. Essas pessoas podem incluir prestadores de cuidados de saúde, familiares e outras funções envolvidas nos cuidados do participante do ensaio.
O investigador deve relatar a exposição ocupacional ao Pfizer Safety dentro de 24 horas após o conhecimento do investigador, independentemente de haver um SAE associado. As informações devem ser relatadas por meio do Formulário de Notificação de SAE de Vacina. Como as informações não pertencem a um participante inscrito no estudo, as informações não são registradas no CRF; no entanto, uma cópia do Formulário de Relatório de Vacina SAE preenchido é mantida no arquivo do centro do investigador.
SE APENAS A INALAÇÃO OU O CONTATO COM A PELE COM A “INTERVENÇÃO DO ESTUDO” PODE LEVAR A EFEITOS ADVERSOS, COMO ESTAS INJEÇÕES PODEM SER CONSIDERADAS SEGURAS PARA MULHERES GRÁVIDAS OU AMAMENTANDO, OU PARA BEBÊS??????
https://www.sciencedirect.com/science/article/pii/S2451929416300602


Nós e outros observamos múltiplas respostas celulares estimuladas por GO ocorrendo na escala temporal de algumas horas, como vacuolização, permeabilização de 23 PM, agitação e fragmentação de 23 PM e endocitose do receptor de PM. As respostas inflamatórias e necrose baseadas em receptores Toll-like induzidas por GO ocorrem em um tempo de incubação muito mais longo e provavelmente estão ligadas às respostas de curto prazo mencionadas anteriormente de interrupção de PM.21,22 A progressão temporal das respostas celulares estimuladas por GO fornece uma pista para descobrir a base molecular desses fenômenos. Estudos futuros se concentrarão na compreensão dos mecanismos celulares subjacentes a essa fragmentação da membrana e como os comportamentos anômalos da membrana se relacionam com a sinalização alterada da membrana, motilidade celular, adesão, polaridade e outros processos celulares.7,25,26,45 Nossas descobertas revelam mamíferos anteriormente não descritos respostas celulares a este nanomaterial estranho; embora não sejam citotóxicos, provavelmente refletem estresse ambiental.
Estas experiências coletivas questionam a biocompatibilidade do GO e advertem contra assumir a sua segurança em aplicações biomédicas ou ambientais com base na sua baixa citotoxicidade.
PARE O CRIME!!!
