Observando mais de perto os mecanismos da MEC e do câncer, a proteína Spike pode estar iniciando o câncer e hiperacelerando o que já está lá.
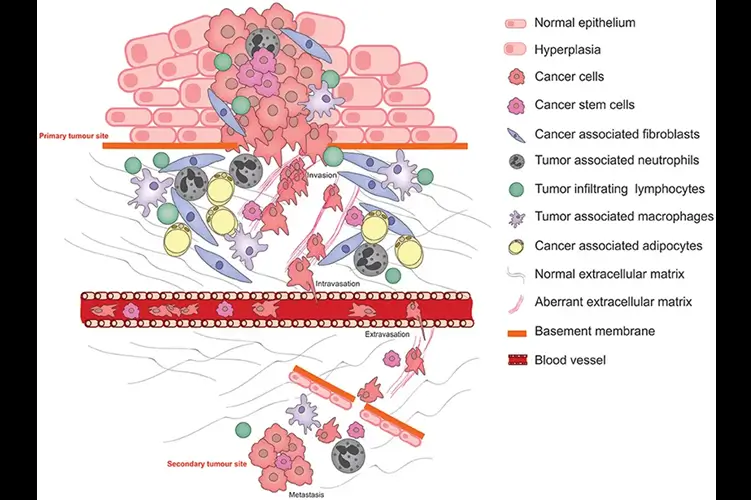
Esquema ilustrando os processos fisiopatológicos que exploram a plasticidade das células cancerígenas durante a progressão, invasão e metástase do tumor.
A explosão de turbocânceres se tornou uma grande preocupação, não apenas na comunidade médica, mas também para a população em geral. Quase todos nós infelizmente já estamos familiarizados com a notícia de que um amigo ou membro da família morreu de um caso de câncer hiperagressivo (turbo). Este não era um caso tão comum antes do surgimento da Proteína Spike.
Os leitores deste Substack sabem que recentemente detalhei como a Proteína Spike continua sua jornada patológica após invadir o endotélio, invadindo então a matriz extracelular. Descrevi várias consequências disso, focando principalmente na fibrogênese.
Eu toquei no assunto dos turbocânceres, indicando o ciclo de feedback entre fibroblastos e células cancerígenas. No entanto, como isso ocorre? A resposta parece ser a Proteína Spike interferindo com componentes da MEC – e criando hiperinflamação.
Primeiro, vamos observar como a proteína Spike não interage apenas com o endotélio, mas também com a MEC (fibronectina).
Então, não só temos uma resposta inflamatória descontrolada da interação do Spike com a fibronectina, mas também podemos determinar outra função deletéria da interação. Observe como o Spike interage com a região CS1 da fibronectina. Por que isso é importante? Porque esse peptídeo inibe ativamente as metástases tumorais! Essa é uma peça importante do quebra-cabeça da explosão do turbocâncer.
O segmento de conexão 1 (CS-1) é um domínio de ligação celular localizado no segmento de conexão de homologia tipo III (IIICS) da fibronectina. O peptídeo CS1 da fibronectina, que não possui o domínio contendo Arg-Gly-Asp, inibe ativamente as metástases tumorais em modelos de metástase espontânea e experimental. O uso do peptídeo CS1 da fibronectina pode oferecer uma abordagem terapêutica promissora para combater e prevenir a metástase do câncer.
Peptídeo de Fibronectina CS1
https://www.genscript.com/peptide/RP10838-Fibronectin_CS1_Peptide.html
Então temos o componente inflamatório. A inflamação crônica certamente está ligada à iniciação do câncer. Observe a presença das muito familiares citocinas induzidas por Spike IL-6 e TNFa.
A inflamação que pode promover o início do câncer é induzida e existe muito antes da formação do tumor [112]. DII, hepatite crônica, gastrite induzida por Helicobacter ou inflamação da bexiga induzida por esquistossomose estão correlacionadas com um risco aumentado de câncer colorretal (CCR), câncer de fígado, estômago e bexiga, respectivamente [113]. A inflamação crônica responde a um dos principais fatores predisponentes reconhecidos para o início do câncer, que é o acúmulo de mutações em células saudáveis [114]. Notavelmente, células inflamatórias como neutrófilos e macrófagos são os principais produtores de espécies reativas de oxigênio (ROS) e espécies intermediárias de nitrogênio reativo (RNI), que aumentam a mutagênese, predispondo ao acúmulo de mutações em tecido normal [112]. Por exemplo, a inflamação intestinal crônica está correlacionada com o acúmulo de mutação em Tp53 ou outros genes relacionados ao câncer em células epiteliais intestinais [115,116,117,118]. As citocinas inflamatórias também estão correlacionadas com mutações predisponentes ao câncer. A IL-22 induz a expressão de genes de resposta a danos no DNA para reparar o insulto genotóxico causado pela inflamação [119]. Outras citocinas de sinalização, como IL-6, TNF-α e IL-1, ativam a maquinaria epigenética em células epiteliais, incluindo componentes de modificação de histona de DNA (Dnmt1, Dnmt3, DOTL1), miRNA e lncRNA, modulando os níveis de expressão de oncogenes e supressores de tumor [120].
O Estudo da Matriz Extracelular na Inflamação Crônica: Uma Forma de Prevenir o Início do Câncer?
https://pmc.ncbi.nlm.nih.gov/articles/PMC9741172/#sec3-cancers-14-05903
Além disso, a ECM, é claro, sinaliza células em órgãos aos quais está conectada. Isso resulta em desregulação da transcrição que pode levar ao desenvolvimento de câncer. Especialmente quando você tem sinalização induzida por hiperinflamação.
Portanto, poderíamos imaginar que a sinalização controlada pela ECM deveria levar ao controle da transcrição genética. No entanto, a disponibilidade de sequências de DNA às quais os fatores de transcrição se ligam pode ser determinada pelo ambiente nuclear local, portanto, potencialmente tornando a organização nuclear a pedra angular do controle da expressão genética. A resposta para esse dilema de poder pode estar na matriz celular que fornece uma maneira de imaginar a contribuição integrada da ECM e da organização nuclear para o controle da expressão genética.
Contribuições da sinalização da matriz extracelular e da arquitetura do tecido para os mecanismos nucleares e organização espacial do controle da expressão gênica
https://pmc.ncbi.nlm.nih.gov/articles/PMC2728154/#S7
Então, podemos agora entender como a Proteína Spike induz câncer através da ECM. Afinal, a hiperinflamação aguda grave pode ter o mesmo efeito na carcinogênese que a inflamação prolongada de baixo nível. Mas, e os cânceres existentes?
É aqui também que a Proteína Spike desempenha um papel crucial no início recente de turbocânceres. A Spike hiperacelera o que já está lá ao interagir com a ECM. É importante entender por quanto tempo um tumor pode existir antes de ser detectado.
Para exemplificar um cenário realista no qual o biomarcador é eliminado por células cancerígenas e não cancerígenas, preparamos o modelo com base no crescimento do tumor ovariano e nos dados de eliminação de CA125, para os quais os parâmetros de crescimento do tumor e as taxas de eliminação estão prontamente disponíveis na literatura publicada. Descobrimos que um tumor pode crescer despercebido por mais de 10,1 anos e atingir um volume de cerca de π/6(25,36 mm)3, correspondendo a um diâmetro esférico de cerca de 25,36 mm, antes de se tornar detectável pelos atuais ensaios clínicos de sangue.
Modelo matemático identifica estratégias e limitações de detecção precoce de câncer com base em biomarcadores sanguíneos
https://www.science.org/doi/10.1126/scitranslmed.3003110
Sim, você leu corretamente. Mais de dez anos. Portanto, não é surpreendente que a Proteína Spike possa “arrancar” esses microtumores existentes e fazê-los “florescer”. Criei um gráfico anos atrás quando vi a Proteína Spike causando metástases, mas ainda não tinha definido completamente os mecanismos. Era uma imagem satírica do alimento vegetal Miracle-Gro – editada para ser para tumores em vez de plantas.
Continuarei trabalhando em terapêuticas para combater esses efeitos patológicos da Proteína Spike. Quanto mais entendermos, mais poderemos mitigar. Obrigado, como sempre, por sua leitura, diálogo e apoio.
Fonte: https://wmcresearch.substack.com/p/turbocancers-a-secondary-manifestation